高压液相色谱-质谱法和高效液相色谱法分析籽瓜中环磷酸腺苷
席冬华,高 晶,彭新媛,王 倩,李 玲,吴 斌,*
(1.新疆大学化学化工学院,新疆 乌鲁木齐 830046;2.新疆大学理化测试中心,新疆 乌鲁木齐 830046;3.新疆农业科学院农产品贮藏加工研 究所,新疆 乌鲁木齐 830091)
高压液相色谱-质谱法和高效液相色谱法分析籽瓜中环磷酸腺苷
席冬华1,高 晶2,彭新媛1,王 倩3,李 玲1,吴 斌3,*
(1.新疆大学化学化工学院,新疆 乌鲁木齐 830046;2.新疆大学理化测试中心,新疆 乌鲁木齐 830046;3.新疆农业科学院农产品贮藏加工研 究所,新疆 乌鲁木齐 830091)
采用高压液相色谱-质谱法鉴定籽瓜中的环磷酸腺苷,并建立高效液相色谱法测定籽瓜 中环磷酸腺苷的含量,对样品提取条件进行优化。结果表明:环磷酸腺苷在0.1~100 mg/L质量浓度范围内线性关系良好,相关系数为0.999 9;平均加标回收率为98.40%,相对标准偏差为3.22%。经单因素试验和正交试验,确定优化的提取条件为料液比1∶12(鲜样)和1∶60(干样)水提取,提取温度90 ℃、提取时间40 min、提取次数3 次。样品前处理和分析方法准确、简便、可靠、重复性好,可用于籽瓜中环磷酸腺苷含量的分析测定。
籽瓜;环磷酸腺苷;高压液相色谱-质谱法;高效液相色谱法
环磷酸腺苷(cyclic adenosine-3’,5’-monophosphate,cAMP)是核苷酸的衍生物,蛋白激酶致活剂,被称为“生命第二信使”(激素为第一信使),广泛存在有机体中的一种具有生理活性的重要物质。医学研究证明有40多种疾病与cAMP的代谢有关,包括癌症、高血压、冠心病、心肌梗塞和心源性休克[1]和帕金森综合症[2]等重大疾病。cAMP可以通过化学合成、微生物发酵、天然产物分离提取等方法获得。化学合成cAMP的方法[3]存在化学试剂不能完全去除的隐患和环境危害;微生物发酵cAMP方法培养周期长,产物中可能含有菌体代谢产物[4];而天然产物提取的cAMP具有绿色,无毒副作用等特点,具有较高的商业开发价值,从富含cAMP的植物源组织中分离检 测cAMP是当今研究热点之一[5]。
目前,分析cAMP的方法主要有纸色谱法、薄层色
谱法[6]、竞争结合蛋白分析法[7]、高效液相色谱(high performance liquid chromatography,HPLC)法[8-9]、液相色谱-质谱(liquid chromatography coupled to tandem mass spectrometry,LC-MS-MS)法[10-12]、亲水色谱-二极管阵列检测器-电喷雾四极杆飞行时间质谱法[13]等。高效液相色谱法具有分析时间短、分离度好、灵敏度高、操作简便的特点,近几年来得到迅速发展[14]与广泛应用。已有大量文献报道用HPLC法测定不同地区[15-16]、不同品种枣果[17-20]中的cAMP含量,但对籽瓜瓜皮和瓜瓤中cAMP的研究报道很少。
籽瓜(又称打瓜)是葫芦科西瓜属普通西瓜的栽培变种,极具地域特色,中国籽瓜种植面积和产量均居世界之首,新疆是我国籽瓜主产区之一。目前,对籽瓜的利用只是做到了取籽加工,瓜籽只占鲜瓜质量的3%~5%,其余约占瓜质量95%以上的部分都作为废物而被丢弃[21],造成极大的资源浪费。本实验通过建立检测籽瓜中cAMP含量的HPLC法,为籽瓜资源的深加工提供技术支持,也为植物源cAMP的研究与应用提供新的原料来源。
1 材料与方法
1.1 材料与试剂
籽瓜(品种:黑大片) 新疆昌吉垦区;cAMP标准品(纯度≥99%) 北京百灵威化学技术有限公司;甲醇(色谱纯) 霍尼韦尔贸易(上海)有限公司;磷酸二氢钾、甲醇(分析纯) 天津市福晨化学试剂厂;实验室用水均为高纯水(≥18 MΩ·cm)。
1.2 仪器与设备
1260型HPLC仪(配有可变波长紫外检测器、示差折光检测器和EZChrom Elite工作站) 美国安捷伦公司;Quattro Premier XE高压液相色谱-质谱仪(配有电喷雾离子源及MassLynx4.1软件操作系统) 美国Waters公司;DZG-303A“艾柯”实验室专用超纯水仪 成都唐氏康宁科技发展有限公司;Himac CR-20B2型高速冷冻离心机 日本日立公司;IKA A11基本型研磨机 广州仪科实验室技术有限公司;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;电热恒温水槽 上海精宏仪器设备有限公司。
1.3 方法
1.3.1 标准溶液的配制
精确称取0.020 0 g cAMP标准品,用高纯水溶解并定容至100 mL棕色容量瓶中,该储备液质量浓度200 mg/L,再依次配制成0.1、1、10、50、100 mg/L一系列不同质量浓度的标准工作溶液,过0.22 μm滤膜后进样。
1.3.2 水浴法提取cAMP
将籽瓜清洗、纵切、手动去籽、去表皮、分离瓜皮和瓜瓤、分别冷冻、粉碎、真空干燥、保存在-80 ℃冰箱。准确称取一定质量籽瓜冷冻样品,放入50 mL圆底烧瓶中;1)籽瓜冷冻鲜样以料液比为1∶12 (g/mL)加入高纯水摇匀后,在90 ℃条件下恒温水浴40 min;2)籽瓜干样以料液比1∶60 (g/mL)加入高纯水摇匀后,在90 ℃条件下恒温水浴40 min。分别提取2 次合并提取液10 000 r/min离心20 min,取上清液过0.22 μm滤膜后直接注入进样品以供分析。
1.3.3 高压液相色谱-质谱条件
色谱条件:Acuity C18(50 mm×2.1 mm,1.7 μm);流动相:乙腈-0.1%甲酸(10∶90,V/V)溶液等度洗脱;流速0.3 mL/min;柱温40 ℃;进样量10 μL。
质谱条件:毛细管电压3.0 kV;脱溶剂温度350 ℃;锥孔气流50 L/h;干燥气为氮气,气流量为650 L/h;碰撞气体氩气;气体流量0.18 mL/min;电喷雾离子源;正离子模式扫描;多反应检测(multiple reaction monitoring,MRM)方式检测。其他参数见表1。
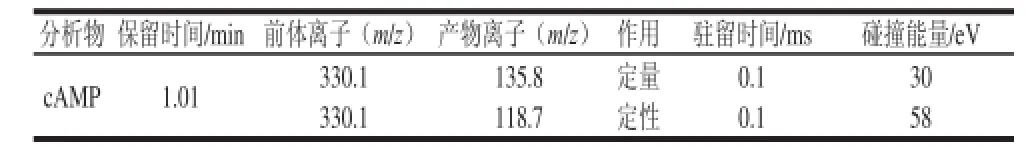
表1 检测cAMP的质谱条件Table 1 MS conditions for the detection of cAMP
1.3.4 高效液相色谱条件
色谱柱:Platisil ODS C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.05 mol/L磷酸二氢钾(15∶85,V/V);流速1 mL/min;柱温30 ℃;检测波长259 nm;进样量20 μL。
1.3.5 提取条件优化
在提取温度90 ℃,提取时间30 min条件下,选取料液比(g/mL):鲜样:1∶4、1∶6、1∶8、1∶10、1∶12;干样:1∶10、1∶20、1∶30、1∶40、1∶50、1∶60。在料液比1∶6(鲜样)和1∶40(干样),提取时间30 min条件下,选取提取温度:60、70、80、90、95、100 ℃。在料液比1∶6(鲜样)和1∶40(干样),提取温度90 ℃条件下,选取提取时间:10、20、30、40、60 min。在料液比1∶6(鲜样)和1∶40(干样),提取温度90 ℃,提取时间30 min条件下,选取不同提取次数:鲜样: 1、2、3 次;干样:1、2、3、4 次。
2 结果与分析
2.1 籽瓜中cAMP的鉴定
对1 mg/L cAMP标准物质进行一级全扫描和子离子扫描,确定cAMP的前体离子和产物离子,选择2 个丰度较高、干扰较少的子离子作为定性离子和定量离子,其MRM色谱图如图1A所示。将籽瓜瓤样品按样品处理方法处理稀释后,进样10 μL,得到MRM色谱图如图1B所示。
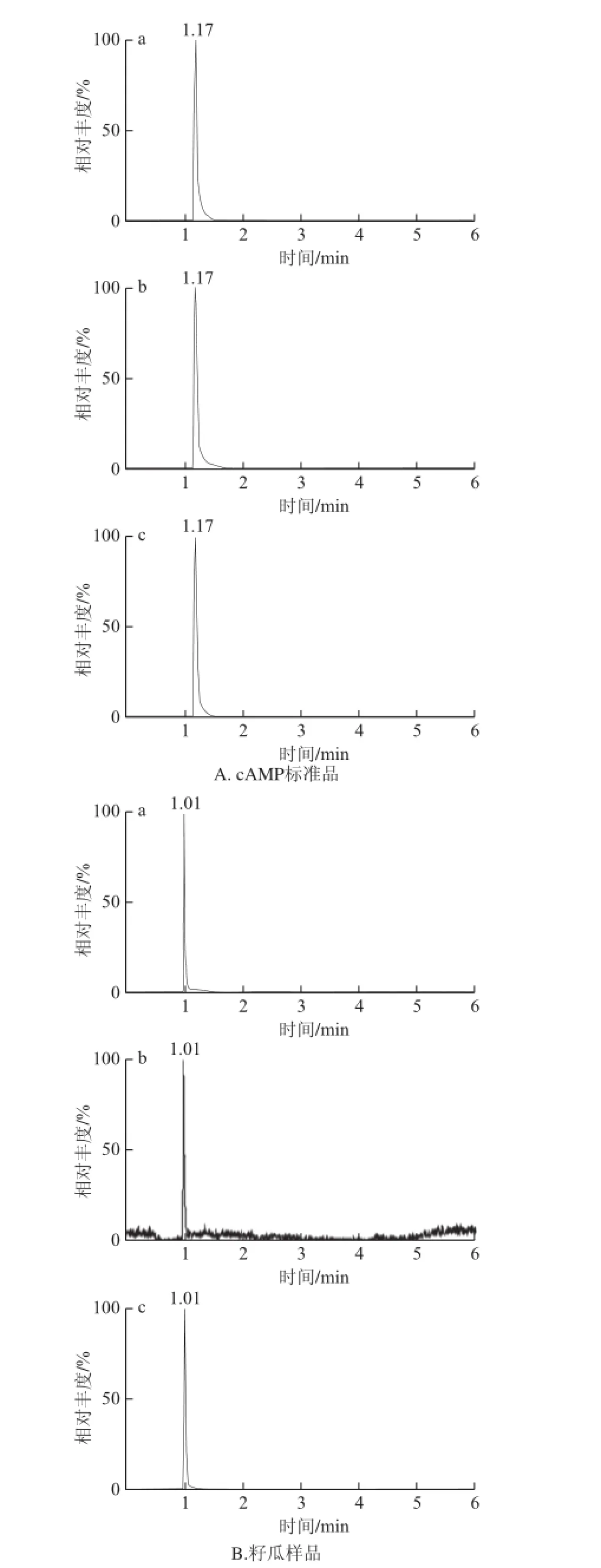
图1 cAMP标准品和籽瓜样品MRM色谱图Fig.1 MRM chromatogram of cAMP standard solution and seeding watermelon sample
由图1可以看出,籽瓜样品中目标物质的峰与cAMP标准品的峰保留时间在误差范围内,选择的特征离子的保留时间及丰度之比与标准品的一致,确定目标物质为cAMP,该方法鉴定了籽瓜样品中含有cAMP。
2.2 cAMP提取条件优化
纯水作提取溶剂时cAMP的提取量较高[13],故本实验用高纯水作提取剂。影响cAMP提取量的主要因素有料液比、提取温度、提取时间和提取次数。以cAMP的提取量为指标,采用单因素分析法对水浴提取参数进行优化。
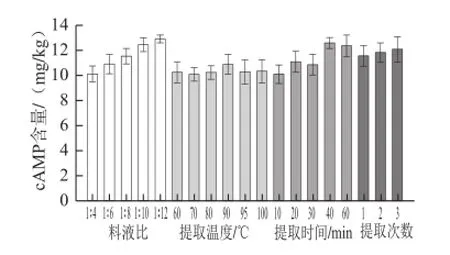
图2 籽瓜鲜样提取条件优化图Fig.2 Optimization of extraction conditions for flesh seeding watermelon
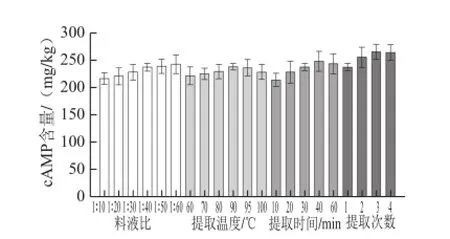
图3 籽瓜干样提取条件优化图Fig.3 Optimization of extraction conditions for dry seeding watermelon
由图2、3可知,提取液使用量越大,提取量越高,但提取液使用量过高,cAMP的质量浓度越低,质量浓度太低会增加cAMP分离提取工作的负担[22],料液比选择1∶12(鲜样)、1∶60(干样)。提取温度达到90 ℃时提取量较高,提取温度选择90 ℃。cAMP的含量随提取时间延长有较明显提高,当提取时间为40 min时,cAMP含量达到最大,随着提取时间的延长,提取量开始降低,可能由于提取时间过长,杂质溶出,影响了cAMP的提取[23],故选择提取时间为40 min。不同提取次数对鲜样中cAMP含量影响较小,干样在提取3 次后提取量变化不明显,鲜样可提取2 次,干样提取3 次。
2.3 cAMP提取因素的正交优化
从以上单因素试验可以看出,提取量受料液比、提取温度、提取时间和提取次数4 个因素影响。为全面考察这4 个因素的作用大小和优化组合,设计了L9(34)正交试验。结果及数据处理见表2和表3。
由表2可知,影响籽瓜鲜样中cAMP提取率的主次因
素为A>D>C>B,即料液比为最主要因素,提取温度、提取时间和提取次数均为次要因素。从各因素极差分析结果得出最佳提取条件为A3B2C2D3,由正交试验可知,最优组合为A3B2C1D3,通过验证实验确定提取工艺组合为A3B2C2D3,由于提取次数对鲜样中cAMP提取量影响较小,最终确定提取工艺为料液比1∶12、提取温度90 ℃、提取时间40 min、提取次数3 次。
由表3可知,影响籽瓜干样中cAMP提取率的主次因素为D>A>C>B,即提取次数是最主要因素,料液比、提取温度和提取时间均为次要因素。从各因素极差分析结果得出最佳提取条件为A3B2C2D3,由正交试验可知,最优组合为A3B2C1D3,通过验证实验最终确定提取工艺组合为A3B2C2D3,即料液比1∶60、提取温度90 ℃、提取时间40 min、提取次数3 次。
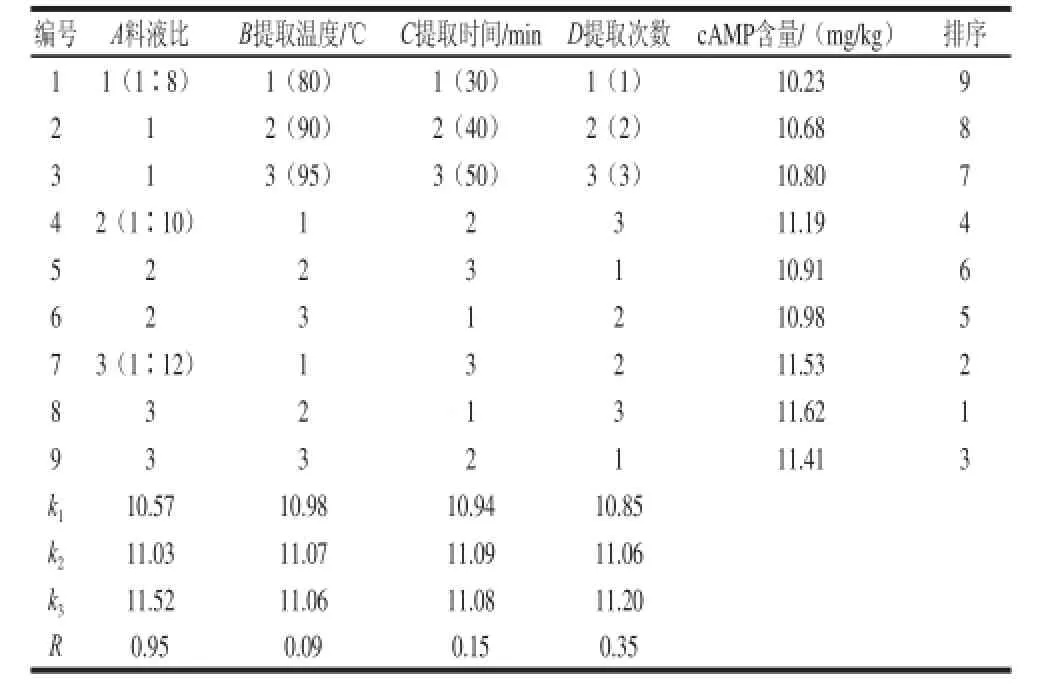
表 2 L9(34)正交试验设计和结果(鲜样)Table 2 Results of L9 (34) orthogonal array design (flesh sample)
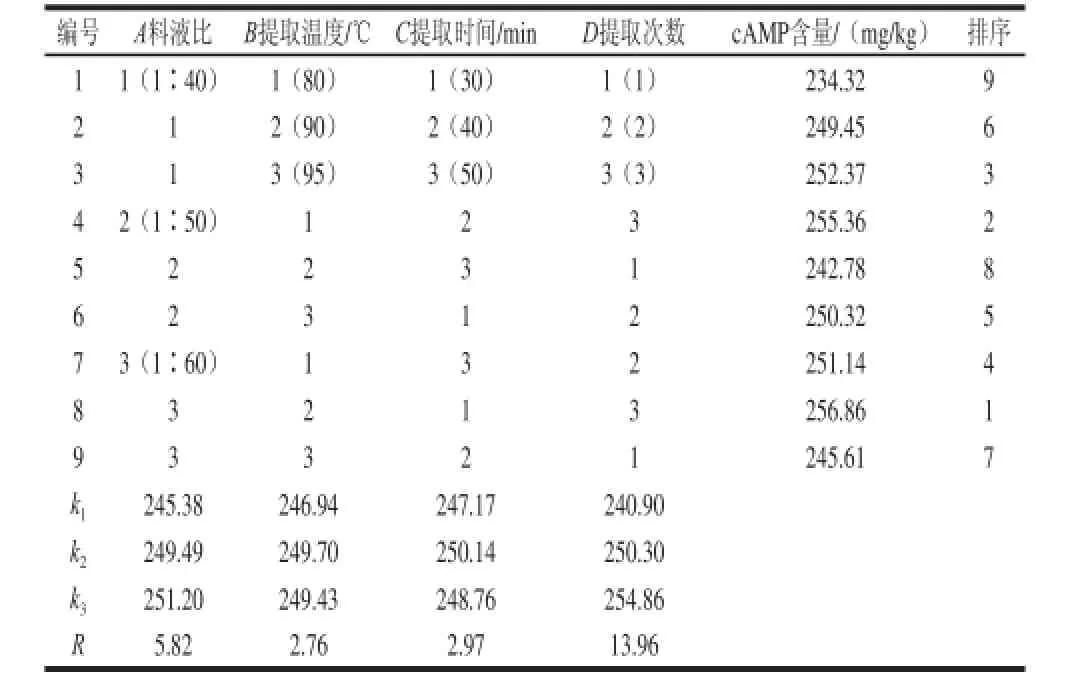
表 3 L9(34)正交试验设计和结果(干样)Table 3 Results of L9((334) orthogonal array design (dry sample)
2.4 标准品及籽瓜cAMP的色谱图
cAMP标准物质色谱图如图4所示。样品进行前处理后用HPLC进行分析,得籽瓜瓜瓤、瓜皮鲜样的色谱图如图5和图6所示,可见cAMP信号峰能与其他杂质峰分离且有较好峰形。
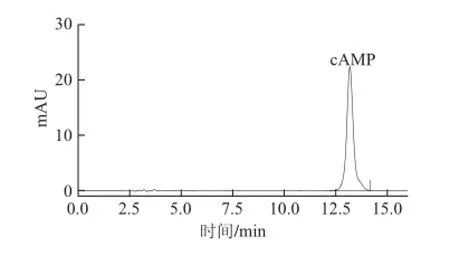
图4 标准品HPLC色谱图Fig.4 Chromatogram of cAMP standard
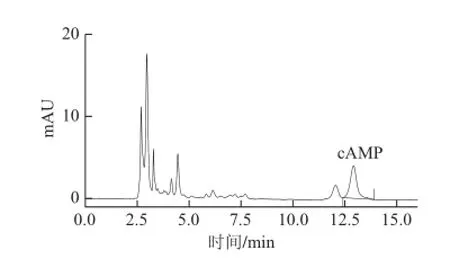
图5 籽瓜瓜瓤样品HPLC色谱图Fig.5 Chromatogram of cAMP from seeding watermelon flesh
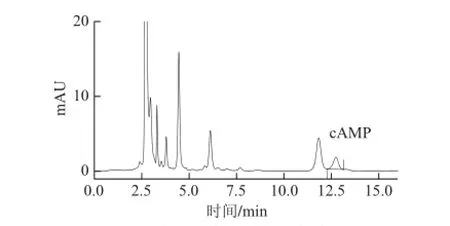
图6 籽瓜瓜皮样品HPLC色谱图Fig.6 Chromatogram of seeding watermelon rind
2.5 方法学考察
2.5.1 标准曲线的绘制
选取不同质量浓度的cAMP标准工作溶液,每个质量浓度进样20 μL。以每个标准工作溶液对应的峰面积Y和其质量浓度X进行线性回归分析,得到回归方程Y=860 341.567 13X-91 953.292 8,R=0.999 9,cAMP标准曲线见图7。结果显示在0.1~100 mg/L范围内线性关系良好。
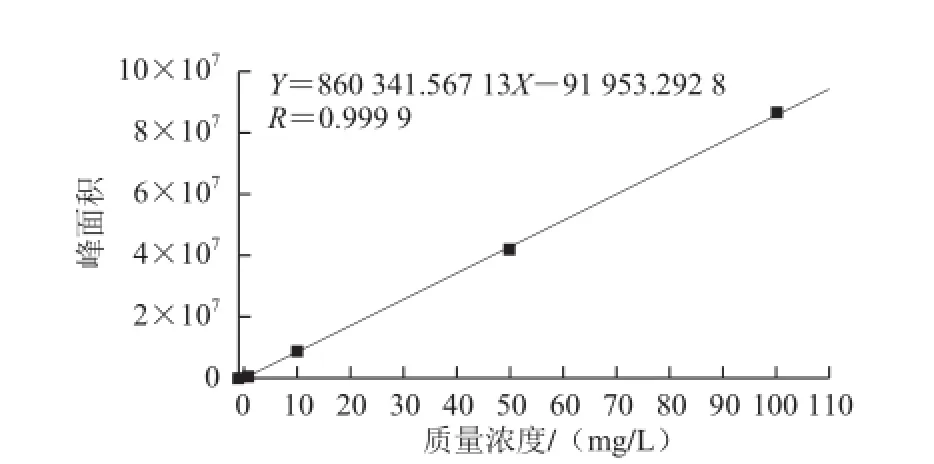
图7 cAMP标准曲线Fig.7 Standard curve of cAMP
2.5.2 精密度
取质量浓度10 mg/L的cAMP标准液自动进样20 μL,平行测定5 次,测定cAMP峰面积积分值,计算平均值和相对标准偏差(rel ative standard deviation,RSD),结果见表4。RSD为0.34%,说明精密度良好,满足实验要求。
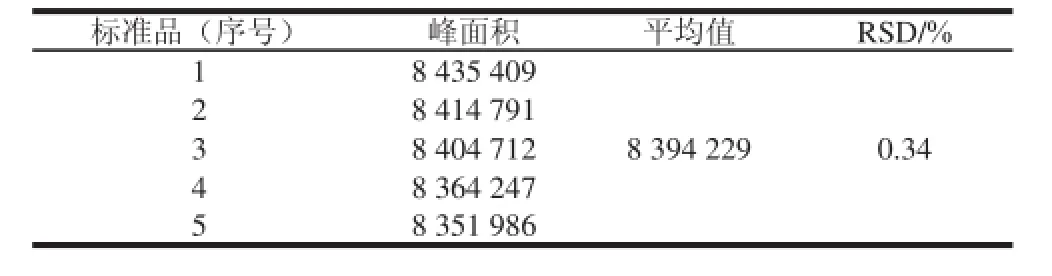
表4 精密度实验结果(n=5)Table 4 Results of precise test (n =5)
2.5.3 重复性
精确称取相同质量的样品5 份,制备籽瓜提取液,分别进样20 μL,用HPLC仪测定峰面积,计算峰面积的RSD为2.28%,结果见表5。说明实验重复性良好。

表5 重复性实验结果(n=5)Table 5 Results of repeatability test (n=5)
2.5.4 回收率
精确称取相同质量的籽瓜瓜瓤样品5 份,分别加入一定量的cAMP标准物质,进行加标回收率实验,结果如表6所示。cAMP的回收率为92.93%~104.96%,RSD为3.22%,表明该方法能准确测定籽瓜中cAMP的含量。
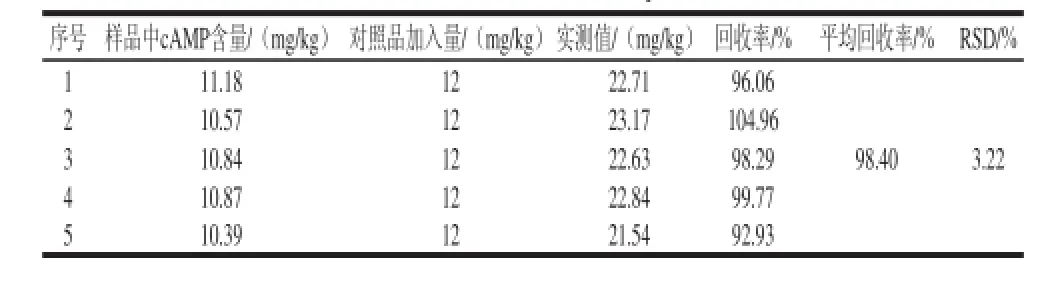
表6 加标回收实验结果(n=5)Table 6 Results of recovery test (n =5)
2.6 籽瓜样品的测定

表7 籽瓜中cAMP的含量(n=3)Table 7 cAMP contents of the flesh and rind of seeding watermelon (n =3)
籽瓜瓜皮和瓜瓤中cAMP含量有较大区别,由表7可以看出,籽瓜瓜瓤中的cAMP含量高于瓜皮,大约是瓜皮的2~3 倍。
3 讨论与结论
本实验采用高压液相色谱-质谱法鉴定出籽瓜中含有cAMP,并建立HPLC法测定籽瓜中cAMP的含量,精密度和准确度均符合分析要求,方法回收率高、重复性好,cAMP的平均加标回收率为98.40%,重复测定的RSD为2.28%。通过单因素试验和正交试验对样品提取条件进行优化,最终选择提取条件:提取液为水、料液比1∶12(鲜样)和1∶60(干样)、提取温度90 ℃、提取时间40 min和提取次数3 次。该研究方法能够满足籽瓜中cAMP定性定量分析的要求。通过对新疆黑大片籽瓜样品中cAMP的检测,可知籽瓜瓜瓤中的cAMP含量较高,含量达到256.86 mg/kg(md)。下一步将研究新疆不同品种籽中cAMP含量的差异,为籽瓜资源的充分利用提供依据。
[1] 崔志强, 孟宪军, 王传杰. HPLC法测定冬枣环磷酸腺苷含量[J]. 食品研究与开发, 2006, 27(3): 158-160.
[2] OECKL P, HENGERER B, FERGER B. G-Protein coupled receptor 6 deficiency alters striatal dopamine and cAMP concentrations and reduces dyskinesia in a mouse model of Parkinson’s disease[J]. Experimental Neurology, 2014, 257: 1-9.
[3] 申艳红, 张文生, 谢楠, 等. 环磷酸腺苷的合成[J]. 有机化学, 2003, 23(增刊1): 113.
[4] 夏泉鸣, 周洋, 赵黎明, 等. 离子交换法提取大枣中环磷酸腺苷(cAMP)的工艺研究[J]. 生物技术进展, 2012, 2(4): 288-292.
[5] 姚文华, 尹卓容. 大枣的研究[J]. 农产品加工: 学刊, 2006(2): 28-33.
[6] HANABUSA K, CYONG J, TAKAHASHI M. High level of cyclic AMP in the jujube plum[J]. Planta Medica, 1981, 42(4): 380-384.
[7] 刘孟军, 王永惠. 枣和酸枣等14 种园艺植物cAMP含量的研究[J]. 河北农业大学学报, 1991, 14(4): 20-23.
[8] 徐涛, 潘见, 袁传勋, 等. 大孔树脂SPE-RP-HPLC检测大枣中的cAMP[J]. 食品科学, 2005, 26(12): 179-181.
[9] 郜文, 丁兆毅, 徐菲, 等. HPLC法测定大枣环磷酸腺苷(c-AMP)的含量[J]. 首都医科大学学报, 2011, 32(3): 375-378.
[10] OECKL P, FERGER B. Simultaneous LC-MS/MS analysis of the biomarkers cAMP and cGMP in plasma, CSF and brain tissue[J]. Journal of Neuroscience Methods, 2012, 203(2): 338-343.
[11] LORENZETTI R, LILLA S, JUIS DONATO L, et al. Simultaneous quantification of GMP, AMP, cyclic GMP and cyclic AMP by liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography B, 2007, 859(1): 37-41.
[12] van DAMME T, ZHANG Y, LYNEN F, et al. Determination of cyclic guanosineand cyclic adenosine monophosphate (cGMP and cAMP) in human plasma and animal tissues by solid phase extraction on silica and liquid chromatography-triple quadrupole mass spectrometry[J]. Journal of Chromatography B, 2012, 909: 14-21.
[13] 赵恒强, 耿岩玲, 苑金鹏, 等. UAE-HILIC-DAD-ESI-Q-TOF/MS法测定大枣中的环磷酸腺苷[J]. 食品研究与开发, 2013, 34(18): 46-50.
[14] 谢越, 俞浩, 汪建飞, 等. 高效液相色谱法同时测定滁菊样品中的9种酚酸[J]. 分析化学, 2013, 41(3): 383-388.
[15] 张倩, 樊君, 罗云书. HPLC测定陕北大枣和新疆大枣中环磷酸腺苷含量的研究[J]. 药物分析杂志, 2008, 28(6): 895-897.
[16] 苏豫梅, 许玲, 孙振荣, 等. 用HPLC法测定红枣中cAMP含量的研究[J].农产品加工, 2011(7): 76-78.
[17] 史红梅, 尹卓容, 蒋文强. 高压液相色谱法测定金丝小枣环磷酸腺苷的含量[J]. 食品科学, 2006, 27(5): 216-218.
[18] 赵堂, 郝凤霞, 杨敏丽. 几种红枣中生物活性物质环磷酸腺苷的含量分析[J]. 湖北农业科学, 2011, 50(23): 4955-4957.
[19] 蒲云峰, 万英, 侯旭杰. HPLC法测定不同品种红枣中cAMP含量[J].食品研究与开发, 2011, 32(7): 109-112.
[20] 许牡丹, 邹继伟, 史芳. 超声波辅助酶法提取木枣环磷酸腺苷的工艺条件优化[J]. 食品科技, 2013, 38(7): 220-224.
[21] 武冬梅, 李冀新, 赵志永, 等. 新疆籽瓜主栽品种营养成分分析比较[J].食品研究与开发, 2010, 31(8): 177-179.
[22] 史红梅, 尹卓容, 蒋文强. HPLC法测定金丝小枣中环磷酸腺苷的含量[J]. 天然产物分离, 2007, 4(1): 9-11.
[23] 尤妍, 陈恺, 李焕荣, 等. 响应面法优化哈密大枣环磷酸腺苷提取工艺的研究[J]. 保鲜与加工, 2011, 11(2): 21-26.
Identification and Quantitation of Cyclic Adenosine 3’,5’-monophosphate in Seeding Watermelon by Liquid Chromatography-Tandem Mass Spectrometry and High Performance Liquid Chromatography
XI Dong-hua1, GAO Jing2, PENG Xin-yuan1, WANG Qian3, LI Ling1, WU Bin3,*
(1. College of Chemistry and Chemical Engineering, Xinjiang University, Ürümqi 830046, China; 2. Center for Physics and Chemistry Analysis, Xinjiang University, Ürümqi 830046, China; 3. Institute of Agro-products Storage and Processing, Xinjiang Academy of Agricultural Sciences, Ürümqi 830091, China)
A method to identify cAMP using liquid chromatography coupled to tandem mass spectrometry (LC-MSMS) and to quantify the content of cAMP in seeding watermelon using high performance liquid chromatography (HPLC) was established. The quantitative method showed a good linear relationship in the cAMP concentration range from 0.1 to 100 mg/L with a correlation coefficient of 0.999 9. The average recovery for spiked samples was 98.40% with relative standard deviation (RSD) of 3.22% (n = 5). By using one-factor-at-a-time and orthogonal array designs, the optimum conditions for cAMP extraction were determined as follows: solid-to-water ratio; 1:12 (fresh sample) or 1:60 (dry sample); temperature, 90 ℃; extraction time, 40 min. This method is simple, accurate, reliable and reproducible, and can be used for the determination of cAMP in seeding watermelon.
seeding watermelon; cyclic adenosine 3’,5’-monophosphate (cAMP); liquid chromatography coupled to tandem mass spectrometry (LC-MS-MS); high performance liquid chromatography (HPLC)
O657.72
A
1002-6630(2014)18-0141-05
10.7506/spkx1002-6630-201418028
2013-11-27
新疆维吾尔自治区级公益性科研院所基本科研业务费专项(KY2013045;KY2014038)
席冬华(1990—),女,硕士研究生,研究方向为天然产物分析。E-mail:553764469@qq.com
*通信作者:吴斌(1973—),男,副研究员,博士,研究方向为农产品贮藏与加工。E-mail:xjuwubin0320@sina.com

