啤酒花总黄酮测定方法的比较研究
李 涛,刘晓璠,杨小兰*
(山西大学生命科学学院,山西 太原 0300 06)
啤酒花总黄酮测定方法的比较研究
李 涛,刘晓璠,杨小兰*
(山西大学生命科学学院,山西 太原 0300 06)
以高效液相色谱法对啤酒花总黄酮含量的测定结果作为评判标 准(相对准确值),比较与评价AlCl3分光光度法、Al(NO3)3分光光度法和硼氢化钠/氯醌分光光度法3 种 比色法测定 酒花总黄酮含量的准确性。结果表明,高效液相色谱法测定酒花总黄酮含量为(12.73±0.26) mg/g;AlCl3法测得总黄酮含量为(13.66±0.45)mg/g,与高效液相色谱法偏差率为7.3%;而Al(NO3)3法测定结果为(43.53±1.16)mg/g,与高效液相色谱法的偏差率 为241.9%;硼氢化钠/氯醌法测定结果为(70.25±1.42)mg/g,与高效液相色谱法的偏差率为451.8%。提出AlCl3分光光度法比其他2 种比色法更适用于酒花总黄酮含量的测定,该方法误差小,准确性好。
酒花;总黄酮;分光光度法;高效液相色谱法;黄腐酚
啤酒花(Humulus lupulus L.)为大麻科葎草属多年生蔓性草本植物,简称酒花,是啤酒工业的原料[1],它赋予啤酒特有的苦味与香味。酒花亦作为一种植物药被国内外广泛使用[2]。近年来,啤酒花中黄酮类物质逐渐受到人们的重视,研究表明,酒花黄酮具有抗病毒[3]、抗菌[4-5]、抗肿瘤[6]、抗氧化[7-8]等活性。
目前,总黄酮的测定方法主要有分光光度法和高效液相色谱(high performance liquid chromatography,HPLC)法。分光光度法主要有AlCl3分光光度法[9]、Al(NO3)3分光光度法[10]和硼氢化钠/氯醌(sodium borohydride/chloranil,SBC)分光光度法[11],其基本原理为黄酮类化合物进行络合显色,通过标准对照测定总黄酮的含量。分光光度法所用设备简单,操作容易,广泛用于植物总黄酮的测定,但该方法专一性差,由于一些酚类物质的干扰使得测定结果偏高[12]。HPLC法具有分析速度快、灵敏度高、结果准确的特点,该法可以通过相应的对照品直接测定总黄酮含量,也可以通过水解后测定黄酮苷元含量,再通过转化系数求得总黄酮含量,但该方法样品前处理复杂,且仪器昂贵不能广泛应用[13]。本实验采用HPLC法和AlCl3、Al(NO3)3和SBC 3种分光光度法对酒花总黄酮含量进行测定,以HPLC法的测定结果作为评判标准(相对准确值),比较3种分光光度法测定结果的偏差率。目的是确定一种最适合于酒花黄酮测定的分光光度法,为酒花的开发利用研究提供理论依据。
1 材料与方法
1.1 材料与试剂
酒花(青岛大花) 新疆绿金啤酒花有限责任公司;
芦丁(纯度95%)、儿茶素(纯度96.0%)、槲皮素(纯度98%)、山奈酚(纯度98%)、黄腐酚(纯度98%)美国Sigma公司;甲醇、乙腈(均为色谱纯) 美国Fisher Scientific公司;其他药品均为分析纯 天津光复科技发展有限公司。
1.2 仪器与设备
高效液相色谱仪(1525系列双泵系统、2487双波长紫外检测器、Breeze软件操作系统) 美国Waters公司;sp-2102UVpc紫外-可见分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 酒花总黄酮的提取
1.000 g粉碎酒花,用石油醚加热回流60 min,除去色素及脂(酯)类[2]。过滤后将啤酒花中残留石油醚挥干。加入50 mL体积分数70%甲醇30 ℃超声提取1 h,离心后过滤分离得上清液,按上述条件重复提取1 h,将2 次上清液混合定容至100 mL作为酒花黄酮提取液。
1.3.2 HPLC法测定酒花总黄酮
1.3.2.1 盐酸水解-HPLC法测酒花黄酮苷
样品水解处理[14]:取酒花黄酮提取液10 mL,加10 mL甲醇,5 mL体积分数25%盐酸(以浓盐酸为基准)溶液,置水浴中80 ℃回流水解2 h后,迅速冷却至室温,全部转移至100 mL容量 瓶中,用甲醇稀释至100 mL,作为水解样品。将未水解样品与水解样品均用0.45 μm滤膜过滤,用HPLC进行游离黄酮苷元和水解产生黄酮苷元的测定。采用0.008、0.016、0.032、0.048、0.064 μg/mL 5个梯度的槲皮素和山奈酚混标溶液制作标准曲线。所有测定均进行5 次平行测定,结果数据以平均值±标准差表示。
色谱条件[15]:Symmetry C18柱(4.6 mm×150 mm,5 μm);检测波长370 nm;柱温40 ℃;流速1.0 mL/min;进样量10 μL;流动相组成及洗脱程序见表1。

表1 盐酸水解-HPLC法测黄酮苷元梯度洗脱程序Table 1 Mobile phase gradient program for the analysis of flavonoid aglycone by hydrochloric acid hydrolysis-HPLC method
1.3.2.2 酒花中黄腐酚(xanthohumol,XN)含量的测定[16]
采用1.3.2.1节色谱条件,流动相组成及洗脱程序见表2。采用2、4、8、16、24 μg/mL 5个梯度的XN标准品使用最小二乘方直线回归法制作标准曲线,以质量浓度为横坐标,峰面积为纵坐标。所有测定均进行5 次平行测定,结果数据以平均值±标准差表示。

表2 HPLC测XN梯度洗脱程序Table 2 Mobile phase gradient program for XN analysis by HPLC method
1.3.3 分光光度法测定酒花总黄酮
1.3.3.1 AlCl3法[9]
精确吸取0.2 mg/mL芦丁标准液0.25、0.50、1.0、2.0、3.0、4.0 mL和一定量的样品酒花黄酮提取液分别置于10 mL试管中;加入0.1 mol/L AlCl3溶液2 mL、1 mol/L乙酸钾溶液3 mL,用体积分数70%甲醇定容至10 mL,室温放置30 min,同时以体积分数70%甲醇做空白对照,在波长420 nm处测吸光度[5]。以芦丁标准液的质量浓度为横坐标,以吸光度为纵坐标,绘制芦丁标准曲线。以样品的吸光度通过标准曲线计算其总黄酮含量。进行5 次平行测定,结果数据以平均值±标准差表示。
1.3.3.2 Al(NO3)3法[10]
分别取0.2 mg/mL的芦丁标准液0、0.5、1.0、1.5、2.0、2.5、3.0 mL和一定量的样品酒花黄酮提取液置于7 只试管中,用体积分数70%的甲醇补足体积到5 mL,后各加入0.3 mL质量分数5%NaNO2溶液,混合后静置5 min;再加入0.3 mL质量分数10%的Al(NO3)3溶液,混合后静置6 min;最后加入4 mL 1mol/L NaOH溶液,加入0.4 mL体积分数30%甲醇使总体积为10 mL,混合后静置10 min,在波长510 nm处测定吸光度。以芦丁标准液的质量浓度为横坐标,以吸光度为纵坐标,绘制芦丁标准曲线。以样品的吸光度通过标准曲线计算其总黄酮含量。进行5 次平行测定,结果数据以平均值±标准差表示。
1.3.3.3 硼氢化钠/氯锟法
按照He Xiangjiu等[11]的方法进行,将一定量酒花黄酮提取液氮气干燥,回收于1 mL四氢呋喃-乙醇溶液中作为样品。以儿茶素为标准对照,使用四氢呋喃-乙醇作为溶剂配制成不同质量浓度酒花黄酮的样品溶液。每1 mL样品溶液或1 mL儿茶素标准溶液的试管中加入0.5 mL 50 mmol/L NaBH4溶液和0.5 mL 74.56 mmol/L AlCl3溶液,室温振荡30 min,再追加0.5 mL NaBH4溶液到每个试管中,继续在室温条件下振荡30 min,然后将冷乙酸溶液(4 ℃、2.0 mL、0.8 mol/L)加入到每个试管中,避光振荡15 min后,再将1 mL 20 mmol/L氯醌添加到每个试管中,100 ℃水浴加热60 min,反应后迅速冷却试管,并将最终体积用甲醇定容为4 mL。然后,每管加入1 mL 1 052 mmol/L香兰素,混匀后加入12 mol/L盐酸2 mL,避光反应15 min。最终反应液在波长490 nm处测量吸光度。以儿茶素标准液的质量浓度为横坐标,以吸光度为纵坐标,绘制儿茶素标准曲线。以样品的吸光度
通过标准曲线计算其总黄酮含量。进行5 次平行测定,结果数据以平均值±标准差表示。
2 结果与分析
2.1 HPLC法测定酒花总黄酮
2.1.1 盐酸水解-HPLC法测定酒花黄酮苷含量
黄酮游离苷元在自然界中不稳定而很难存在,因此,黄酮多以糖苷形式稳定存在[17]。对照品HPLC色谱图见图1。本实验对未水解的酒花样品中游离苷元进行测定。结果表明,酒花中不含游离黄酮苷元,这与王鹏等[18]的研究结果相同。因此,采用经水解的酒花样品测得的苷元均为黄酮苷水解后所产生的苷元,其测定结果见图2。图2中峰1保留时间为5.21 min,与图1对照品槲皮素保留时间(5.21 min)相同,可确定为槲皮素。图2中峰2保留时间为8.41 min,与图1对照品山奈酚保留时间(8.41 min)相同,可确定为山奈酚。测定结果显示,酒花中仅含槲皮素和山奈酚2 种黄酮苷元,这与王仿等[19]的结果一致。槲皮素标准曲线:Y=3.75×106X-28 416.3(R2=0.998 8)。山奈酚标准曲线:Y=8.47×106X-115 426.1(R2=0.992 6)。由标准曲线计算得酒花黄酮提取物中槲皮素苷元(P1)的含量为(0.031 0±0.000 3)μg/mL,山奈酚苷元(P2)的含量为(0.012 7±0.000 6)μg/mL。
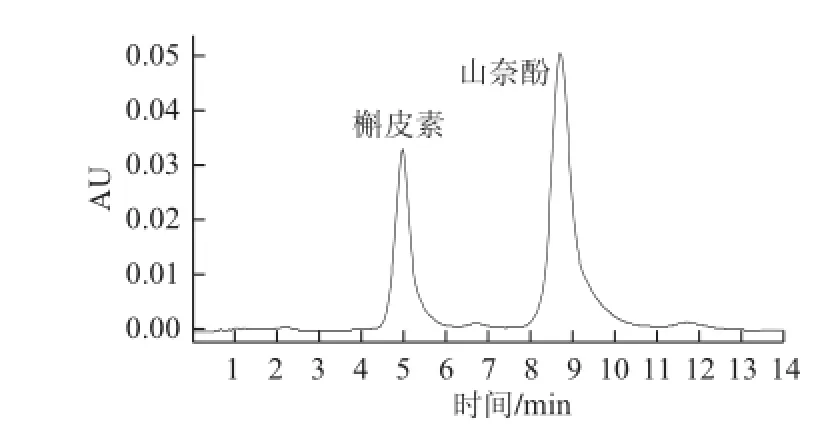
图1 对照品HPLC色谱图Fig.1 HPLC chromatogram of the reference
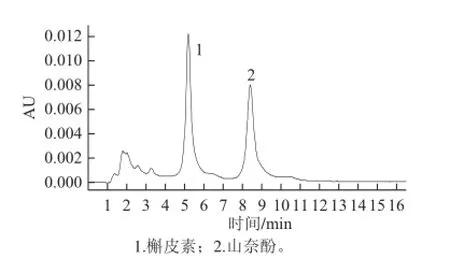
图2 水解样品HPLC色谱图Fig.2 HPLC chromatogram of the hydrolyzed sample
1993年,Sticher首次提出通过转换因子由黄酮苷元计算得到黄酮苷含量,山奈酚转换因子为2.64,槲皮素转换因子为2.51[20]。由公式(1)得到酒花中总黄酮苷含量为(11.134±0.234)mg/g。
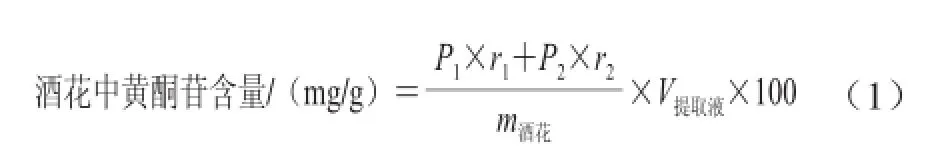
式中:P1为水解液中槲皮素苷元含量(0.031 0×10-3mg/mL);P2为水解液中山奈酚苷元含量(0.012 7×10-3mg/mL);r1为槲皮素苷元转换因子为2.51;r2为山奈酚苷元转换因子为2.64;m酒花为酒花质量/g;V提取液为提取溶液的体积/mL。
2.1.2 HPLC法测酒花中XN含量
HPLC法测得XN对照品保留时间为9.780 min(图3),标准曲线:Y=61 829X+33.102,R2=0.998。酒花样品的XN测定色谱图见图4,由标准曲线计算出酒花中XN含量为(1.300±0.025)mg/g。
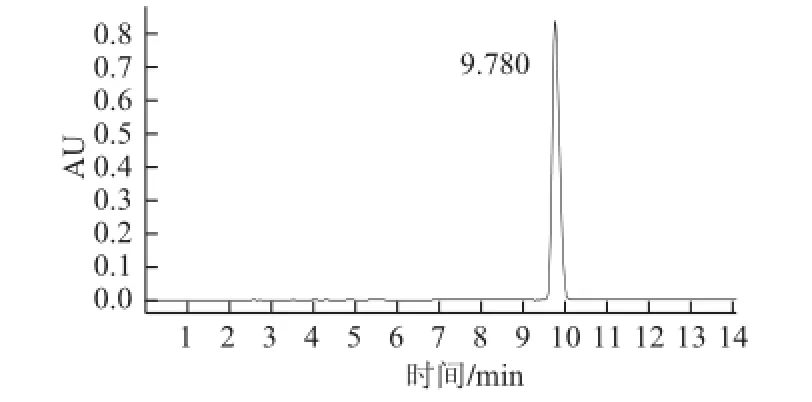
图3 XN标准品HPLC色谱图Fig.3 HPLC chromatogram of XN reference
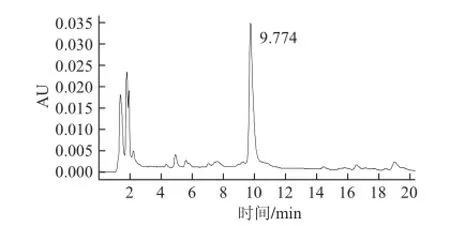
图4 酒花中XN HPLC色谱图Fig.4 HPLC chromatogram of XN in hops
2.1.3 酒花总黄酮计算结果
先前的研究已表明,酒花中的黄酮类化合物主要是黄酮苷和异戊烯基类黄酮,而异戊烯基类黄酮的主要组成为XN,其含量占异戊烯基类黄酮的80%[21]。因此,由公式(2)得出酒花总黄酮含量为(12.73±0.26)mg/g。

2.2 3 种分光光度法测定结果的比较
本研究中,AlCl3分光光度法测得芦丁标准曲线为y=3.793 1x-0.000 5,R2=0.999 7;Al(NO3)3法测得芦丁标准曲线为y=1.196 2x+0.020 8,R2=0.995 8;SBC法测得儿茶素标准曲线为y=0.027 6x+0.125 4,R2=0.995 0。采用公式(3)计算3 种分光光度法与HPLC法相比的偏差率。

结果表明,A l C l3法测定的酒花总黄酮含量为(13.66±0.45)mg/g,与HPLC法相比偏差率为7.3%;A l(N O3)3法测定的酒花总黄酮含量为(43.53±1.16)mg/g,与HPLC法相比偏差率达241.9%;而SBC法测定的酒花总黄酮含量为(70.25±1.42)mg/g,与HPLC法相比有最大的偏差率为451.8%。结果表明,AlCl3法测定的总黄酮含量与Al(NO3)3法和SBC法相差甚远,从理论上分析,黄酮分子中的羰基与其邻位羟基或2 个邻二酚羟基均能与金属离子Al3+配位,生成稳定的5、6元环的有色络合物[22]。但是,Al(NO3)3法是在碱性条件下,显色反应可以发生在非黄酮类多酚类化合物原儿茶素、原儿茶醛、原儿茶酸、咖啡酸、绿原酸、羟基苯甲酸类等的邻二酚羟基部位,导致黄酮测定结果偏高[23]。因此,Al(NO3)3法并非是测定黄酮类化合物专属,而对多酚类物质均有显色反应。据文献报道,酒花中含有4%~12%的多酚[24],主要为原花青素、黄酮苷和异戊烯基黄酮[18],其中原花青素占总多酚的50%以上[24]。酒花原花青素具有邻二酚羟基结构,可以与Al(NO3)3发生显色反应后在波长510 nm处有很强吸收,导致酒花总黄酮测定结果偏高。而AlCl3法的测定环境是酸性,在此条件下,只与黄酮分子中的羰基与其邻位羟基之间反生显色反应,其显色机理见图5[23]。
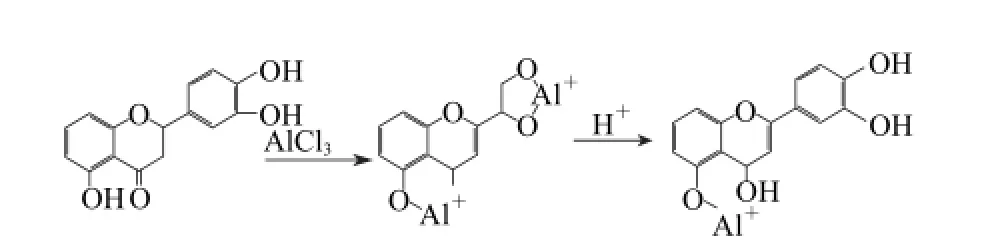
图5 lCl3法的显色机理Fig.5 Mechanism of color development of aluminum chloride method
由此可见,AlCl3法可以避免邻二酚羟基结构的非黄酮类化合物的干扰,对黄酮类化合物的测定专属性较强[25]。所以AlCl3法测定酒花总黄酮具有更好的专属性,更高的准确度。而SBC法中的四氢硼钠反应是鉴别二氢黄酮类化合物专属性较高的反应[11],以儿茶素表示,用于测定酒花黄酮含量误差较大。
3 结 论
本实验采用盐酸水解-HPLC法测定酒花黄酮苷元,通过转换因子计算得到实际的黄酮苷含量,通过HPLC法测定酒花XN含量折算出异戊烯基类黄酮含量,二者之和为酒花总黄酮含量,所得结果更接近真实值。以此作为评判标准,对AlCl3分光光度法、Al(NO3)3分光光度法和SBC分光光度法3 种比色法测定酒花总黄酮结果进行了比较评价。结果表明,AlCl3分光光度法比其他2 种比色法更适用于酒花总黄酮的测定。
[1] STEVENS J F, MIRANDA C L, BUHLER D R, et al. Chemistry and biology of hops flavonoids[J]. Journal of the American Society of Brewing Chemists, 1998, 56: 136-145.
[2] 胡仕屏, 田艳花, 郑海鹰, 等. 啤酒花总黄酮超声波提取工艺的研究[J].食品工程, 2008(1): 38-41.
[3] CHOI O, YAHIRO K, MORINAGA N, et al. Inhibitory effects of various plant polyphenols on the toxicity of staphylococcal a-toxin[J]. Microbial Pathogenesis, 2007, 42(5): 215-224.
[4] SHINADA K, TAGASHIRA M, WATANABLE H, et al. Hop bract polyphenols reduced three-day dental plaque regrowth[J]. Journal of Chemical Research, 2007, 86(9): 848-851.
[5] KEN Y, TOMOKO T, TSUTOMU S, et al. Hop polyphenols suppress production of water-insoluble glucan by Streptococcus mutans and dental plaque growth in vivo[J]. The Journal of Clinical Dentistry, 2008, 19(2): 74-78.
[6] 赵世元, 农智新, 钟振国. 甘草总黄酮体内抗肿瘤作用的实验研究[J].广西医学, 2006, 28(9): 1348-1350.
[7] GORJANOVIC S Z, NOVARKOVIC M, POTKONJAK N I, et al. Application of a novel antioxidative assay in beer analysis and brewing process monitoring[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 744-751.
[8] GORINSTEIN S, CASPI A, LIBMAN I, et al. Bioactivity of beer and its influence on human metabolism[J]. International Journal of Food Sciences and Nutrition, 2007, 58(2): 94-107.
[9] 农业部. NY/T 1295—2007 荞麦及其制品中总黄酮含量的测定[S].
[10] 庄向平, 虞杏英. 银杏叶中黄酮含量的测定和提取方法[J]. 中草药, 1992, 23(3): 122-124.
[11] HE Xiangjiu, LIU Dong, LIU Ruihai. Sodium borohydride/chloranilbased assay for quantifying total flavonoids[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20): 9337-9344.
[12] 赵晓莉, 岳红. 黄酮类化合物分析方法概述[J]. 盐湖研究, 2005, 13(2): 34-39.
[13] 叶文峰, 陈新, 刘秀娟, 等. 树叶中具有生理活性的黄酮类化合物研究进展[J]. 江西师范大学学报: 自然科学版, 2000, 24(3): 278-282.
[14] 张蕾, 陈骁鹏, 董小平. HPLC法测定银杏叶胶囊的含量[J]. 江苏药学与临床研究, 2004, 12(1): 29-32.
[15] 熊冬梅, 邓泽元, 刘蓉, 等. 高效液相色谱法测定银杏保健品中总黄酮[J]. 食品科学, 2009, 30(22): 256-259.
[16] 熊皓平. 啤酒花化学成分及黄腐酚提纯技术的研究[D]. 无锡: 江南大学, 2005.
[17] 施荣富, 王春红, 史作清. 沙棘叶黄酮高效液相色谱测定方法[J]. 国际沙棘研究与开发, 2004, 2(4): 4-6.
[18] 王鹏, 赵海峰, 陆健. 酒花多酚-潜在的啤酒风味和风味稳定物质[J].啤酒科技, 2007(5): 48-52.
[19] 王仿, 张霞, 刘海英, 等. 新疆野生啤酒花总黄酮含量的比较研究[J].酿酒科技, 2009(12): 27-29.
[20] STICHER O. Quality of ginkgo preparations[J]. Planta Medica, 1993, 59(1): 2-11.
[21] STEVEN J F, IVANCIC M, HSU V L, et al. Prenyl favonoids from Humulus iupulus[J]. Phytochemistry, 1997, 44(8): 1575-1585.
[22] 王庆明, 张金生, 李丽华. 两种分光光度法测定党参中的黄酮[J]. 辽宁石油化工大学学报, 2010, 30(4): 4-7.
[23] 旷春桃, 李湘洲, 汪玉霞. 大叶冬青叶中总黄酮测定方法和提取工艺研究[J]. 食品科学, 2009, 30(6): 49-51.
[24] 罗正明. 酒花多酚的提取纯化及其降脂、抗氧化作用研究[D]. 太原: 山西大学, 2011.
[25] 徐宝才, 丁霄霖. 苦荞黄酮的测定方法[J]. 盐湖研究, 2003, 22(2): 98-101.
Comparative Study on Assays for Determination of Flavonoids in Hops (Humulus lupulus L.)
LI Tao, LIU Xiao-fan, YANG Xiao-lan*
(College of Life and Science, Shanxi University, Taiyuan 030006, China)
The accuracy of three spectrophotometric assays for the determination of flavonoids in hops (Humulus lupulus L.) using respectively AlCl3, Al(NO3)3and sodium borohydride/chloranil (SBC) was evaluated by comparison with the reference data (relatively more accurate) from HPLC analysis. The results showed tha t the total content of flavonoids in hops was (12.73 ± 0.26) mg/g by HPLC, compared to (13.66 ± 0.45) mg/g, (43.53 ± 1.16) mg/g, and (70.25 ± 1.42) mg/g with a relative deviation of 7.3%, 241.9% and 451.8%, respectively, as spectrophotometrically assayed using AlCl3, Al(NO3)3and SBC. Therefore, the AlCl3-based assay is proposed to be more suitable for the determination of flavonoids in hops with smaller errors.
Humulus lupulus L.; total flavonoids; colorimetric methods; high performance liquid chromatography (HPLC); xanthohumol (XN)
TS261.7
A
1002-6630(2014)18-0089-04
10.7506/spkx1002-6630-201418017
2013-11-27
国家自然科学基金面上项目(31171748);山西省科技攻关项目(20090321097)
李涛(1989—),女,硕士研究生,研究方向为食品生物技术。E-mail:1020486956@qq.com
*通信作者:杨小兰(1956—),女,教授,学士,研究方向为食品生物技术。E-mail:1454552647@qq.com

