维持性血液透析患者低蛋白饮食治疗高磷血症的有效性与安全性研究
缪 静,李新伦,黄志芳,景洪江,伦立德
高磷血症是维持性血液透析 (MHD)患者的常见并发症,是其死亡率增加的独立危险因素[1]。我国高磷血症 (血清磷>1.76 mmol/L)发生率为57.4%[2],远高于发达国家 (美国35.1%,英国31.1%,日本36.6%)[3],这就迫切要求寻找切实符合中国国情的治疗措施。因磷的摄入与蛋白摄入相平行,理论上减少蛋白的摄入可降低血清磷水平。本研究采用前瞻性随机对照研究方法,观察低蛋白饮食治疗MHD患者高磷血症的疗效与安全性。
1 资料与方法
1.1 病例入选与排除标准 入选标准:(1)年龄18~70岁,MHD 6个月以上,尿素清除率 (Kt/V)>1.2;(2)在已经稳定使用含钙磷结合剂3个月及以上的基础上仍存在高磷血症 (血清磷>1.78 mmol/L);(3)无明显营养不良 (BMI>18.5 kg/m2,清蛋白>35 g/L);(4)自愿在试验过程中保持饮食稳定;(5)经中国人民解放军空军总医院伦理委员会批准,签署知情同意书。排除标准:(1)近期发生严重的厌食、呕吐,热量摄入不足,对饮食限制耐受性差;(2)氨基酸代谢紊乱、严重感染性疾病、慢性未控制的炎症;(3)严重心脑血管疾病、严重肝胆疾病、严重活动性消耗性疾病、恶性肿瘤;(4)妊娠或哺乳期。
1.2 一般资料 根据入选标准和排除标准前瞻性选取2012年10月—2013年8月我院血液净化中心MHD高磷血症患者28例。采用随机数字表法将患者分为低蛋白饮食组和常规蛋白饮食组。低蛋白饮食组 (16例)中男13例、女3例,年龄 (55.7±14.8)岁,透析龄(33.3±28.7)个月;常规蛋白饮食组 (12例)中男9例、女3例,年龄 (54.1±15.3)岁,透析龄 (47.5±17.0)个月;两组患者的性别构成、年龄和透析龄间差异均无统计学意义 (χ2=0.385,P=0.703;t=0.281,P=0.778;t=1.526,P=0.139)。
1.3 治疗方法 两组患者均采用以下透析方案:维持性碳酸氢盐血液透析治疗,钙离子浓度1.25~1.50 mmol/L,透析3次/周,4 h/次,透析液流量500 ml/min,血流量200~250 ml/min。透析机为贝朗血液透析机,每次透析使用一次性聚砜膜 (LOPS 15)透析器,膜面积1.5 m2,血管通路均为自体动静脉内瘘。在维持磷结合剂及活性维生素D原治疗剂量的基础上,低蛋白饮食组每日蛋白摄入量 (DPI)为0.8 g·kg-1·d-1,常规蛋白饮食组DPI为1.2 g·kg-1·d-1。两组患者治疗前由专职营养师对每例患者行膳食调查及营养状况检查,根据患者的BMI及饮食习惯制定个体化食谱,热量30 ~ 35 kcal·kg-1·d-1。入选患者分别在治疗前和治疗3、6个月时进行抽血化验并记录3 d饮食,由专业营养师应用营养计算软件 (中国人民解放军总医院研制的膳食营养专家系统V2.0)计算出患者实际蛋白摄入量,并根据血生化计算标准化的蛋白分解代谢率 (nPCR),并及时纠正及指导饮食。治疗期间根据患者情况适当调整降压药、降脂药及胰岛素剂量。
1.4 观察指标 治疗前及治疗3、6个月时观察两组患者钙磷代谢指标:血清磷、矫正钙、钙磷乘积、全段甲状旁腺激素 (iPTH)。营养状况指标:清蛋白、前清蛋白、转铁蛋白、总胆固醇;营养不良-炎症评分。人体测量学指标:身高、体质量、BMI、肱三头肌皮褶厚度(TSF)、上臂周径 (MAC)、上臂肌围 (MAMC)。
1.5 统计学方法 采用SPSS 13.0软件进行统计学分析。计量资料以 ()表示,采用独立样本t检验或重复测量的方差分析。计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 钙磷代谢指标变化 治疗前两组患者血清磷、矫正钙、钙磷乘积、iTPH水平比较,差异无统计学意义(P>0.05)。治疗3、6个月时,两组患者血清磷水平、钙磷乘积间差异均有统计学意义 (P<0.05)。低蛋白饮食组患者血清磷水平、钙磷乘积较治疗前降低,差异有统计学意义 (P<0.05,见表1)。
2.2 营养状况变化 治疗前及治疗3、6个月时,两组患者清蛋白、前清蛋白、转铁蛋白、总胆固醇水平及营养不良-炎症评分间差异均无统计学意义 (P>0.05,见表2)。
2.3 人体测量学指标变化 治疗前及治疗3、6个月时,两组患者人体测量学指标间差异均无统计学意义(P>0.05,见表3)。
3 讨论
高磷血症是MHD患者的常见并发症,可导致血管及软组织钙化,是患者死亡率增加的独立危险因素[1],其治疗难度较大。如何有效控制MHD患者的高磷血症是当前全球肾脏病领域研究的热点课题之一。高磷血症的治疗方法主要有低磷饮食、磷结合剂的应用及充分透析。各种磷结合剂的应用均有不足,如可造成铝蓄积、血管钙化、价格昂贵等,而血液透析对磷的清除能力也有限,能否通过降低饮食中的蛋白来降低血清磷水平是临床关注的重要问题。
表1 两组治疗前后钙磷代谢指标比较 ()Table 1 Comparison of calcium and phosphorus metabolism between the two groups before and after treatment

表1 两组治疗前后钙磷代谢指标比较 ()Table 1 Comparison of calcium and phosphorus metabolism between the two groups before and after treatment
注:与组内治疗前比较,▲P<0.05;与低蛋白饮食组比较,*P<0.05;iPTH=全段甲状旁腺激素
表2 两组治疗前后营养状况指标比较 ()Table 2 Comparison of nutritional indicators between the two groups before and after treatment
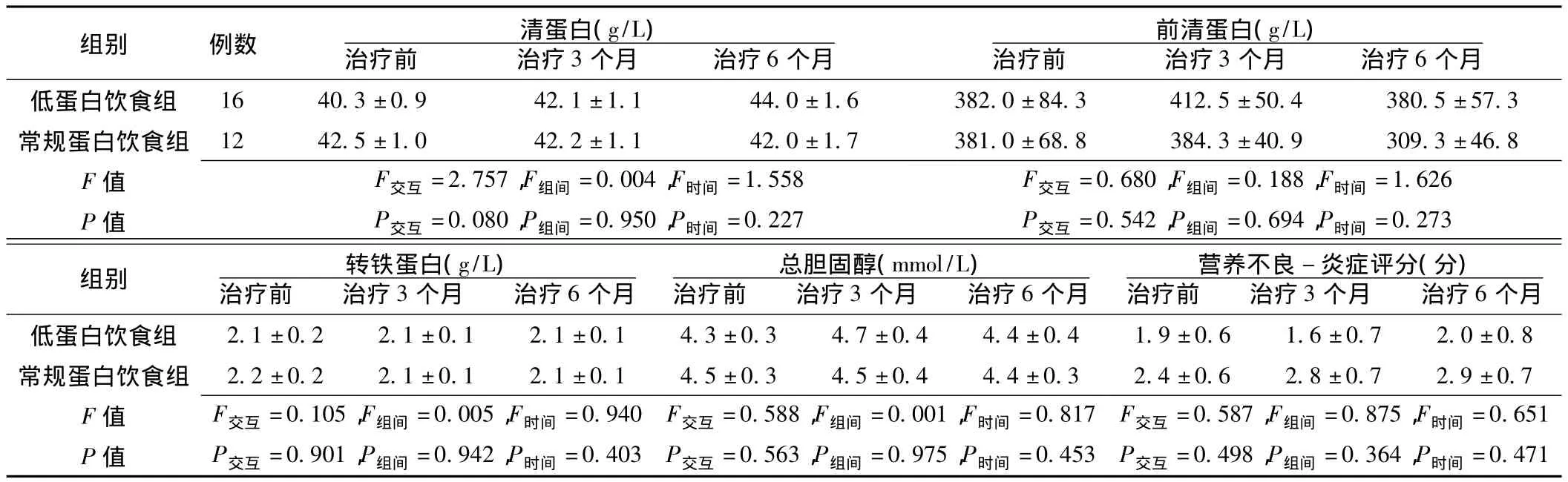
表2 两组治疗前后营养状况指标比较 ()Table 2 Comparison of nutritional indicators between the two groups before and after treatment
表3 两组治疗前后人体测量学指标比较 ()Table 3 Comparison of anthropometric indicators between the two groups before and after treatment
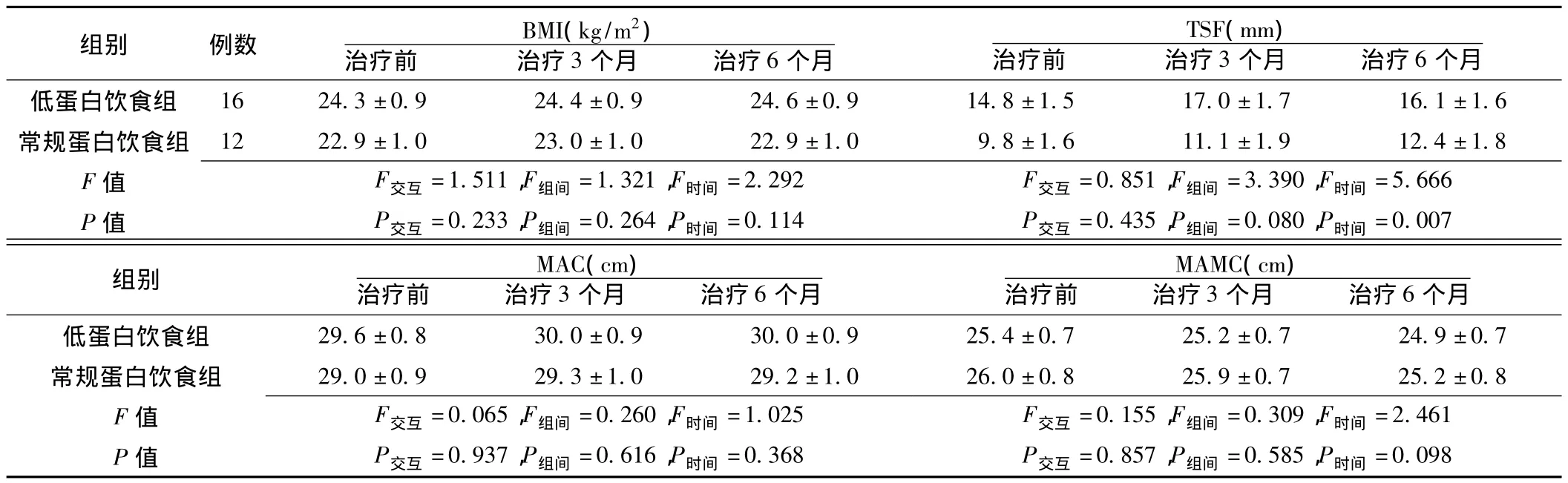
表3 两组治疗前后人体测量学指标比较 ()Table 3 Comparison of anthropometric indicators between the two groups before and after treatment
注:BMI=体质指数,TSF=肱三头肌皮褶厚度,MAC=上臂周径,MAMC=上臂肌围
本研究显示,给予MHD高磷血症患者6个月低蛋白饮食治疗后,血清磷水平及钙磷乘积较治疗前下降,而常规蛋白饮食组患者血清磷水平及钙磷乘积无明显变化。有研究对20例MHD患者进行为期8周的低蛋白饮食 (DPI为0.8 g·kg-1·d-1)联合 α -酮酸 (12片/d)治疗,结果显示血清磷从 (7.26±1.42)mg/dl降至 (5.59±1.20)mg/dl,钙磷乘积从 (70.60±2.39)mg2/dl2降至 (52.94±12.80)mg2/dl2,而营养状况指标在治疗前后无明显变化[4]。其研究为短期研究,与之不同的是,本研究是为期6个月的研究,本研究显示低蛋白饮食治疗3个月时血清磷开始下降。上述文献中实际 DPI为0.86 g·kg-1·d-1,联合应用复方 α - 酮酸制剂 (含钙量约为50 mg/片),本研究实际DPI为0.82 g·kg-1·d-1,这可能是本研究结果与之有差异的原因。Rufino等[5]对60例MHD患者的横断面研究发现,每日磷的摄入量与DPI高度相关,DPI>0.8 g·kg-1·d-1时磷不能被血液透析清除而出现蓄积,降低蛋白摄入可以使血清磷下降,但限制蛋白摄入可能会增加蛋白营养不良的风险。
低蛋白饮食降低血清磷的同时能否避免营养不良的发生,是决定该治疗方法能否实施的关键问题。但近年研究表明透析相关营养不良是多因素造成的,与代谢性酸中毒、炎症、胰岛素抵抗、透析器生物不相容、代谢废物积蓄等有关[6],单纯摄入足够蛋白难以改善营养状况,低蛋白摄入并非透析营养不良的主要因素,改善MHD患者的透析充分性,控制微炎症状态及提高透析器的组织相容性也是至关重要的。Kloppenburg等[7]对比研究了常规蛋白饮食 (DPI为0.9~1.0 g·kg-1·d-1)和高蛋白饮食 (DPI为 1.3 ~1.4 g·kg-1·d-1)对MHD患者的影响,提示对于充分透析的患者DPI为0.9 g·kg-1·d-1时足以满足机体需要,可以降低血清磷水平。本研究实际DPI为0.82 g·kg-1·d-1,经过为期6个月的治疗后,在血清磷水平下降的同时患者营养状况相对平稳。国内 Dong等[8]对 DPI为0.74~0.93 g·kg-1·d-1的患者随访44.5个月的研究显示其营养状况保持稳定。Tian等[9]对腹膜透析患者的研究提示中国大多数腹膜透析患者DPI未达到指南建议,对DPI<0.8 g·kg-1·d-1的患者进行为期1年的随访显示未发生营养不良,得出我国腹膜透析患者DPI不必达到指南建议的1.2 g·kg-1·d-1。这也间接支持国人MHD患者DPI可能也存在同样情况。本研究结果提示单纯低蛋白饮食在不联合α-酮酸制剂的情况下未增加营养不良的风险。
国外研究不建议限制MHD患者的蛋白摄入,低蛋白饮食造成的营养不良及死亡率增加的风险高于高磷血症所带来的风险[10]。但过高蛋白摄入量会造成高磷血症,加重代谢性酸中毒、代谢废物蓄积,影响透析充分性等[11]。这些文献是基于西方研究提出的,本研究及国内有关MHD患者DPI的研究支持国人相对低蛋白饮食是可行的,出现研究结果差异的原因可能因西方人与国人体质及饮食结构存在差异,欧美国家的DPI指南未必适用于国人,故需要进一步探讨适合中国MHD患者的DPI,既能保证良好的营养状态,又能避免因营养物质摄入过多带来的危害。
综上所述,DPI为0.8 g·kg-1·d-1时可以降低我国MHD患者血清磷水平,并且营养状况稳定。但本研究病例数较少,研究时间短,MHD患者能否长期耐受低蛋白饮食仍需长期、大规模、多中心的临床研究证实。
1 Block GA,Klassen PS,Lazarus JM,et al.Mineral metabolism,mortality,and morbidity in maintenance hemodialysis [J].J Am Soc Nephrol,2004,15(8):2208 -2218.
2 Kong X,Zhang L,Zhang L,et al.Mineral and bone disorder in Chinese dialysis patients:a multicenter study [J].BMC Nephrology,2012,13(1):116-122.
3 Dialysis Outcomes and Practice Patterns Study.2012 DOPPS Annual Report[R] .DOPPS,2012.
4 Li H,Long Q,Shao C,et al.Effect of short-term low -protein diet supplemented with keto acids on hyperphosphatemia in maintenance hemodialysis patients[J].Blood Purif,2011,31(1/2/3):33 -40.
5 Rufino M,de Bonis E,Martin M,et al.Is it possible to control hyperphosphataemia with diet,without inducing protein malnutrition?[J].Nephrol Dial Transplant,1998,13(Suppl 3):65 -67.
6 Pupim LB,Flakoll PJ,Brouilltte JR,et al.Intradialytic parenteral or nutrition improves protein and cenergy homeostasis in chronic hemodialysis patients[J].J Clin Invest,2002,110(4):483 -492.
7 Kloppenburg WD,Stegeman CA,Hovinga TK,et al.Effect of prescribing a high protein and increasing the dose of dialysis on nutrition in stable chronic hemodialysis patients:a randomized,controlled trial[J].Nephrol Dial Transplant,2004,19(5):1212 -1223.
8 Dong J,Li Y,Xu Y,et al.Daily protein intake and survival in peritoneal dialysis[J].Nephrol Dial Transplant,2011,26(11):3715 -3721.
9 Tian XK,Wang T.A low-protein diet does not necessarily lead to malnutrition in peritoneal dialysis patients[J].J Ren Nutr,2005,15(3):298-303.
10 Shinaberger CS,Greenland S,Kopple JD,et al.Is controlling phosphorus by decreasing dietary protein intake beneficial or harmful in persons with chronic kidney disease?[J].The American Journal of Clinical Nutrition,2008,88(6):1511-1518.
11 Nakao T,Matsumoto H,Okada T,et al.Nutritional management of dialysis patients:Balancing among nutrient intake,dialysis dose,and nutritional status[J].Am J Kidney Dis,2003,41(Suppl 1):S133-136.

