卒中后抑郁大鼠小脑浦肯野细胞形态学改变及神经元凋亡情况研究
刘丹丹,隋汝波,张 磊,夏海苗,王春检
卒中后抑郁 (post-stroke depression,PSD)是卒中后常见精神并发症之一,可发生于卒中后的各个时期,严重影响患者的生活质量和愈后[1-3]。目前该病发病机制不明,多种机制并存。近年来越来越多的证据表明小脑与认知、行为及精神疾病相关[4-7]。同时,临床试验已证实电刺激小脑顶核能显著改善PSD患者的抑郁症状[8]。小脑可通过广泛的神经通路与其他部位脑组织发生联系是不同精神疾病发生的病理基础,目前国内外关于PSD小脑的研究多集中在影像学方面,本课题组之前的研究发现小脑低功能与PSD发病相关,于是本实验在前期研究的基础上观察PSD大鼠小脑形态学改变,并观察小脑浦肯野细胞凋亡情况,为明确PSD发病机制及PSD的临床治疗提供新的方向。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性SD大鼠72只,均经旷野实验 (OFT)评分排除水平运动得分及垂直运动得分总和低于20分及超过120分的大鼠。体质量为250~350 g(由辽宁医学院实验动物中心提供)。许可证号:SCXK(辽)。实验动物级别:普通级。
1.1.2 实验试剂 兔抗大鼠激活型半胱氨酸天冬氨酸蛋白酶3(activated-caspase 3)抗体 (北京博奥森生物技术有限公司);链霉亲和素-生物素复合物 (SABC)试剂盒及二氨基联苯胺 (DAB)试剂盒 (北京中杉金桥生物技术有限公司);TUNEL试剂盒 (罗氏公司)。
1.1.3 主要仪器 LEICA-RM2135石蜡切片机,烘片机,烤片机,恒温水浴箱,BH/CH20BIMF200显微镜,CTAS-1000细胞图像分析仪。
1.2 方法
1.2.1 动物分组及实验方法 将实验大鼠适应饲养1周,昼夜节律光照,自由摄食进水,通风良好, (21±2)℃恒温。将大鼠随机分为4组:假手术组 (6只)给予假手术处理,除拴线不插入颈总动脉外,余同卒中组;抑郁组 (6只)给予慢性不可预见的温和刺激(CUMS)结合孤养;余60只大鼠行大脑中动脉闭塞(MCAO)术,术后随机取神经功能评分处于1~4分的大鼠12只,随机分为卒中组 (6只)和PSD组 (6只),PSD组大鼠于MCAO术后第3天给予CUMS结合孤养。
1.2.2 动物模型制备方法
1.2.2.1 大鼠 CUMS 模型 参照 Willner等[9]和 Katz等[10]方法:(1)禁食、禁水20 h;(2)禁水17 h;(3)倾斜鼠笼45℃17 h;(4)持续光照17 h;(5)湿笼(100 g锯屑+200 ml水)21 h;(6)4℃游5 min;(7)水平摇晃5 min;(8)行为限制2 h;(9)夹尾1 min。9种刺激每天随机采取1种,共刺激21 d。
1.2.2.2 大鼠MCAO模型[11]腹腔注射10%水合氯醛(3 ml/kg)将大鼠麻醉完全后,置于手术台上,仰卧固定。取颈正中切口,分离、结扎左侧颈总动脉近心端、颈外动脉及其分支动脉。夹闭颈内动脉远端,通过距离颈总动脉分叉处近心端0.5 cm的切口插入经肝素处理过的鱼线,当到达指定长度 (18 mm左右)时结扎颈内动脉并固定鱼线。假手术组除不插入鱼线外,其他过程同卒中组。青霉素局部外用后缝合皮肤。术中及术后注意大鼠的保温,尤其是头部的保温。大鼠即刻出现右侧Horner征被认为是模型成功的标志。
1.2.2.3 孤养 将抑郁组和PSD组动物单笼饲养。
1.3 观察指标
1.3.1 行为学观察和测试 CUMS开始第1、7、14、21天测量大鼠体质量,并行蔗糖水实验 (禁食禁水20 h后测定大鼠1 h糖水消耗比例,即糖水消耗量/总液体消耗量×100%)和OFT(室内隔音,测定5 min水平和垂直运动得分)。
1.3.2 标本制备 各组大鼠完成行为学观察和测试证明造模成功后,用4%多聚甲醛行局部灌流后分离出小脑组织,甲醛外固定,石蜡包埋,制备厚约5 μm的连续冠状切片,制备防脱切片〔3-氨丙基三乙氧硅烷(APES)行防脱处理〕。
1.3.3 尼氏染色 (Nissl染色) 石蜡切片脱蜡至水化→置于1%甲苯胺蓝中,50℃条件下染色20 min→双蒸水漂洗→分色→梯度乙醇脱水→二甲苯透明→封片。观察浦肯野细胞形态变化。
1.3.4 免疫组织化学染色 测定activated-caspase 3阳性细胞,按即用型免疫组织化学试剂盒说明书 (SABC法)操作。常规脱蜡至水,抗原修复,阻断内源性过氧化物酶,正常山羊血清封闭;Ⅰ抗:兔抗大鼠activated-caspase 3单克隆抗体 (1∶400);Ⅱ抗:生物素化山羊抗兔IgG;DAB显色;常规苏木素复染;脱水、透明、封片。用PBS代替Ⅰ抗进行免疫细胞化学染色,结果作为阴性对照。光镜下观察并计算阳性染色的浦肯野细胞数,即activated-caspase 3阳性细胞数。每张切片随机取目标区域6个高倍镜视野 (×400),测量并记录每个视野activated-caspase 3阳性细胞平均数。
1.3.5 TUNEL染色 采用TUNEL法标记凋亡细胞。切片常规脱蜡至水后,3%过氧化氢 (H2O2)室温封闭后,蛋白酶K于37℃环境下消化10~15 min,标记液37℃标记2 h后封闭30 min,生物素化地高辛抗体37℃反应30 min,DAB显色,苏木素复染;脱水、透明、封片。不含末端脱氧核甘酸转移酶 (TdT)反应液的为阴性对照。每张玻片分别随机取6个高倍镜视野,计数阳性细胞数和细胞总数,计算浦肯野细胞凋亡率,凋亡率 (%)=阳性细胞数/细胞总数×100%。
1.4 统计学方法 采用SPSS 16.0统计软件进行分析。计量资料以 ()表示,符合正态分布的多组间均数比较采用单因素方差分析 (One-way ANOVA)。检验水准 α =0.05。
2 结果
2.1 行为学观察 4组大鼠应激 (CUMS)后第1天体质量、糖水消耗比例、水平运动、垂直运动比较,差异均无统计学意义 (P>0.05);而应激后第7(除外体质量和水平运动)、14、21天4组大鼠上述指标比较,差异均有统计学意义 (P<0.05)。组间两两比较:应激后第14、21天卒中组、抑郁组、PSD组体质量和水平运动低于假手术组,应激后第14、21天抑郁组和PSD组体质量、水平运动低于卒中组;应激后第7、14、21天,卒中组、抑郁组、PSD组糖水消耗比例低于假手术组,应激后第14、21天抑郁组、PSD组糖水消耗比例低于卒中组;应激后第7天卒中组、PSD组垂直运动低于假手术组,应激后第14、21天卒中组、抑郁组、PSD组垂直运动低于假手术组,应激后第14天PSD组垂直运动低于卒中组,应激后第21天抑郁组、PSD组垂直运动低于卒中组,差异均有统计学意义 (P<0.05,见表1~4)。
表1 应激后不同时间各组大鼠体质量比较 (,g)Table 1 Comparison of weight of rats among different groups at different time points after stimulation
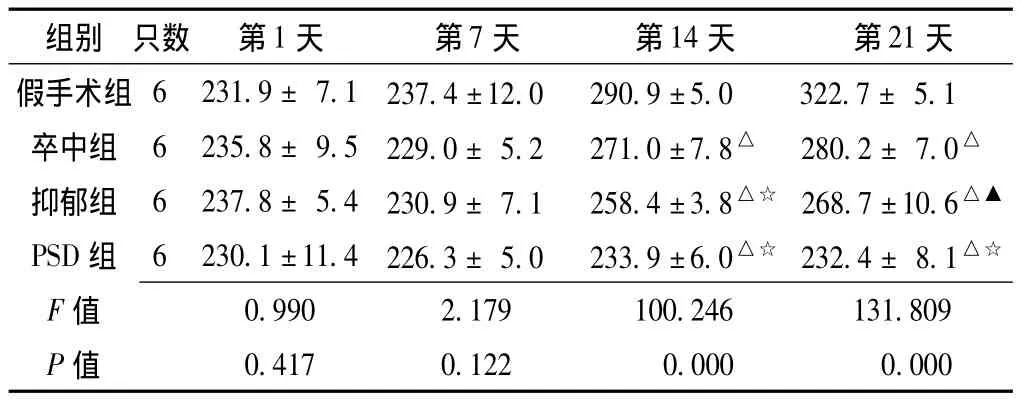
表1 应激后不同时间各组大鼠体质量比较 (,g)Table 1 Comparison of weight of rats among different groups at different time points after stimulation
注:与假手术组比较,△P<0.01;与卒中组比较,▲P<0.05,☆P<0.01
组别 只数 第1天 第7天 第14天 第21天假手术组 6 231.9 ± 7.1 237.4 ±12.0 290.9 ±5.0 322.7 ± 5.1卒中组 6 235.8 ± 9.5 229.0 ± 5.2 271.0 ±7.8△ 280.2 ± 7.0△抑郁组 6 237.8 ± 5.4 230.9 ± 7.1 258.4 ±3.8△☆ 268.7 ±10.6△▲PSD 组 6 230.1 ±11.4 226.3 ± 5.0 233.9 ±6.0△☆ 232.4 ± 8.1△☆F 0.990 2.179 100.246 131.809 P值值0.417 0.122 0.000 0.000
表2 应激后不同时间各组大鼠糖水消耗比例比较 (,%)Table 2 Comparison of sugar consumption rate of rats among different groups at different time points after stimulation
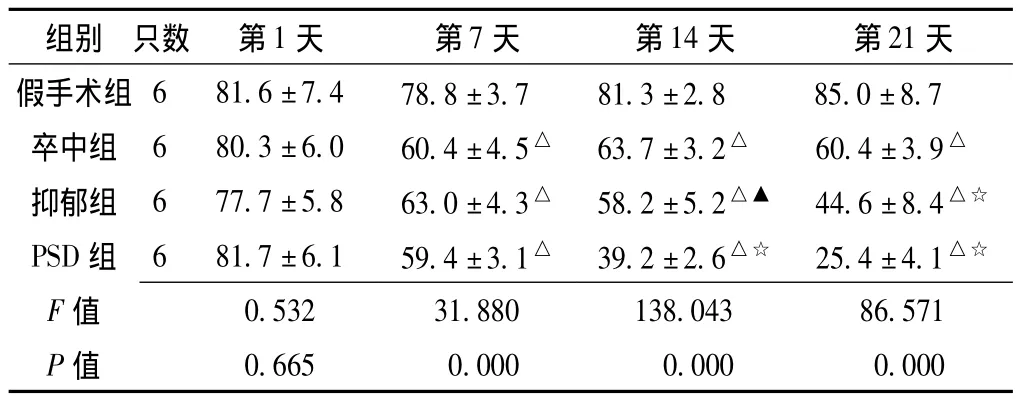
表2 应激后不同时间各组大鼠糖水消耗比例比较 (,%)Table 2 Comparison of sugar consumption rate of rats among different groups at different time points after stimulation
注:与假手术组比较,△P<0.01;与卒中组比较,▲P<0.05,☆P<0.01
组别 只数 第1天 第7天 第14天 第21天假手术组 6 81.6 ±7.4 78.8 ±3.7 81.3 ±2.8 85.0 ±8.7卒中组 6 80.3 ±6.0 60.4 ±4.5△ 63.7 ±3.2△ 60.4 ±3.9△抑郁组 6 77.7 ±5.8 63.0 ±4.3△ 58.2 ±5.2△▲ 44.6 ±8.4△☆PSD 组 6 81.7 ±6.1 59.4 ±3.1△ 39.2 ±2.6△☆ 25.4 ±4.1△☆F 值0.665 0.000 0.000 0.000 0.532 31.880 138.043 86.571 P值
表3 应激后不同时间点各组大鼠水平运动比较 (,次/5 min)Table 3 Comparison of horizontal motion of rats among different groups at different time points after stimulation

表3 应激后不同时间点各组大鼠水平运动比较 (,次/5 min)Table 3 Comparison of horizontal motion of rats among different groups at different time points after stimulation
注:与假手术组比较,△P<0.01;与卒中组比较,☆P<0.01
组别 只数 第1天 第7天 第14天 第21天假手术组 6 64.6 ±14.1 61.9 ±12.2 61.0 ±5.2 62.9 ±3.1卒中组 6 60.1 ±14.2 52.0 ± 2.8 50.0 ±3.2△ 46.6 ±2.1△抑郁组 6 64.5 ± 9.5 50.3 ±14.5 43.9 ±1.6△☆ 36.5 ±1.1△☆PSD 组 6 61.6 ±13.3 46.8 ± 4.6 38.7 ±3.6△☆ 31.1 ±1.6△☆F 0.179 3.117 42.461 182.313 P值值0.909 0.076 0.000 0.000
表4 应激后不同时间各组大鼠垂直运动比较 (,次/5 min)Table 4 Comparison of vertical motion of rats among different groups at different time points after stimulation
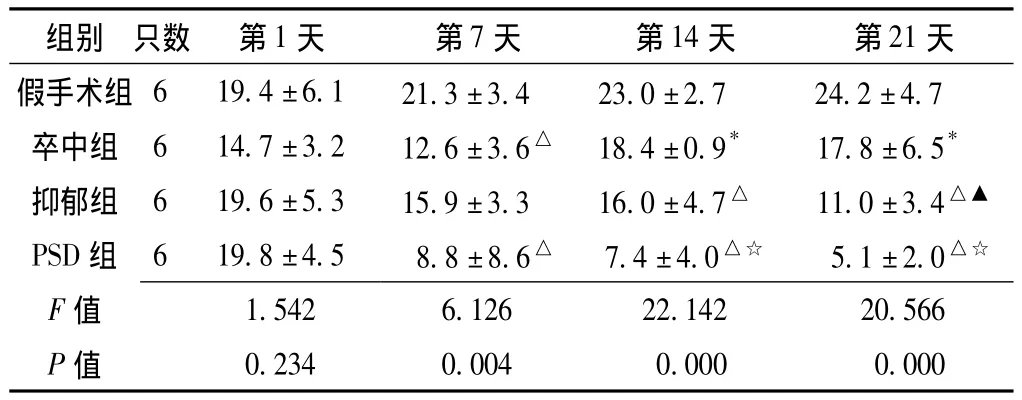
表4 应激后不同时间各组大鼠垂直运动比较 (,次/5 min)Table 4 Comparison of vertical motion of rats among different groups at different time points after stimulation
注:与假手术组比较,*P<0.05,△P<0.01;与卒中组比较,▲P<0.05,☆P <0.01
组别 只数 第1天 第7天 第14天 第21天假手术组 6 19.4 ±6.1 21.3 ±3.4 23.0 ±2.7 24.2 ±4.7卒中组 6 14.7 ±3.2 12.6 ±3.6△ 18.4 ±0.9* 17.8 ±6.5*抑郁组 6 19.6 ±5.3 15.9 ±3.3 16.0 ±4.7△ 11.0 ±3.4△▲PSD 组 6 19.8 ±4.5 8.8 ±8.6△ 7.4 ±4.0△☆ 5.1 ±2.0△☆F 值0.234 0.004 0.000 0.000 1.542 6.126 22.142 20.566 P值
2.2 尼氏染色结果 假手术组尼氏体在尼氏染色中清晰可辨,受染后呈块状,尼氏体大而数量多,反映神经元合成蛋白质的功能较强 (见图1A)。与假手术组比较,卒中组 (见图1B)、抑郁组 (见图1C)及PSD组(见图1D)均有尼氏体减少甚至消失,表现为尼氏体从核周开始崩解为细尘状颗粒,并逐渐向外扩展,进而完全溶解消失,细胞质着色浅,胞体肿胀。
2.3 免疫组织化学结果 大鼠小脑浦肯野细胞activated-caspase 3抗原的表达:小脑浦肯野细胞单层排列,呈梨形或烧瓶形,阳性染色细胞呈棕黄色,位于细胞质。假手术组activated-caspase 3阳性表达不明显。各组大鼠小脑浦肯野细胞activated-caspase 3阳性细胞数比较,差异有统计学意义 (P<0.05);其中卒中组、抑郁组、PSD组高于假手术组,抑郁组、PSD组又高于卒中组,差异均有统计学意义 (P<0.05,见表5、图2)。
2.4 TUNEL染色结果 光镜下凋亡神经元胞核深染为棕黄色,胞体缩小,可见核固缩和核破裂,非凋亡神经元胞核则呈蓝色。假手术组小脑浦肯野细胞偶可见细胞凋亡,推测是生理性死亡。各组大鼠小脑浦肯野细胞凋亡率比较,差异有统计学意义 (P<0.05);其中卒中组、抑郁组、PSD组高于假手术组,抑郁组、PSD组又高于卒中组,差异均有统计学意义 (P<0.05,见表5、图3)。
3 讨论
愈来愈多的研究表明,精神分裂症、抑郁等精神紊乱与小脑病变有关,而小脑急性和慢性病变均可引起小脑认知情感障碍综合征[12-14],且小脑低功能的程度与抑郁的严重程度呈正相关。既然结构决定功能,故推测PSD作为一种特殊抑郁,其发病时小脑存在结构性的病理改变,且这种病理改变与PSD发病相关。
本实验通过建立MCAO模型,模拟与PSD发病相关的“内源性机制学说”。待卒中急性期过后,加以CUMS和孤养模拟人类PSD发病机制中的社会应激因素。发现随着刺激时间的延长,PSD组大鼠体质量、糖水消耗比例 (心境低落,食欲下降)、水平运动及垂直运动 (活动减少,兴趣下降)下降,从刚开始刺激后低于假手术组到后来低于卒中组,说明大鼠整体精神不振,焦虑,毛色晦暗无光泽,进食减少,活动减少,不动时间延长,出现抑郁的核心症状——情绪低落、兴趣缺乏和乐趣缺乏。行为学观察和测试结果证实成功建立PSD模型。
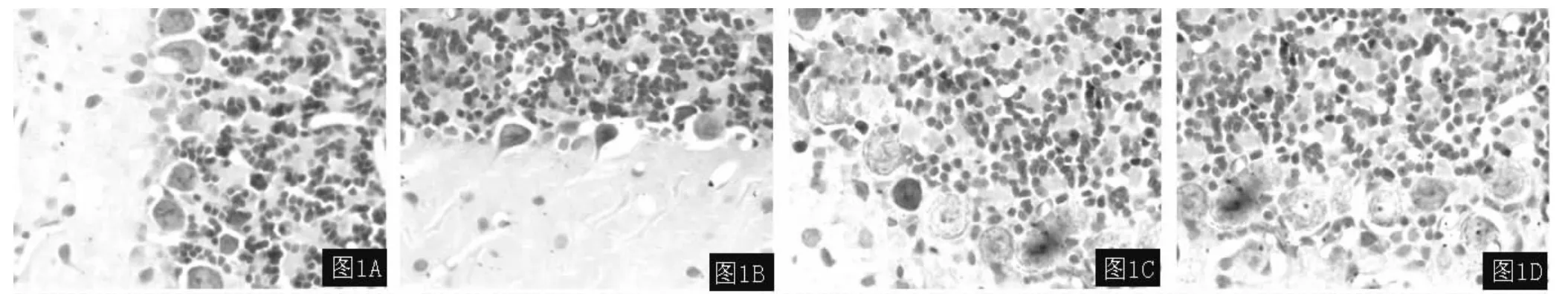
图1 各组大鼠小脑浦肯野细胞中尼氏小体的表达 (Nissl杂色,×400)Figure 1 Expression of Nissl bodies in cerebellar Purkinje cells in each group

图2 各组大鼠小脑浦肯野细胞中activated-caspase 3的表达 (SABC法,×400)Figure 2 Expression of activated-caspase 3 in cerebellar Purkinje cells in each group

图3 各组大鼠小脑浦肯野细胞凋亡情况 (TUNEL杂色,×400)Figure 3 The apoptotic changes in cerebellar Purkinje cells in each group
细胞凋亡是细胞受到伤害后为维持内环境稳定而发生的一种程序性细胞死亡。在中枢神经系统中,海马、纹状体、大脑和小脑皮质对缺血较敏感,缺血后易发生迟发性神经元的损伤,而在小脑皮质各神经元中尤以蒲肯野细胞最为敏感[15]。近期国内研究发现PSD大鼠海马和杏仁核区域凋亡细胞增加[16-17],而关于小脑区域是否存在神经元的凋亡坏死还不明了。脑缺血后细胞主要通过死亡受体途径[18-19]、线粒体途径[20-21]及内质网应激[22]途径发生凋亡坏死。半胱氨酸天冬氨酸蛋白酶3(caspase 3)是半胱氨酸蛋白酶家族的重要成员,属于凋亡执行蛋白类,多种凋亡相关蛋白级联反应通过caspase 3引发细胞凋亡。本实验发现,与假手术组、卒中组比较,PSD组大鼠小脑浦肯野细胞胞体肿胀,尼氏小体数量减少,细胞质着色浅,反映蛋白质合成功能下降;凋亡相关蛋白actived-caspase 3阳性细胞数和小脑浦肯野细胞凋亡率增加。以上结果提示PSD大鼠小脑浦肯野细胞凋亡增加,且这种改变与半胱氨酸蛋白酶依赖的凋亡途径相关。
表5 各组大鼠浦肯野细胞activated-caspase 3阳性细胞数及凋亡率比较()Table 5 Comparison of activated-caspase 3 positive cells and apoptosis rate of cerebellar Purkinje cells in each group
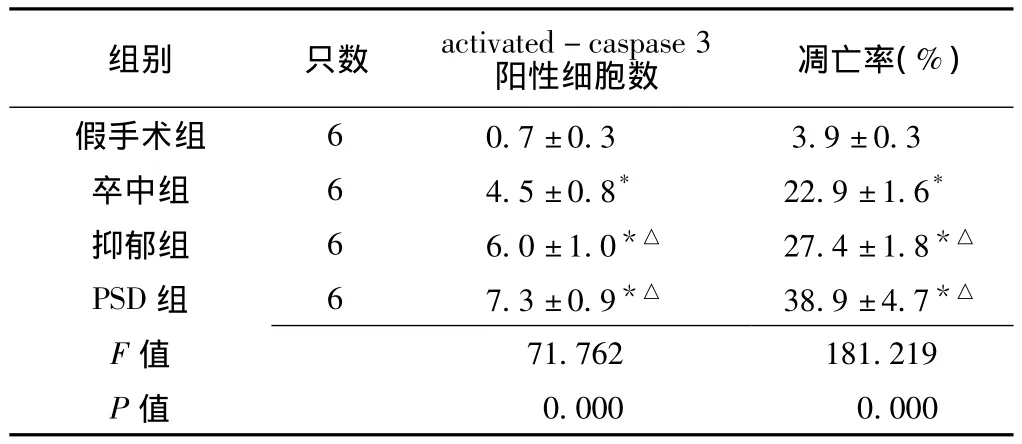
表5 各组大鼠浦肯野细胞activated-caspase 3阳性细胞数及凋亡率比较()Table 5 Comparison of activated-caspase 3 positive cells and apoptosis rate of cerebellar Purkinje cells in each group
注:与假手术组比较,*P<0.01;与卒中组比较,△P<0.01
组别 只数 activated-caspase 3阳性细胞数 凋亡率(%)假手术组 6 0.7 ±0.3 3.9 ±0.3卒中组 6 4.5 ±0.8* 22.9 ±1.6*抑郁组 6 6.0±1.0*△ 27.4±1.8*△PSD 组 6 7.3 ±0.9*△ 38.9±4.7*△F 值0.000 0.000 71.762 181.219 P值
小脑皮质可以参与感觉和运动信息的加工处理。蒲肯野细胞是小脑皮质发出的惟一能够传出冲动的神经元,其轴突止于小脑的深部核团 (齿状核和顶核),接受传入小脑的全部冲动。现已证实浦肯野细胞能通过释放γ-氨基丁酸 (GABA)抑制小脑深部核团的活动[23]。PSD大鼠小脑浦肯野细胞在发生凋亡坏死后对深部核团的抑制作用减弱,可反射性地引起炎性细胞因子网络失衡,这与学者提出的PSD发病的细胞因子假说相符[24]。本课题组前期实验结果提示电刺激小脑顶核细胞能改善浦肯野细胞超微结构的损伤,Sui等[25]在总结前人工作的基础上提出小脑低功能可能参与PSD发病的假说,以上均提示小脑损伤与PSD发病相关。
综上所述,本实验发现PSD大鼠小脑形态学发生改变,小脑浦肯野细胞凋亡增加,且这种改变与PSD发病相关,为明确PSD的发病机制提供了基础。
1 Berg A,Lönnqvist J,Palomäki H,et al.Assessment of depression after stroke:a comparison of different screening instruments[J].Stroke,2009,40(2):523-529.
2 王雪.脑卒中后抑郁对神经功能康复的影响研究 [J].实用心脑肺血管病杂志,2012,20(6):1023.
3 米彩卿.脑卒中与卒中后抑郁的相关性研究[J].实用心脑肺血管病杂志,2011,19(8):1254.
4 Buckner RL.The cerebellum and cognitive function:25 years of insight from anatomy and neuroimaging[J].Neuron,2013,80(3):807-815.
5 Rogers TD,Dickson PE,Heck DH,et al.Connecting the dots of the cerebro-cerebellar role in cognitive function:neuronal pathways for cerebellar modulation of dopamine release in the prefrontal cortex [J].Synapse,2011,65(11):1204-212.
6 王振发.脑卒中后抑郁临床研究[J].实用心脑肺血管病杂志,2011,19(5):794.
7 范明月,赵明,王炯妹,等.卒中后抑郁中西医发病机制的探讨[J].疑难病杂志,2011,10(12):951.
8 Liu JL,Li JP,Dong WW.A clinical study of fastigial nucleus electrical stimulation on post stroke depression[J].Chinese Journal of Clinical Rehabilitation,2003,7(13):1926-1927.
9 Willner,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic mild unpredictable stress and its restoration by a tricyclic antidepressant[J].Psychopharmacology,1987,93(3):358-364.
10 Katz RJ,Roth KA,Carroll BJ.Acute and chronic stress effects on open field activity in the rats implications for a model of depression[J].Neurosci Biobehay,1981,5(2):247-151.
11 Juenemann M,Goegel S,Obert M,et al.Flat-panel volumetric computed tomography in cerebral perfusion:evaluation of three rat stroke models [J].Neurosci Methods,2013,219(1):113-123.
12 Schmahmann JD,Weilburg JB,Sherman JC.The neuropsychiatry of the cerebellum-insights from the clinic[J].Cerebellum,2007,6(3):254-267.
13 Wolf U,Rapoport MJ,Schweizer TA.Evaluating the affective component of the cerebellar cognitive affective syndrome[J].Neuropsychiatry Clin Neurosci,2009,21(3):245-253.
14 张哲,蒋国卿,吕静静,等.中西医结合治疗卒中后抑郁的研究现状及进展[J].中国全科医学,2012,15(8):2715.
15 寿天德.神经生物学[M].北京:高等教育出版社,2006:340-344.
16 刘昊,王海涛,徐爱军,等.卒中后抑郁模型大鼠杏仁核神经元凋亡增加 [J].中风与神经疾病杂志,2011,28(8):685-687.
17 樊蔚虹,姚建平,赵文景.柴胡疏肝散对卒中后抑郁大鼠海马组织Bcl-2,Bax蛋白表达的影响[J].中国实验方剂学杂志,2011,1(3):181-183.
18 Mehta SL,Manhas N,Raghubir R.Molecular targets in cerebral ischemia for developing novel therapeutics[J].Brain Res Rev,2007,54(1):34-66.
19 Broughton BR,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebral ischemia [J].Stroke,2009,40(5):e331-339.
20 Sims NR,Muyderman H.Mitochondria,oxidative metabolism and cell death in stroke [J].Biochim Biophys Acta,2010,1802(1):80-91.
21 Ekert PG,Silke J,Hawkins CJ,et al.DIABLO promotes apoptosis by removing MIHA/XIAP from processed caspase-9 [J].J Cell Biol,2001,152(3):483-490.
22 关丽英,许彩民,潘华珍,等.内质网应激介导的细胞凋亡[J].生物化学与生物物理进展,2007,34(11):1136-1141.
23 Duguid IC,Smart TG.Retrograde activation of presynaptic NMDA receptors enhances GABA release at cerebellar interneuron-Purkinje cell synapses[J].Nature Neuroscience,2004,7(5):525-533.
24 Spalletta G,Bossu P,Robinson RG,et al.The etiology of poststroke depression:a review of the literature and a new hypothesis involving inflammatory cytokines[J].Molecular Psychiatry,2006,11:984-991.
25 Sui R,Zhang L,Min L,et al.Cerebellar dysfunction may play an important role in post-stroke depression [J].Med Hypotheses,2009,72(6):643-646.

