黄体酮凝胶剂的刺激性和子宫内膜转化实验研究
王 梅,侯艳霞,常占瑛,贺 冰,周雪峰(.新疆医科大学药学院,新疆 乌鲁木齐 8300;.新疆维吾尔自治区人民医院,新疆 乌鲁木齐 830000)
黄体酮凝胶剂的刺激性和子宫内膜转化实验研究
王梅1,侯艳霞1,常占瑛1,贺冰2,周雪峰1(1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.新疆维吾尔自治区人民医院,新疆 乌鲁木齐 830000)
目的:研究黄体酮凝胶剂阴道给药后的刺激性及其对子宫内膜Mcphail指数的影响,初步考察药效,探讨黄体酮凝胶剂的制剂可行性。方法:选取雌性未孕未产普通家兔20只,随机分成空白对照组,空白基质组,低、中、高剂量组,每组各4只。除空白对照组和空白基质组外,其余各组分别给予不同剂量黄体酮凝胶剂,考察黄体酮凝胶剂单次和多次给药后的阴道刺激性。在此基础上,采用子宫内膜转化实验检测黄体酮凝胶剂对家兔子宫的作用。结果:单次或多次给药后,与空白对照组相比,各组家兔均未出现明显的红斑、分泌物渗出。病理切片结果表明,单次或多次给药后,各组病理结果无明显差异。药效学结果表明,经过23 d给药,空白基质组,低、中、高剂量组,阳性对照组的Mcphail分级结果分别为(0.25±0.46)、(1.00±0.61)、(1.75±0.50)、(2.25±0.50)、(3.20±0.27);子宫病理切片结果显示低、中、高剂量组子宫逐渐由增生期向分泌期转变。结论:黄体酮凝胶剂单次或多次给药后,对家兔阴道和子宫无明显刺激性,Mcphail分级显示黄体酮凝胶剂具有一定的孕激素活性,能促进家兔子宫内膜发育,表明该剂型具有一定的制备可行性。
黄体酮;凝胶剂;刺激性;子宫内膜
黄体酮(progesterone)是由卵巢黄体分泌的一种天然孕激素,在临床中应用广泛,可用于治疗继发性闭经、机能不良性出血、黄体期支持、早产、黄体功能不全、经前综合征等,在激素补充疗法中,可防止长期服用雌激素所引起的子宫内膜增生,降低因单用雌激素所引起的绝经后妇女患子宫内膜癌的风险,且能更好的预防骨质疏松与牙周疾病[1-2]。
然而天然黄体酮存在口服后吸收差,具有较强的首过效应,生物利用度低的缺点,极大地限制了临床应用。黄体酮在临床上常用剂型为注射剂,由于注射剂是油溶液,注射后疼痛,而且黄体酮在激素补充疗法中需要长期给药,肌注给药患者的顺应性较低,所以提高黄体酮的生物利用度,开发黄体酮新型制剂,已成为黄体酮应用中的关键问题[3-4]。针对这一问题,本课题组研制了黄体酮凝胶剂,并对其阴道给药的初步药效进行了考察,为开发黄体酮凝胶剂提供参考。
1 实验材料
1.1仪器与试剂
黄体酮凝胶剂(新疆医科大学药学院药剂教研室,含量为0.3%,g/g);黄体酮注射液(浙江仙琚制药股份有限公司,规格1 mg : 10 mL,批号130217);10%甲醛溶液为分析纯。
1.2实验动物
雌性未孕未产普通家兔40只,体质量1.5 ~ 2 kg;新西兰雌性幼兔44只,体质量0.8 ~ 1.2 kg,均由新疆医科大学实验动物中心提供,动物合格证号:SCXK(新)2011-0003。
2 方法
2.1黄体酮凝胶剂单次给药后的阴道用药刺激性考察[5-7]
雌性未孕未产普通家兔20只,随机分成空白对照组,空白基质组,低、中、高剂量组,每组各4只。给药剂量按临床中黄体酮注射液的人用剂量推算至兔给药剂量作为中剂量组给药剂量,再根据黄体酮凝胶剂中含黄体酮量(0.3%,g/g)和家兔的体重推算至每只家兔应给予的黄体酮凝胶剂的剂量。低、中、高各剂量组给予黄体酮凝胶剂的用量分别为1.725、3.450、6.900 mg·kg-1,空白基质组按中剂量组对应的凝胶剂量给予空白凝胶剂。
称重后,将药物和赋形剂用自制给药管插入家兔阴道内长度约7 cm,采用注射剂将凝胶剂经由导管缓缓推入,然后在给药1、24、48、72 h分别观察动物进食、活动情况和阴道部位有无红斑、水肿、分泌物等。按照药理实验阴道刺激性肉眼观察评分标准和药物对阴道刺激性分级标准[8]对各组刺激性情况进行评分。72 h后将家兔处死,取阴道和子宫组织,剪开后平铺于滤纸上,吸干水分然后置于10%甲醇溶液固定24 h,HE染色后做病理切片检查。
2.2黄体酮凝胶剂多次给药后的阴道刺激性考察
雌性未孕未产普通家兔20只,随机分成空白对照组,空白基质组,低、中和高剂量组,每组各4只。给药剂量计算同“2.1”项下,黄体酮凝胶剂低、中、高各剂量组分别给予的剂量为1.725、3.450、6.900 mg·kg-1,空白基质组按中剂量组对应的凝胶剂量给予空白凝胶剂。
依照单次给药方法连续给药10 d,第1、5、10天分别称重,第10天给药后继续观察24、48、72 h,记录家兔阴道黏膜状况(有无红斑、水肿、分泌物等),同“2.1”项下方法对刺激性进行评分。72 h后将家兔处死,取阴道和子宫组织,HE染色后进行病理切片检查。
2.3子宫内膜转化实验[9-11]
采用兔子宫内膜转化实验,测定兔子宫内膜腺体增生程度,采用Mcphail评分法测定孕激素的活性。将新西兰雌性幼兔40只,随机分为空白基质组,阳性对照组,低、中、高剂量组,每组各8只,另取4只未给药幼兔作为空白对照组。给药剂量同“2.1”项下方法计算,低、中、高剂量组分别给予3.450、6.900、13.800 mg·kg-1黄体酮凝胶,空白基质组按6.900 mg·kg-1给予不含药的空白凝胶剂,阳性对照组以黄体酮注射液作为阳性对照,以13.800 mg·kg-1肌肉注射给药,空白基质组,低、中、高剂量组连续阴道给药23 d,第1、23天分别称重,第24天处死。阳性对照组连续给药10 d,第11天称重后处死。幼兔处死后,取部分子宫组织(自子宫与阴道连接处向卵巢方向用直尺量2 cm处),剪开平铺于滤纸上,吸干水分,置于10%甲醇溶液中固定24 h,HE染色后,做病理切片检查。根据内膜腺体增生程度,按Mcphail指数分级,Mcphail指数从0级到4级表示孕酮样反应依次增强,比较各组Mcphail指数的差异。
2.4统计学处理
采用SPSS10.0统计软件对数据进行处理,组间比较采用q检验进行统计分析。
3 结果
3.1黄体酮凝胶剂单次阴道用药刺激性实验
各组刺激性评分结果详见表1,结果显示与空白对照组相比,空白基质组出现少量分泌物;低剂量组红斑和水肿出现频率较高;中、高剂量组的家兔基本无红斑和水肿,高剂量组具有很少量的分泌物。这表明黄体酮凝胶剂单次阴道给药有轻微的刺激性,而低剂量组红斑和水肿高于中、高剂量组,其原因可能是个体差异。病理切片结果详见图1。结果表明,与空白对照组相比,各组家兔阴道上皮黏膜未见脱落,未见明显炎性细胞浸润,子宫内膜未发生变化。
3.2黄体酮凝胶剂多次阴道用药刺激性实验
各组刺激性评分结果详见表2,由结果可知与空白对照组相比,空白基质组,低、中、高剂量组在给药10 d后出现轻度的红斑和水肿,未见明显分泌物。病理切片结果显示各组均未出现明显上皮细胞脱落及炎性细胞浸润,各组病理切片结果无明显差异(见图2)。
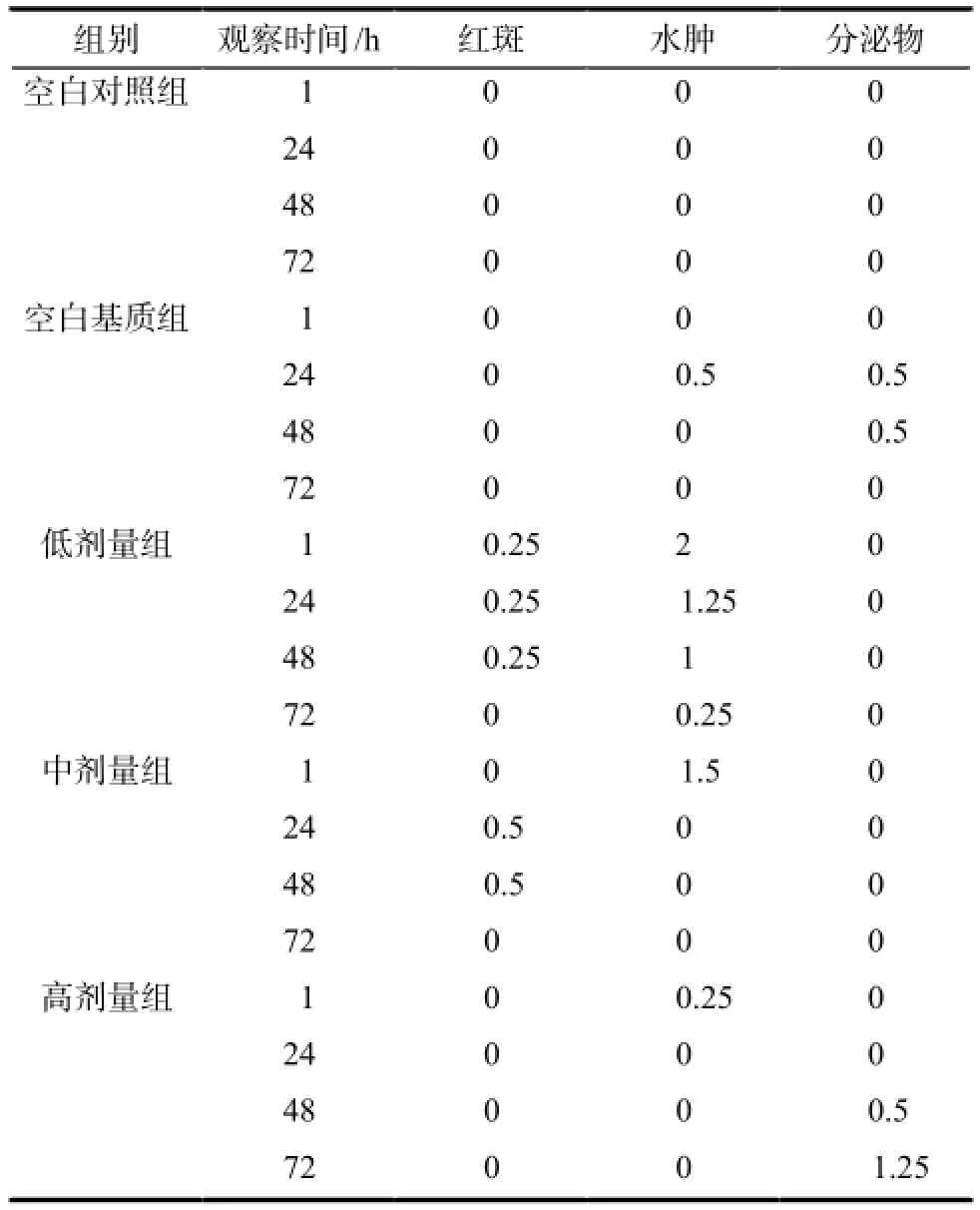
表1 单次给药后家兔阴道黏膜刺激性评分观察结果. n = 20Tab 1 Vaginal irritation score results of rabbits after single dose. n = 20
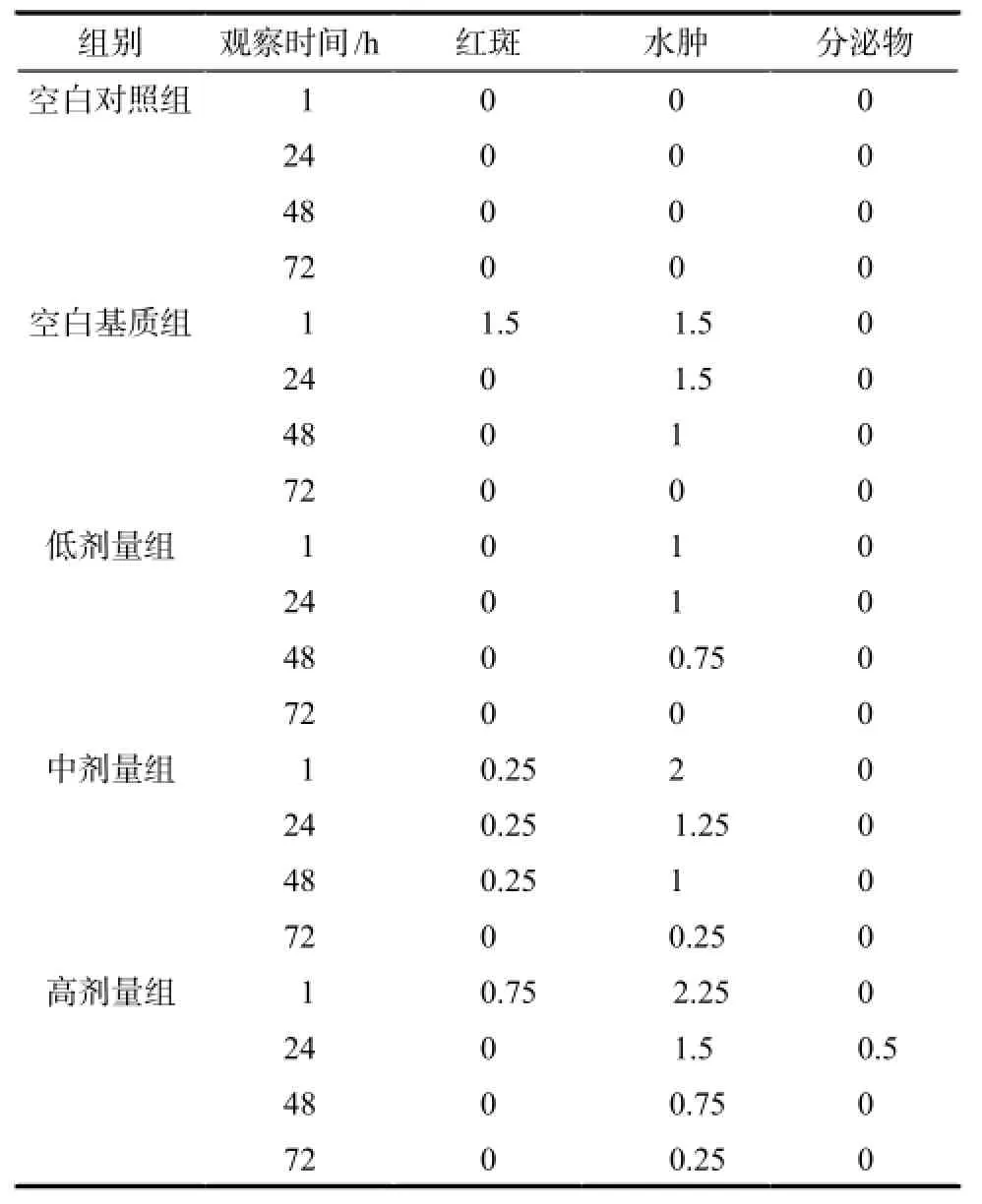
表2 多次给药后家兔阴道黏膜刺激性评分观察结果. n = 20Tab 2 Vaginal irritation score results of rabbits after multiple doses. n = 20
3.3子宫内膜转化实验
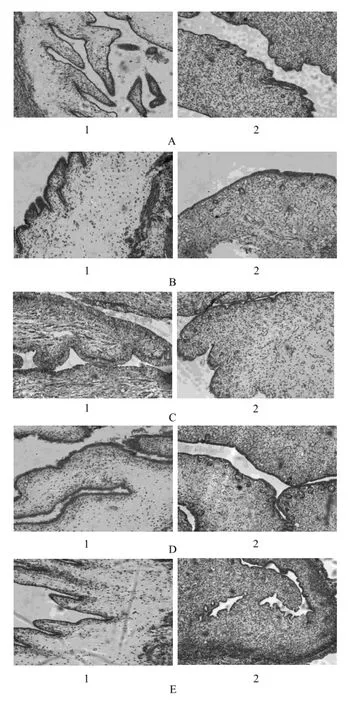
图1 各组病理切片图A – 空白对照组,B – 空白基质组,C – 低剂量组,D – 中剂量组,E – 高剂量组;1 – 阴道,2 – 子宫Fig 1 Pathological section photographs of each groupA – blank control group, B – blank matrix group, C – low dose group, D – middle dose group, E – high dose group; 1 – vagina, 2 – uterus
空白基质组,阳性对照组,低、中、高剂量组的Mcphail指数分别为(0.25±0.46)、(3.20±0.27)、(1.00±0.61)、(1.75±0.50)、(2.25±0.50)。结果表明,随着黄体酮凝胶剂用量的增加,子宫分级指数呈增加趋势,空白基质组、低剂量组与阳性对照组之间有显著性差异(P < 0.05),中、高剂量组与阳性对照组之间无显著性差异(P > 0.05)。由子宫病理切片可知,与空白对照组比较,阳性对照组,低、中、高剂量组子宫内膜有不同程度的增生,阳性对照组更为明显;低、中、高剂量组随着给药剂量的增加腺体开始延长;阳性对照组腺体几乎延伸到肌肉层,间质极少,同时腺体增多(见图3)。这说明给予黄体酮凝胶剂后,随着给药剂量的增加,子宫内膜厚度增加,幼兔的孕酮反应增强,提示药物有一定的作用。
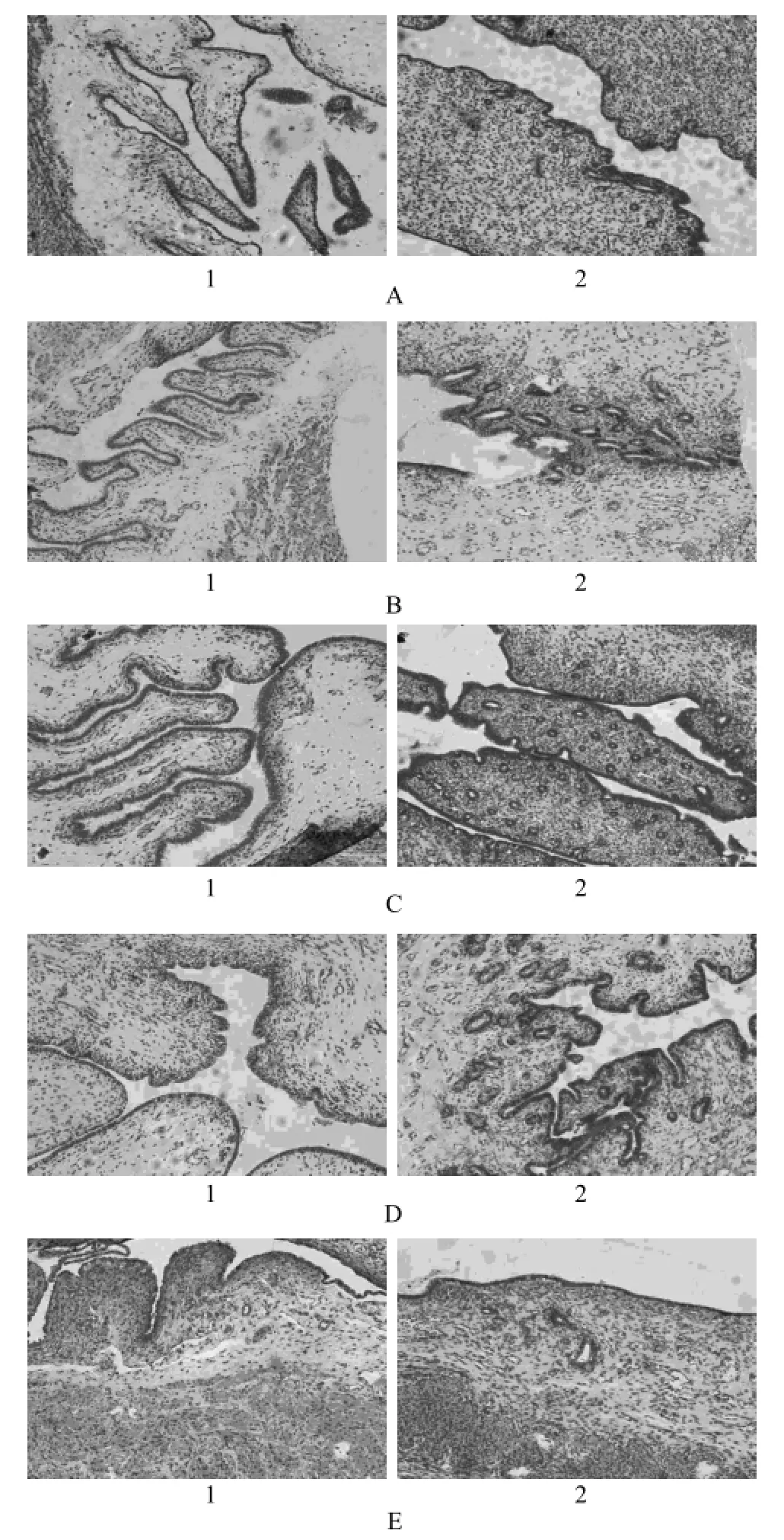
图2 各组多次给药后病理切片图A – 空白对照组,B – 空白基质组,C – 低剂量组,D – 中剂量组,E – 高剂量组;1 – 阴道,2 – 子宫Fig 2 Pathological section photographs after multiple doses of each groupA – blank control group, B – blank matrix group, C – low dose group, D – middle dose group, E – high dose group; 1 – vagina, 2 – uterus
4 讨论
4.1刺激性研究
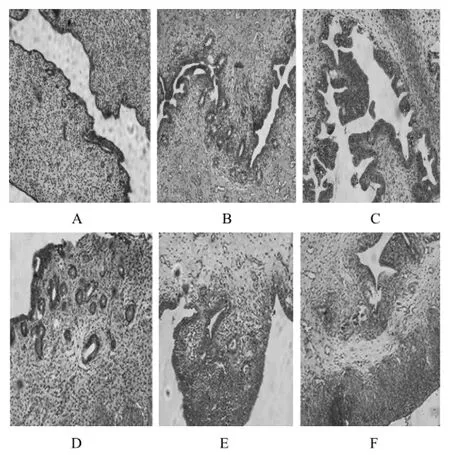
图3 子宫内膜转化实验家兔子宫病理切片A – 空白对照组,B – 空白基质组,C – 阳性对照组,D – 低剂量组,E – 中剂量组,F – 高剂量组Fig 3 Uterus pathological section of rabbits in endometrial transformation experimentA – blank control group, B – blank matrix group, C – positive control group, D – low dose group, E – middle dose group, F – high dose group
为了探讨本实验室制得的黄体酮凝胶剂的用药安全性,本文对黄体酮凝胶剂阴道给药的刺激性进行了实验研究。结果表明黄体酮凝胶剂单次给药后,与空白对照组相比,各组基本未出现红斑、水肿和分泌物,其中低剂量组家兔的红斑和水肿情况反而高于中、高剂量组,其原因可能是家兔的个体差异,也可能是实验过程中人为操作失误。黄体酮凝胶剂经过10 d多次给药后,与空白对照组相比,各组家兔也均未出现明显的红斑、分泌物渗出,中、高剂量组可见轻微水肿。病理切片结果表明,单次或多次给药后,与空白对照组相比,各组阴道上皮黏膜未见脱落,未见明显炎性细胞浸润,子宫病理切片未见明显变化。结合刺激性评分结果说明黄体酮凝胶剂单次或多次给药后,对家兔阴道和子宫无明显刺激性。
4.2子宫内膜转化实验
关于黄体酮凝胶剂的药效考察,本文采用文献[9]报道的子宫内膜转化实验来考察其对子宫的影响,初步判断其药效。该方法简便、可靠,其方法为选用未成熟幼兔,给药一段时间后,根据子宫分级标准(即Mcphail指数)判断子宫的分级,从而考察药物对子宫内膜、子宫腺体的影响。本文结果表明,幼兔在给予黄体酮凝胶剂后,子宫分级指数随剂量的增加而增大,呈现出剂量-效应关系,子宫病理切片也显示子宫内膜增厚,腺体增多,表明黄体酮凝胶剂与市售黄体酮注射液相比,同样可以发挥孕酮样作用。
综上所述,黄体酮凝胶剂单次或多次给药后,对家兔阴道和子宫无明显刺激性,子宫内膜转化实验表明黄体酮凝胶剂具有一定的孕激素活性,可使幼兔子宫内膜发育,具有一定的孕酮样作用,这为制备该剂型的可行性奠定了基础,但其药效作用仍有待进一步深入研究。
[1]朱颖军,高企贤.子宫内膜癌的孕激素治疗[J].中国实用妇科与产科杂志,2002,18(4):204-206.
[2]钱丽娟.黄体酮在临床实践中的应用[J].国外医学计划生育分册,2001,20(2):101-102,128.
[3]古丽巴哈尔·卡吾力,高晓黎.黄体酮乳膏皮肤安全性及初步药效学研究[J].新疆医科大学学报,2008,31(9):1151-1153.
[4]宁美英,何湘,顾忠伟.阴道内给药凝胶制剂的研究进展[J].国外医学药学分册,2005,32(5):346-349.
[5]王海梅,邵卿,梅胜尧,等.硝酸芬替康唑凝胶阴道刺激性研究[J].中外医疗,2014,33(15):61-62.
[6]金毅,王平,王晓炜,等.阴道刺激性试验的动物实验研究[J].哈尔滨医科大学学报,2012,46(3):235-237.
[7]秦玉花,刘银萍,王睿,等.奥硝唑与其他抗菌药物对照治疗妇科阴道感染有效性和安全性Meta分析[J].中国药物应用与监测,2013,10(1):7-9.
[8]叶祖光.中药毒性理论与安全性评价[M].北京:人民卫生出版社,2012:150-153.
[9]张丽娟,赵生俊,高晓黎,等.复方结合雌激素片的动物药效学研究[J].新疆医科大学学报,2006,29(5):424-426.
[10]孙丽英,于秋爽,胡晓阳,等.龟贞地黄饮对性早熟大鼠性腺发育的影响[J].中医药信息,2013,30(1):21-23.
[11]辛春.雌、孕激素对功血患者子宫血流动力学及子宫内膜微血管密度、血清因子的影响[J].海南医学,2012,23(21):3-5.
Irritation test and endometrial transformation experiment of progesterone gel on rabbits after vaginal delivery
WANG Mei1, HOU Yan-xia1, CHANG Zhan-ying1, HE Bing2, ZHOU Xue-feng1(1. College of Pharmacy, Xinjiang Medical University, Urumqi 830011, China; 2. Xinjiang Uygur Autonomous Region People's Hospital, Urumqi 830000, China)
Objective:To study vaginal irritation and effect on the lining of the uterus after vaginal delivered progesterone gel, and investigate the practicability of progesterone gel preparation.Methods:A total of 20 female rabbits were randomly divided into fi ve groups: blank control group, blank matrix group, low dose group, middle dose group, and high dose group. Then the irritation of progesterone vaginal gel was studied after a single dose and multiple doses. The results were scored according to vaginal irritation grading standard tables and classi fi cation criteria for vaginal irritation after observation. Furthermore, initial pharmacodynamics of progesterone gel was studied. The vagina and uterus of every rabbit was detected as well as the results were measured by transforming activity of each rabbit.Results:Compared with the blank control group, after a single dose and multiple doses, the rabbits in each group showed no obvious erythema and exudate. Biopsy results showed that there was no significant difference between rabbits in each group. In the initial pharmacodynamical study, the Mcphail indexes in blank matrix group, low, middle, high dose group and positive control group were (0.25 ± 0.46), (1.00 ± 0.61), (1.75 ± 0.50), (2.25 ± 0.50), (3.20 ± 0.27) respectively after 23 d treatments. Uterine pathological results showed the uterus changes from the proliferative phase to the secretory phase were all observed in the low, middle and high dose group.Conclusion:No significant vaginal and uterus irritation was observed in rabbits after vaginal delivery of progesterone gel with single or multiple doses. Furthermore, progesterone gel has certain progesterone activity, which shows that this formulation is feasible.
Progesterone; Gel; Irritation; Endometrium
R94
A
1672 – 8157(2014)06 – 0351 – 05
2014-07-08
2014-10-15)
新疆维吾尔自治区高校科研计划资助项目(XJEDU2011S25)
王梅,女,副教授,研究方向:药物新剂型及靶向给药制剂的研究。E-mail:wm630@163.com

