小口径聚乳酸-己内酯/纤维蛋白原管形支架的构建及生物相容性评价
方征东 胡何节 董智慧 王晓天 孙小杰 葛新宝
小口径聚乳酸-己内酯/纤维蛋白原管形支架的构建及生物相容性评价
方征东 胡何节 董智慧 王晓天 孙小杰 葛新宝
目的探索静电纺丝技术制备小口径聚乳酸-己内酯[P(LLA-CL)]/纤维蛋白原管形支架的方法,评价支架的生物相容性,探讨其作为血管组织工程材料的可行性。方法以P(LLA-CL)、纤维蛋白原为原料,制备小口径复合管形支架,观察支架的大体形态,并用扫描电镜观察三维结构;利用溶血试验、细胞毒性试验、皮下植入试验,评价支架材料的生物相容性。结果管形支架表面呈网格状三维结构,并有大小不等、互相交通的孔隙,孔径平均直径为(4.56±1.23)μm,表面纤维平均直径(318±56)nm;P(LLA-CL)/纤维蛋白原浸提液溶血率为2.87%±0.49%;细胞毒性实验示P(LLA-CL)/纤维蛋白原浸提液较阴性对照组无明显差异(P>0.05);皮下植入试验显示P(LLA-CL)/纤维蛋白原支架炎症反应轻微,材料逐渐降解。结论通过静电纺丝技术可以构建小口径P(LLA-CL)/纤维蛋白原管形支架,并具有良好的生物相容性,可作为组织工程血管的支架材料。
静电纺丝管形支架聚左旋乳酸-己内酯纤维蛋白原生物相容性
支架是血管组织工程研究的核心内容之一,理想的组织工程血管应具有合适的生物力学性能和良好的生物相容性[1]。由于构建的组织工程血管植入体内后与血液接触,因此用于构建组织工程血管支架的材料要具有良好的生物相容性,其血液相容性及细胞毒性的优劣直接影响了材料的临床应用。
静电纺丝技术是近年来发展的可以制备与天然
细胞外基质类似结构和空间构象的新技术,其制备的电纺纤维直径在毫米至纳米级别,并且具有高比表面积、高孔隙率、孔隙相连性好等特殊形貌[2-3],这些特性对细胞黏附、生长、增殖有益[4]。与其他纳米纤维制备方法相比,静电纺丝技术能够制备小直径(<6 mm)的管状结构[5],并具有简便快捷、成本低廉、结构可控等优点。这些特点使静电纺丝技术在组织工程血管支架构建领域具有突出优势。我们前期的研究表明,以聚乳酸-己内酯[P(LLA-CL)]和纤维蛋白原为原料,通过静电纺丝技术构建的膜片具有高孔隙率的纳米纤维结构和良好的细胞亲和力[6-7]。在本次试验中,我们以P(LLA-CL)和纤维蛋白原为原料,利用静电纺丝技术构建小口径管形支架,并通过体内、外实验评价材料及浸提液的生物相容性,探讨其作为血管组织工程材料的可行性。
1 材料与方法
1.1 材料
聚乳酸-己内酯(济南岱罡生物科技有限公司),纤维蛋白原(上海松力生物技术有限公司),六氟异丙醇(上海誉美化工有限公司),DMEM细胞培养液(GIBCO公司,美国),MTT干粉(Sigma公司,美国)。
1.2 实验方法
1.2.1 小口径P(LLA-CL)/纤维蛋白管形支架制备
以六氟异丙醇为溶剂,配制8%(w/v)的PLCL溶液;以体积比9∶1混合六氟异丙醇与DMEM溶液,配制成混合溶剂,将纤维蛋白原溶于混合溶剂中配制成100 mg/mL的纤维蛋白原溶液;PLCL溶液与纤维蛋白原溶液以体积比2∶1混合后,置于磁力搅拌器上混匀2~3 h,直至溶液澄清,保存待纺。
取配制好的P(LLA-CL)/纤维蛋白原溶液10 mL置于静电纺丝注射泵中,以直径5 mm的不锈钢金属杆作为收集装置。静电纺丝机参数:电纺距离12 cm、静电纺丝电压15 KV、聚合物推进速度2 mL/h、接受装置转动速率500 r/min、注射器横动速度10 cm/min。自金属杆上取下管状电纺支架,修剪两端后置于干燥器内干燥备用。
1.2.2 P(LLA-CL)/纤维蛋白原膜片三维结构观察
电纺支架固定在样品台上,喷金镀膜后,Stereoscan 360扫描电镜(Cambridge,UK)观察支架的表面形貌。采用图像分析软件Image J测定电纺膜的纤维直径和孔径。
1.2.3 管形支架浸提液制备
将P(LLA-CL)/纤维蛋白原管形支架裁剪为1 cm×1 cm×5 mm长条状膜片,以环氧乙烷消毒后密封备用。以生理盐水或含5%FBS的DMEM培养液为浸提介质,按3 cm2/mL(表面积/体积)的浸提比例加入浸提液,置于37℃电热恒温水浴箱中浸提72 h。浸提液制备后24 h内进行溶血试验、细胞毒性试验。
1.2.4 溶血试验
健康家兔心脏采血10 mL,加入枸橼酸钾溶液制备成新鲜抗凝兔血。取2 mL抗凝兔血加入到98 mL生理盐水中,配制成2%兔血混悬液。将P(LLA-CL)/纤维蛋白原管形支架浸提液、氯化钠注射液(阴性对照组)、蒸馏水(阳性对照组)2 mL加入到试管中,每组3管。上述试管置于37℃电热恒温水浴箱中保温30 min后,每支试管加入2 mL新鲜配制的稀释抗凝兔血,轻轻混匀,置37℃水浴箱中保温60 min。离心后吸取上清液移入比色皿内,用分光光度计在545 nm波长处测定吸光度(OD)值。按下方公式计算膜片的溶血率。若材料的溶血率小于5%,认为材料符合标准;溶血率大于5%则提示材料有溶血现象,不符合标准。

1.2.5 细胞毒性试验
取对数期生长的L929细胞,按5×103个/孔接种于96孔板中,培养24 h后弃去原培养液,更换成含5%FBS的材料浸提液100 μL进行培养,并设空白对照组(含5%FBS的DMEM培养基)、阴性对照组(高密度聚乙烯浸提液)和阳性对照组(体积分数为5%的DMSO溶液,每2天更换培养液。实验时每组设3个复孔。在培养1 d、3 d、5 d、7 d、9 d,分别于各组试验孔中加入5 g/L的MTT溶液20 μL,继续培养4 h后,小心吸出孔内液体,每孔内加入150 μL DMSO,置振荡仪上振荡10 min,选用波长490 nm的酶标仪测定OD值。按下式计算相对增殖率(RGR),进行毒性分级。

1.2.6 皮下植入实验
将P(LLA-CL)/纤维蛋白原管形支架材料剪为1.0 cm×1.0 cm的长条状膜片。取体质量为250±20 g的SD大鼠8只,雌雄不限,随机分成4组,分别为2周、4周、8周、12周观察组。SD大鼠背部脊柱两侧作0.5 cm切口,切开皮肤和浅筋膜,用钝性解剖法在皮肤切口部位下制备一个皮下囊,每个囊内植入一个膜片,膜片之间不能互相接触,以3-0丝线缝
合切口。术后常规饲养,1周后拆线。植入后1 d、3 d和5 d观察局部皮肤有无出血、红肿和试样排出等异常现象,以及大鼠的饮食、精神等状况。于每个观察期末,无痛处死SD大鼠。解剖后肉眼观察植入部位组织有无异常病变,并行HE染色,观察材料局部炎症反应情况。
1.2.7 统计学处理
所有计数资料以x±s表示,采用SPSS 10.0统计软件进行分析,多组间比较采用One-Way ANOVA分析,组间比较采用LSD检验。P<0.05认为差异有统计学意义。
2 结果
2.1 P(LLA-CL)/纤维蛋白原管型支架的三维结构
P(LLA-CL)/纤维蛋白原管形支架呈白色,质地柔软,弹性较好,受压后易变形。制备的小口径血管支架长度可根据需要修剪,一般为5~8 cm,内径5 mm左右,管壁厚度0.4~0.5 mm。
电镜下,支架表面及两端均可见光滑的纳米纤维,纤维直径为(318±56)nm,支架表面呈网格状三维结构,并有大小不等、互相交通的孔隙,孔径平均为(4.56±1.23)μm(图1)。
2.2 溶血试验
根据公式计算,P(LLA-CL)/纤维蛋白原管形支架浸提液溶血率为2.87%±0.49%,参照ISO10993标准及我国GB/Tl6886标准,材料溶血率低于5%为无溶血反应,可以认为此浸提液不引起溶血反应。
2.3 细胞毒性实验
主要通过细胞增殖来评价材料的细胞毒性。细胞接种在材料上后,前3 d增殖不明显,细胞数量没有快速增加。接种3 d后,实验组、阴性对照组及空白组细胞在纤维支架上开始生长,并在5 d后进人快速增长期,7 d后逐渐进入平台期(图2)。而阳性对照组没有见到明显的细胞生长。实验组浸提液在1 d、3 d、5 d、7 d、9 d的相对增殖率分别为81.96%、95.01%、83.33%、90.53%和92.43%,均>80%,细胞毒性为0-1级,与阴性对照组无明显差异(P>0.05),表示其对细胞的生长无毒性作用。
2.4 皮下植入实验
术后各实验鼠均存活,饮食、饮水及活动情况较术前无明显改变,皮肤切口愈合良好、未见脓性分泌物及异物排出。2周时,见植入的材料仍保持片状形态;4周时,材料形态仍较完整,局部出现软化现象;8周时,材料体积明显缩小,结构显示不清,易破损;12周时,材料基本结构破坏,肉眼未见明显的材料剩余。HE染色显示,2周时,材料结构保持完好,外围可见嗜中性粒细胞、单核细胞、巨噬细胞和淋巴细胞浸润(图3A);4周时材料结构仍清晰显示,但结构疏松,材料间隙部位可见浸润细胞,以单核细胞为主,中性粒细胞较少见(图3B);8周时,材料结构显示不清,材料部位可见新生的组织纤维与材料混杂,并可见少量新生血管,炎症反应明显减退(图3C);12周时材料大部分已降解,降解区被成纤维细胞和新生胶原纤维代替,内有较多的新生血管(图3D)。

图1P(LLA-CL)/纤维蛋白原支架(A:10×,B:2 000×,C:2 000×)Fig.1The SEM observation of the P(LLA-CL)/fibrinogen tubular scaffold(A:10×,B:2 000×,C:2 000×)
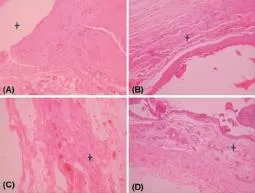
图3 P(LLA-CL)/纤维蛋白原皮下植入试验(HE染色,200×)Fig.3 Histological observation of the P(LLA-CL)/ fibrinogen tubular scaffold after subcutanous implantation by HE staining(200×)
3 讨论
理想的组织工程支架应具有与天然细胞外基质相类似的结构,使用传统的支架制备方法[8-9](如溶剂浇铸/粒子沥出、气体发泡、乳液冷冻干燥、熔融纺丝等)得到的纤维直径一般为5~500 μm,明显高于ECM的纤维直径(其中胶原纤维直径为50~500 nm),不利于种子细胞的黏附与增殖。本实验中,我们使用的静电纺丝技术[10]是通过在聚合物溶液上施加高压电场来制备细小纤维,所构建的支架纤维直径为(318±56)nm,与ECM的纤维直径类似。而且制备的这种纳米无纺膜具有高比表面积、高孔隙率、孔隙相连性好等特殊形貌,有利于细胞的生长增殖。另外,通过调整静电纺丝接受杆的直径,我们可以制备各种不同直径的小口径支架,因而在组织工程血管支架的构建中具有简便快捷、成本低廉等优点。
P(LLA-CL)是由左旋乳酸(L-LA)与ε-己内酯(ε-CL)单体共聚的脂肪族聚酯,因其出色的柔韧性和弹性、良好的生物相容性,在血管组织工程中已备受关注[11],但其缺乏良好的细胞相容性,不利于细胞生长[12]。纤维蛋白原是参与凝血过程后期的一个血浆糖蛋白,不仅参与凝血,且在创伤修复和肿瘤生长过程中也发挥了作用。上世纪80年代以来,以人血液或哺乳动物血液为原料制成的商品化纤维蛋白胶作为止血剂已广泛应用于临床[13],已证明纤维蛋白具有良好的生物相容性。实验研究也已证实,纤维蛋白基生物材料构建的三维支架具有可降解性、无毒、无免疫原性[14]。我们前期的研究表明,将P(LLA-CL)与纤维蛋白原以合适的比例混合后,可以弥补各自的不足,具有良好的生物力学性能及细胞亲和性[7]。本次试验中,我们进一步对其生物相容性进行评价,探讨此支架作为组织工程血管支架的可行性。
溶血实验可以敏感地反映材料对红细胞的影响,是一种特别有意义的材料筛选实验。本实验构建的P(LLA-CL)/纤维蛋白原支架材料浸提液溶血率为2.87%±0.49%,小于5%,可以认为材料无溶血性,能满足生物材料的医用要求。但应注意的是,溶血试验仅是与血液接触材料的一个粗筛实验,对于需要进入临床应用的、与血液直接接触的材料,还要详细检测材料对血液内血小板、白细胞、血浆蛋白、补体系统等成分的作用。体外细胞毒性试验是生物材料毒性评价中最基础、最重要的评价标准,在1 d、3 d、5 d、7 d、9 d各时间点上,实验组的毒性等级均为0或1级,即对细胞不产生明显毒性,是安全的。皮下植入实验中,管形支架膜片植入皮下后的2周内,局部以急性炎症反应为主,考虑与手术创伤有一定关系;4周后,材料周围炎症反应逐渐减轻,材料逐渐降解;至12周时,材料大部分已降解,材料降解区被成纤维细胞和宿主新生胶原纤维代替,表明P(LLA-CL)/纤维蛋白原管形支架具有良好的组织相容性。
上述体内、体外实验结果证实,以静电纺丝技术构建的小口径P(LLA-CL)/纤维蛋白原管形支架具有良好的体外/体内生物相容性,符合生物材材料的医用标准,有望进一步用于构建组织工程血管。
[1]Mitchel l SL,Niklason LE.Requirements for growing tissueengineered vascular grafts[J].Cardiovasc Pathol,2003,12(2):59-64.
[2]Neal RA,McClugage SG,Link MC,et al.Laminin nanofiber meshes that mimic morphological properties and bioactivity of basement membranes[J].Tissue Eng,2009,15(1):11-21.
[3]何晨光,赵莉.静电纺丝壳聚糖-明胶复合纤维的制备和体外生物相容性评价[J].组织工程与重建外科杂志,2012,8(6):316-322.
[4]Wang S,Zhang Y,Wang H,et al.Fabrication and properties of the electrospun polylactide/silk fibroin-gelatin composite tubular scaffold[J].Biomacromolecules,2009,10(8):2240-2244.
[5]Hong Y,Ye SH,Nieponice A,et al.A small diameter,fibrous vascular conduit generated from a poly(ester urethane)urea and phospholipid polymer blend[J].Biomaterials,2009,30(13):2457-2467.
[6]金良,胡何节,方征东.PLCL/纤维蛋白原静电纺丝膜片与兔骨髓间充质干细胞的体外生物相容性[J].安徽医科大学学报,2012, 47(2):776-780.
[7]Fang ZD,Fu WG,Dong ZH,et al.Preparation and biocompatibility ofelectrospunpoly(l-lactide-co--caprolactone)/fibrinogen blended nanofibrous scaffolds[J].Appl Surf Sci,2011,257(9): 4133-4138.
[8]陈思诗,杨庆,沈新元,等.溶剂浇铸-粒子沥滤法制备PBS/PCL组织工程支架[J].东华大学学报(自然科学版),2009,35(4):391-395.
[9]李喆,赵莉,崔磊,等.乳液冷冻干燥法制备明胶多孔支架及其性能研究[J].组织工程与重建外科,2006,2(2):92-95.
[10]Zuo W,Zhu M,Yang W,et al.Experimental study on relationship between jet instability and formation of beaded fibers during electrospinning[J].Polym Eng Sci,2005,45(5):704-709.
[11]Jeong SI,Kim SH,Kim YH,et al.Manufacture of elastic biodegradable PLCL scaffolds for mechano-active vascular tissue engineering [J].J Biomater Sci Polym Ed,2004,15(5):645-660.
[12]Lim JI,Yu B,Lee YK.Fabrication of collagen hybridized elastic PLCL for tissue engineering[J].Biotechnol Lett,2008,30(12): 2085-2090.
[13]王捷,区庆嘉,陈积圣,等.普通外科手术中应用医用生物胶的体会[J].现代临床普通外科,1997,2(1):14-16.
[14]Ye Q,Zünd G,Benedikt P,et al.Fibrin gel as a three dimensional matrix in cardiovascular tissue engineering[J].Eur J Cardiothorac Surg,2000,17(5):587-591.
Establishment and Biocompatibility of a Small Diameter Tubular Scaffold of Electrospun Poly(L-lactide-co-ε- caprolactone)/fibrinogen Blended Fibers
ObjectiveTo fabricate a small diameter tubular scaffold of P(LLA-CL)/fibrinogen by electrospinning fiber technique,to evaluate the biocompatibility of the P(LLA-CL)/fibrinogen scaffold and its feasibility for vascular tissue engineering.MethodsA small diameter tubular scaffold was fabricated by co-electrospinning blend of P(LLA-CL)and Fibrinogen.Gross morphology of the scaffold was observed and the 3-dimensional structure was observed by scanning electron microscope(SEM).Biocompatibilities of the tubular scaffold were evaluated in vivo and in vitro by acute hemolysis test,cytotoxicity test,and short-term test of subcutanous implantation.ResultsA randomly oriented nanofibrous structure with a well interconnected network of pores was observed.The diameter of the fiber at the outer surface was 318±56 nm and the average pore diameter was 4.56±1.23 μm;Hemolysis rate was 2.87%±0.49%;There was no significant difference of cytotoxicity between the P(LLA-CL)/fibrinogen tubular scaffold and negative control group(P>0.05).After the placement in rat subcutaneous pouches,the scaffolds were gradually biodegraded with little inflammatory reaction.ConclusionThe P (LLA-CL)/fibrinogen tubular scaffold can be fabricated by electrospinning fiber technique.It has good biocompatibility and could be potentially used as vascular tissue engineering scaffold material.
Electrospinning;Tubular scaffold;Poly(L-lactide-co-ε-caprolactone);Fibrinogen;Biocompatibility
Q813.1+3
A
1673-0364(2014)04-0207-04
FANG Zhengdong1,HU Hejie1,DONG Zhihui2,WANG Xiaotian1,SUN Xiaojie1, GE Xinbao1.
1 Department of Vascular Surgery,Provincial Hospital Affiliated to Anhui Medical University,Hefei 230001, China;2 Department of Vascular Surgery,Zhongshan Hospital,Fudan University,Shanghai 200032,China.Corresponding author:HU Hejie(E-mail:huhejie@hotmail.com).
安徽省自然科学基金(11040606M199,1208085MH151)。
230001安徽省合肥市安徽医科大学附属省立医院血管外科(方征东,胡何节,王晓天,孙小杰,葛新宝);200032上海市复旦大学附属中山医院血管外科(董智慧)。
胡何节(E-mail:huhejie@hotmail.com)。
2013年12月19日;
2014年3月2日)
10.3969/j.issn.1673-0364.2014.04.010

