蓝莓花青素的酰化及其抗氧化性评价
李路宁,陈 威,赵立仪,孙爱东
(北京林业大学生物科学与技术学院,北京100083)
蓝莓花青素的酰化及其抗氧化性评价
李路宁,陈 威,赵立仪,孙爱东*
(北京林业大学生物科学与技术学院,北京100083)
以三乙酰没食子酰氯作为酰基化剂,对蓝莓花青素提取物进行酰基化反应,制得酰基化蓝莓花青素产物没食子酸酰化花青素(GAA)。薄层色谱追踪反应进程、毛细管法测定熔点保证酰化剂合成纯度。对原花青素提取物、酰化中间产物和酰化花青素进行了红外光谱扫描,对比三者谱图,证实了酰基化实验的成功,并利用HPLC测定了酰化度。分别通过DPPH法、邻苯三酚自氧化法、卵磷脂脂质体法测定了酰化花色苷对于清除自由基、清除超氧阴离子和抑制脂质体过氧化的能力,酰化花色苷对于以上3实验的IC50分别为26.8、17.5、171.7μg/mL;相比较,原蓝莓花青素为39.8、27.0、219.7μg/mL;抗坏血酸为45.1、51.2、1084.8μg/mL。实验表明没食子酸酰化花青素方法切实可行,产物没食子酸酰化花青素的抗氧化性得到提升。
蓝莓,花青素,没食子酸,抗氧化
花青素是一类广泛存在于植物中的水溶性色素,它不仅为植物提供了蓝、紫和红等鲜艳的颜色,还在植物的传种授粉、抵御害虫与紫外线伤害等方面起到重要作用[1]。近些年的研究发现花青素对人体具有多种生理功能,如清除自由基[2]、抗突变[3]、抗肿瘤[4]、抗炎症[5]、抵御粥样动脉硬化和冠心病[6]、防护肝损伤[1]和增强视力[7]等。
花青素属于黄酮类化合物,其骨架为2-苯基苯并吡喃环结构[8](图1)。绝大多数花青素在3-,5-,7-位具有羟基,且在C-3位以糖苷键形式与不同的糖结合。B环中R1和R2位置取代基的不同和C-3位结合糖的不同构成了多种多样不同结构的花青素。同时,花色苷分子和糖残基上的羟基还可以进一步与一些脂肪酸和芳香酸结合,形成酰基化的花青素。一些研究表明酰基化的花青素在稳定性及抗氧化功能方面具有明显的优势[9-10]。目前国内外研究的酰化花青素主要为分离天然产物获得,而应用化学手段合成酰化花青素却鲜有报道。本文通过化学合成方法将富含羟基的没食子酸基团引入蓝莓花青素中,并对得到的没食子酰化花青素进行了体外抗氧化能力考察,为进一步了解花青素抗氧化能力与结构的关系及扩大花青素的应用提供理论依据。

图1 花青素基本结构Fig.1 Basic structure of anthocyanins
1 材料与方法
1.1 材料与仪器
野生蓝莓样品 产于大兴安岭林区,-80℃冷冻保存;没食子酸标准品 由林业科学研究院提供;DPPH 购置于Sigma公司;色谱纯甲醇 购置于Fisher公司;其他试剂 均为分析纯。
UV-1200紫外可见分光光度计 上海美谱达仪器有限公司;NEXUS 670傅里叶变换近红外光谱仪 美国热电尼高力公司;1100高效液相色谱仪 美国安捷伦公司;Senco R-201旋转蒸发仪 上海申顺生物科技有限公司;FA1604N电子分析天平 上海精密仪器厂;JB-5定时双向数显恒温磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;FD-18真空冷冻干燥机 北京德天佑科技有限公司。
1.2 实验方法
1.2.1 蓝莓花青素提取 依照Fossen等[11]方法,有改动。将-80℃下贮藏的蓝莓鲜果在0℃下解冻24h,然后将蓝莓研磨成浆,按照料液比1∶5比例加入含0.5%三氟乙酸(TFA)的甲醇溶液,在0℃下封口、遮光搅拌提取24h。将提取液离心,5000r/min,15min,收集上清液。将上清液用旋转蒸发器浓缩,控制温度在40℃以下,除去甲醇,得到浓缩液。
将浓缩液用1∶1(V∶V)乙酸乙酯萃洗,反复振荡,除去上层脂类物质,将此操作反复3次。将除去脂类的浓缩液通入离子交换树脂XAD-7柱,通入20倍柱体积含0.5%的三氟乙酸水溶液洗柱,除去非花青素化合物。然后通入含0.5%三氟乙酸甲醇溶液洗脱,收集洗脱液。将洗脱液于38℃下进行真空浓缩,然后置于冻干机中真空干燥,得到花青素粉末。
1.2.2 酰基化试剂的制备 将没食子酸置于120℃真空条件下烘干48h,充分除去水分,得到无水没食子酸。将无水没食子酸、无水乙酸酐、无水吡啶在0℃的条件下,按摩尔比3∶10∶10加入圆底烧瓶中,封口,在25℃的条件下搅拌反应10h。若反应不完全,可以适当延长反应时间。反应过程中通过薄层色谱法追踪反应的进度,当检测结果显示混合体系中没有没食子酸残余时,反应完成。
反应结束后,向反应系统中加入足量的10℃去离子水,搅拌。再利用HCl溶液调整混合体系pH为1,混合溶液中出现沉淀,静止过夜。抽滤,收集沉淀产物。产物用少量冷水冲洗,在室温下进行真空干燥,得到白色粉末,即为三乙酰没食子酸。用毛细管法测量其熔点。
按摩尔比1∶3将三乙酰没食子酸和无水亚硫酰氯加入到圆底烧瓶中,80℃搅拌回流反应4h,视情况可以适当延长反应时间,反应过程中通过薄层色谱法追踪反应的进度。反应结束后,在体系中加入二氯甲烷,溶解反应物,在50℃下通过多次旋蒸除去反应体系中的多余的亚硫酰氯,晶体析出。收集析出的晶体,室温下进行真空干燥,得到干燥产物,即酰化剂三乙酰没食子酰氯的白色粉末,并用毛细管法测量其熔点。三乙酰没食子酰氯溶解于二氯甲烷中密封避光保存。
1.2.3 蓝莓花青素酰基化 参考徐曼等[12]方法,有改动。将制备得到的三乙酰没食子酰氯、蓝莓花青素提取样品和吡啶以摩尔比5∶1∶5溶于二氧六环中,50℃回流反应4h,反应过程中需要不断搅拌。反应结束后,减压蒸出二氧六环和吡啶,加适量水稀释,得到产物晶体。过滤出产物,反复水洗,抽滤,晾干,真空干燥,得到酰化花青素的中间产物三乙酰没食子酰化花青素。
将三乙酰没食子酰化花青素溶于适量丙酮,在冰浴中降温至0℃,搅拌滴加稀氢氧化钠溶液,控制pH为8.5,于0℃静置3h。然后再用盐酸溶液酸化至pH为3,旋蒸除去丙酮,析出固形物,过滤后将固体产物溶于乙酸乙酯,酯层用水洗涤,旋蒸除去乙酸乙酯,得到没食子酰化花青素。
1.2.4 红外光谱扫描 通过KBr压片法,运用傅里叶变换红外光谱仪对原花青素提取物、酰化中间产物和酰化花青素进行红外光谱扫描,波长范围从4000~400cm-1,分辨率在2cm-1,将得到的谱图进行比较和鉴别。
1.2.5 HPLC测定酰化程度 将没食子酸酰化花青素溶于质量分数10%的氢氧化钠溶液中,完全水解后,用HPLC测定水解液中没食子酸含量,并计算没食子酰化程度。色谱柱ZORBAX Eclipse XDB-C18;柱温30℃;检测波长272nm;进样量10μL;流速0.6mL/min。洗脱条件:0min,3%A(甲醇),97%B(水,1.5%乙酸);线性变化至45min,57%A,43%B。
1.2.6 DPPH清除实验 参考Chu等[13]方法,有改动。将DPPH(1,1-二苯基-2-苦基苯肼)配制成200μmol/L的乙醇溶液。原花青素和没食子酸酰化花青素用乙醇配制成不同浓度梯度溶液待测。将2mL的DPPH溶液和2mL需测试的溶液加入到同一带塞口的试管中,混匀,在暗处静置30min,在517nm波长处通过分光光度计处测量DPPH的残留量。抗坏血酸用作正相对照。DPPH清除率按计算式为:
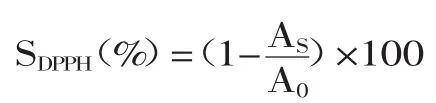
式中,AS为样品管在517nm下吸光值;A0为空白管在517nm下吸光值。
同时测定没食子酰化酸花青素、花青素提取物及抗坏血酸清除DPPH自由基反应前7min的反应进程。
1.2.7 超氧阴离子清除实验 参考Sun等[14]方法,有改动。用10mmol/L盐酸配制6mmol/L邻苯三酚溶液。首先测定邻苯三酚自氧化速率。将4.5mL 100mmol/L Tris-HCl与4.2mL去离子水混合,25℃水浴20min,加入0.3mL邻苯三酚溶液。在325nm处测定反应前4min的吸光值,半分钟读数一次。绘制时间-吸光值曲线,曲线为邻苯三酚自氧化速率,即每分钟吸光值改变量(ΔA/min)。然后测定酰化花青素和原花青素对邻苯三酚自氧化的抑制率。其他条件不变,反应体系中的2mL去离子水用不同浓度的样品液代替。Tris-HCl溶液用作零点参比,同样以抗坏血酸作为正相对照。超氧阴离子清除率计算式为:
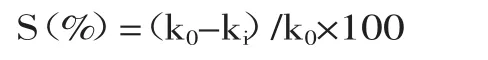
式中,k0表示邻苯三酚自氧化速率(ΔA/min);ki表示待测样品存在时的氧化速率(ΔA/min)。
1.2.8 脂质过氧化抑制实验 参考李卫等[15]和Lo等[16]方法,有改动。在冰浴超声波振荡环境下,用pH7.4的磷酸缓冲溶液配制10mg/mL卵磷脂溶液。配制TTH溶液:15g三氯乙酸,0.37g硫代巴比妥酸,2.1mL的12mol/L盐酸一次加入100mL去离子水中。将1mL卵磷脂溶液和1mL 0.4mmol/L硫酸亚铁溶液混合,再加入1mL不同浓度的待测溶液,将反应管在37℃下避光保温60min。随后加入2mL TTH溶液,100℃加热15min,终止反应。将混合液离心3000r/min,15min,测定上清液在532nm下吸光值。磷酸缓冲液作参比,抗坏血酸作正相对照。脂质过氧化抑制率的计算式为:
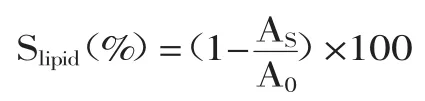
式中,AS为样品管在532nm下吸光值;A0为空白管在532nm下吸光值。
2 结果与讨论
2.1 酰化反应
由于受到基团活性及空间位阻的影响,需要先将没食子酸制备成酰氯才能成功与花青素分子结合。在没食子酰氯制备工程中,为避免没食子酸分子的羟基在反应中被破坏,采用先将其与保护基团结合,反应结束后再将保护基团水解掉的方法。实验中先将没食子酸与乙酸酐反应,将三个羟基用乙酰基保护起来,然后再制备酰氯,反应路线如图2所示,最后再将乙酰基在温和条件下水解去除。
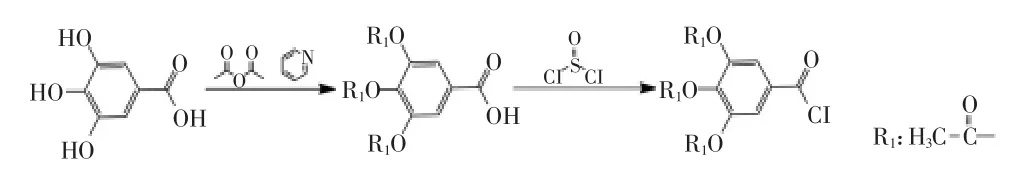
图2 三乙酰没食子酰氯合成路线Fig.2 Synthetic route of triacetyl gallic acid chloride
毛细管法测得三乙酰没食子酸熔点168~171℃,三乙酰没食子酸氯熔点105~107℃,与文献资料[17]数据相符。在实验过程中,有以下几点需要特别注意以保证实验成功:a.花青素层析柱纯化洗脱后,应充分除去花青素提取液中含有的残余甲醇;b.在整个酰基化反应过程中,应保持反应体系完全无水;c.若三乙酰没食子酸熔点区间较大,可利用碱溶酸沉重结晶法进一步纯化,缩小三乙酰没食子酸熔点区间,重复进行熔点测定实验是核实重结晶是否成功的关键;d.二氧六环的选择非常重要,它对于酰氯和花青素有合适的沸点和很好的溶解能力,可以作为酰基化反应的溶剂。
2.2 红外谱图与酰化度
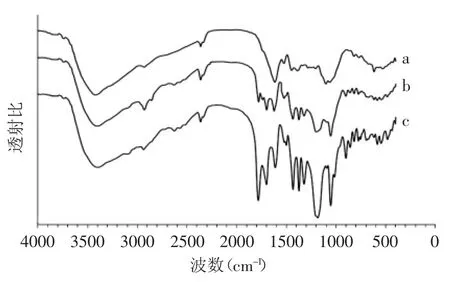
图3 蓝莓花青素(a)、没食子酰化花青素(b)、三乙酰没食子酰化花青素(c)的红外光谱图Fig.3 Infrared spectrum of blueberry anthocyanins(a),gallic acyl anthocyanins(b)and triacetyl gallic acyl anthocyanins(c)
蓝莓花青素(a)、没食子酸花青素(b)和三乙酰没食子酸花青素(c)的红外光谱图如图3所示。这三者的光谱图显示出一些共同点:处于3400~3420cm-1范围内的又宽又强的峰对应的是芳香环和糖基上面的羟基的伸缩振动;在2929cm-1处的信号峰表示的是亚甲基伸缩振动;苯环和杂环骨架结构的伸缩振动体现为在1620、1522、1447cm-1附近的信号峰。然而,在于三个光谱图中可以看到一些明显的不同信号,在1700~1780cm-1处,没食子酰化花青素和三乙酰没食子酸花青素有吸收峰,但是原花青素的谱线在此处并没有吸收峰,而这些信号正好证明酯羰基的存在,同时,因为酯羰基与苯环共轭,信号峰向低频移动。另外,没食子酸花青素、三乙酰没食子酸花青素在1322、1201、1184cm-1处的谱峰明显比花青素要强。在1201、1184cm-1处的信号峰对应着C-O-C基团的对称与反对称伸缩振动,而这两处的信号被称为“酯谱带”,可用以定性酯基基团。一般来讲,酯基的特征谱带是C=O和C-OC基团的伸缩振动峰。对比b和c的谱图,因为b中的保护基团被除去,所以在b的波谱图中酯基的特征峰明显地变弱。同时,在1433、1373cm-1处的甲基(与羰基相连接的)特征峰也以证明b中的保护基团已经被除去。
依据1.2.5步骤,通过高效液相色谱法测定了酰化花青素水解液中的没食子酸含量。由结果计算得,每0.1g没食子酸酰化花青素包含(0.26±0.05)mmol没食子酸,大约1分子的花青素和2分子没食子酸进行了结合(以矢车菊素-3-O-葡萄糖苷分子量进行计算)。
2.3 DPPH自由基清除实验
DPPH自由基是一类稳定的有机氮自由基,其醇溶液呈现紫色,在517nm处有很强的吸收。DPPH法是由Gadow最先创建的,是目前公认的评价植物化学物质抗氧化性的方法,并且可以在短时间内得出实验结果[18]。按1.2.6步骤,测定了原花青素和酰化花青素的自由基清除率,结果如图4所示,三者对于清除DPPH自由基均具有明显效果,清除率随着浓度的升高均明显增强。半抑制浓度(IC50)常被用来表示抗氧化剂清除自由基的能力,IC50数值越小,表明其抗氧化能力越强。蓝莓花青素、没食子酰化花青素和抗坏血酸的IC50分别为39.8、26.8、45.1μg/mL,对比而言,明显可以看出没食子酸酰化花青素清除自由基的能力最强,蓝莓花青素提取物的自由基清除能力比抗坏血酸稍强。在高浓度下,抗坏血酸清除自由基能力呈现出一定的线性关系,不同的是,没食子酸酰化花青素和蓝莓花青素提取物在浓度接近90%时,自由基清除率上升较慢。
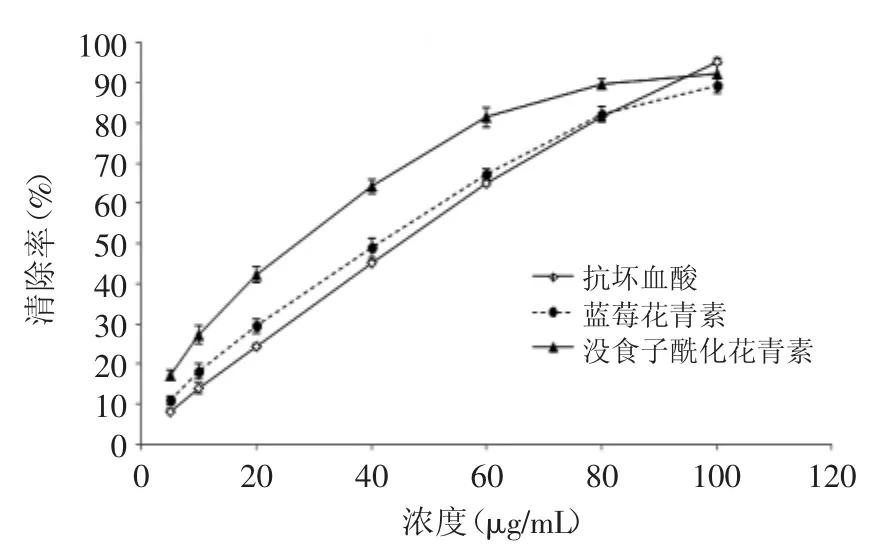
图4 蓝莓花青素、没食子酸酰化花青素、抗坏血酸对DPPH自由基的清除率Fig.4 Scavenging activity on DPPH free radical of blueberry anthocyanin,gallic acyl anthocyanins and ascorbic acid
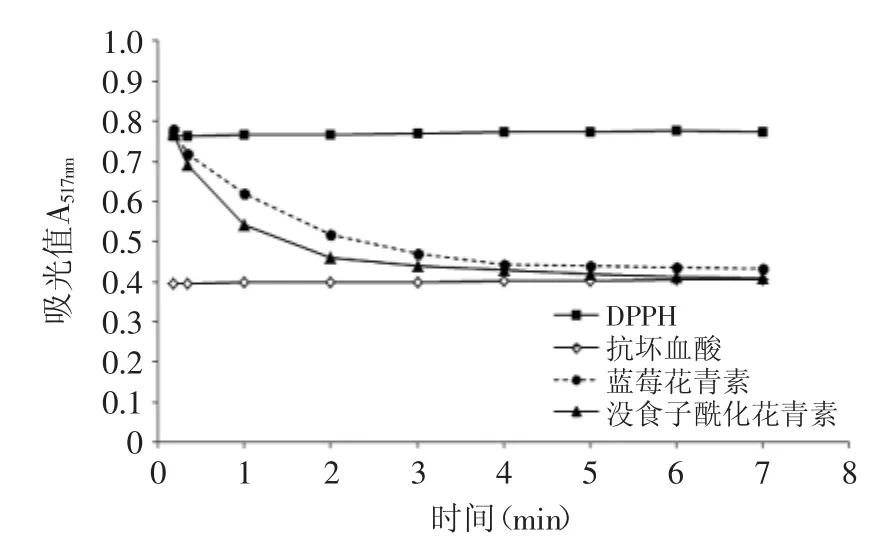
图5 蓝莓花青素、没食子酸酰化花青素、抗坏血酸清除DPPH自由基的反应进度Fig.5 The reaction time course of scavenging on DPPH free radical by blueberry anthocyanins,gallic acyl anthocyanins(GAA)and ascorbic acid
测定了前7min内DPPH自由基清除实验的反应进度,参与反应各物质加入体积和DPPH初始浓度保持与清除率实验一致,以蓝莓花青素提取物、没食子酸酰化花青素和抗坏血酸的IC50作为反应浓度,结果如图5所示。三者的反应速率不同,抗坏血酸清除DPPH自由基的反应时间较难确定,其反应在很短时间内就已经完成。相比之下,蓝莓花青素提取物和没食子酸酰化花青素的反应速率比较缓慢。对于蓝莓花青素而言,反应前4min吸光值持续明显降低。而没食子酰化花青素的反应时间比蓝莓花青素短,观察可知,反应3min时吸光值下降已趋于停止。综上所述,通过酰基化反应后,没食子酰化花青素对DPPH自由基清除能力与清除速率均比蓝莓花青素有所提高。
2.4 超氧阴离子清除实验
在碱性溶液中,邻苯三酚可迅速发生自氧化链式反应,产生一系列中间产物和超氧阴离子但在反应体系中存在清除剂的情况下,清除剂使生成的发生歧化反应转化为O2和H2O2,使邻苯三酚自氧化速率降低。在本实验条件下邻苯三酚自氧化速率为0.1524ΔA/min,其时间-吸光值曲线线性关系良好,R2=0.9984。如图6所示,三者对于超氧阴离子有明显清除作用,但在清除能力上显示出明显不同。蓝莓花青素、没食子酰化花青素和抗坏血酸清除超氧阴离子的IC50值分别为27.0、17.5、51.2μg/mL,清除超氧阴离子的能力依次为:没食子酰化花青素>蓝莓花青素>抗坏血酸。此外,对于没食子酰化花青素(R2=0.9280,浓度低于60μg/mL时)和抗坏血酸(R2= 0.9900)而言,浓度-清除率曲线线性关系较好,而蓝莓花青素(R2=0.7319)线性趋势较差。
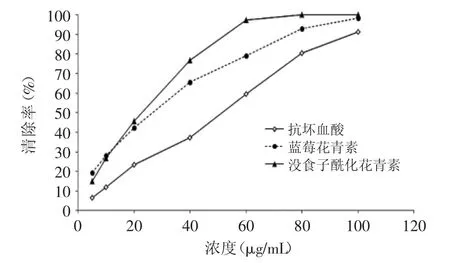
图6 蓝莓花青素、没食子酸酰化花青素、抗坏血酸清除对的清除率
2.5 脂质过氧氧化抑制实验
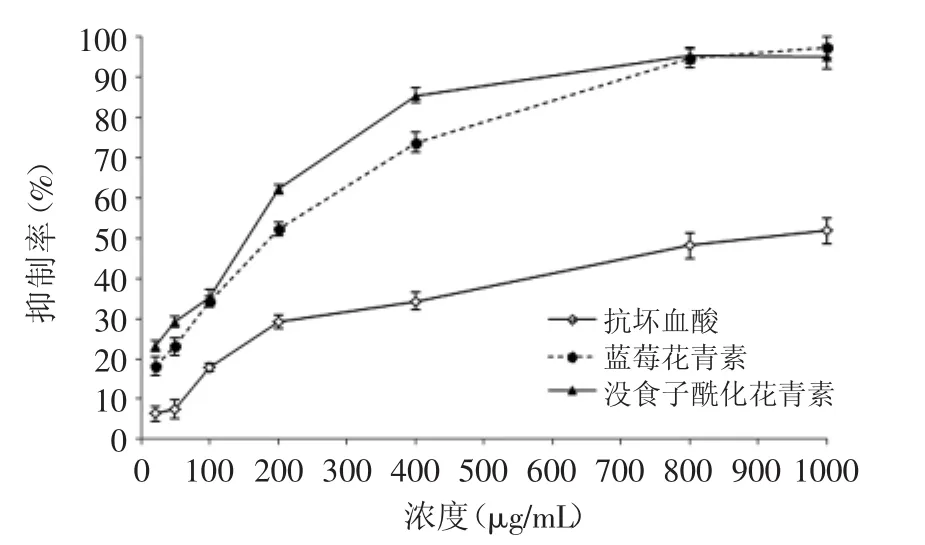
图7 蓝莓花青素、没食子酸酰化花青素、抗坏血酸清除对脂质过氧氧化的抑制作用Fig.7 Inhibition activity on lipid peroxidation of blueberry anthocyanin,gallic acyl anthocyanin and ascorbic acid
卵磷脂通常被用作细胞模型而进行体外的脂质过氧化的研究,卵磷脂所含的极低密度脂蛋白和低密度脂蛋白中的不饱和脂肪酸在铁离子的催化作用下,能发生过氧化,由此建立的铁离子诱导卵磷脂脂质体过氧化模型,可用以评价花青素的抗氧化活性[19]。在卵磷脂脂质体过氧化实验中,在532nm出检测硫代巴比妥酸反应物质可以测定脂质过氧化程度。如图7所示,三者都显示出对脂质过氧化的抑制能力,但能力强弱明显不同。蓝莓花青素、没食子酰化花青素和抗坏血酸抑制脂质过氧化的IC50值分别219.7、171.7、1084.8μg/mL。抑制脂质过氧化能力由强到弱同样为:没食子酰化花青素>蓝莓花青素>抗坏血酸。由IC50值可知,没食子酰花青素抑制能力大约为抗坏血酸的6.3倍,蓝莓花青素抑制能力是抗坏血酸的将近5倍。在浓度为20μg/mL时,没食子酰花青素抑制能力比蓝莓花青素和抗坏血酸分别高出26.8%和266%;在400μg/mL时,分别高15.7%和149%。结果表明没食子酰化花青素具有很强的抑制脂质过氧化活性。
3 结论
原花青素的抗氧化性已经得到了广泛研究,然而对于化学修饰花青素的研究却鲜有报道。本实验以三乙酰没食子酰氯作为酰基化剂,对蓝莓花青素提取物进行酰基化反应,制得没食子酰化花青素。对原花青素提取物、酰化中间产物和酰化花青素进行了红外光谱扫描,对比三者谱图,证实了酰基化实验的成功,酰化程度为每0.1g没食子酸酰化花青素包含0.26mmol没食子酸。分别通过DPPH法、邻苯三酚自氧化法、卵磷脂脂质体法测定了酰化花色苷对于清除自由基、清除超氧阴离子和抑制脂质体过氧氧化的能力,酰化花色苷对于以上3个实验的IC50分别为26.8、17.5、171.7μg/mL;蓝莓花青素为39.8、27.0、219.7μg/mL;抗坏血酸为45.1、51.2、1084.8μg/mL。实验表明没食子酸酰化花青素方法切实可行,产物没食子酸酰化花青素的抗氧化性得到提升。
[1]Chen J,Sun H N,Sun A D,et al.Studies of the protective effect and antioxidant mechanism of blueberry anthocyanins in a CCl4-induced liver injury model in mice[J].Food and Agricultural Immunology,2012,23:352-362.
[2]Tsuda T,Watanabe M,Ohshima K,et al.Antioxidative activity of the anthocyanin pigments cyaniding 3-O-β-D-glucoside and cyanidin[J].Journal of Agricultural and Food Chemistry,1994,42:2407-2410.
[3]Aoki H,Wada K,Kuze N,et al.Inhibitory Effect of Anthocyanin Colors on Mutagenicity Induced by 2-Amino-1-Methyl-6-Phenylimidazo[4,5-b]Pyridine(PhlP)[J].Foods and Food Ingredients Journal of Japan,2004,209:240-246.
[4]Malik M,Zhao C,Schoene N,et al.Anthocyanin-Rich Extract From Aronia meloncarpa E.Induces a Cell Cycle Block in Colon Cancer but Not Normal Colonic Cells[J].Nutrition and Cancer,2003,46:186-196.
[5]Wang Q,Xia M,Liu C,Guo H,et al.Cyanidin-3-O-betaglucoside inhibits iNOS and COX-2 expression by inducing liver X receptor alpha activation in THP-1 macrophages[J].Life Sciences,2008,83:176-184.
[6]Xia M,Ling W H,Zhu H L,et al.Anthocyanin attenuates CD40-mediated endothelial cell activation and apoptosis by inhibiting CD40-induced MAPK activation[J].Atherosclerosis,2009,202:41-47.
[7]Ghosh D,Konishi T.Anthocyanins and anthocyanin-rich extracts:role in diabetes and eye function[J].Asia Pacific Journal of Clinical Nutrition,2007,16:200-208.
[8]Clifford M N.Anthocyanins-nature,occurrence,and dietary burden[J].Journal of the Science of Food and Agriculture,2000,80:1063-1072.
[9]Brouillard R,Mazza G,Saad Z,et al.The copigmentation reaction of anthocyanins:a microprobe for the structural study of aqueous solutions[J].Journal of American Chemical Society,1989,11:2604-2610.
[10]Azevedo J,Teixeira N,Oliveira J,et al.Effect of sugar acylation on the antioxidant properties of Vitis vinifera red grape malvidin-3-glucoside[J].International Journal of Food Science and Technology,2011,46:343-349.
[11]Fossen T,Cabrita L,Andersen O M.Colour and stability of pure anthoycanins influenced by pH including the alkaline region[J].Food Chemistry,1998,63:435-440.
[12]徐曼,陈笳鸿,汪咏梅,等.落叶松原花青素的没食子酰化及其抗氧化活性增强效应[J].林产化学与工业,2010,30(6):55-60.
[13]Chu Y H,Chang C L,Hus H F.Flavonoid content of several vegetables and their antioxidant activity[J].Journal of the Science of Food and Agriculture,2000,80:561-566.
[14]Sun J,He H,Xie B J.Novel antioxidant peptides from fermented mushroom Ganoderma lucidum[J].Journal of Agricultural and Food Chemistry,2004,52:6646-6652.
[15]李卫,郑成,宁正祥,等.酯化修饰对二氢杨梅素性能的影响[J].食品科学,2011,32(1):66-69.
[16]Lo K M,Cheung C K.Antioxidant activity of extracts from the fruiting bodies of Agrocybe aegerita varalba[J].Food Chemistry,2005,89:533-539.
[17]Elsinghorst P W,Cieslik J S,Mohr K,et al.First gallaminetacrine hybird:Design and characterization at cholinesterases and the M2 muscarinic receptor[J].Journal of Medicinal Chemistry,2007,50:5685-5695.
[18]凌文华,郭红辉.植物花色苷[M].北京:科学出版社,2009.
[19]姜平平,吕晓玲,朱惠丽.花色昔类物质分离鉴定方法[J].中国食品添加剂,2003,24(4):108-111.
Acylation reaction of blueberry anthocyanins with gallic acid and evaluation of its antioxidant activities
LI Lu-ning,CHEN Wei,ZHAO Li-yi,SUN Ai-dong*
(College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China)
Gallic acyl anthocyanin(GAA)was prepared by chemical acylation with blueberry anthocyanins and gallic acid,and triacetyl gallic acid chloride was synthetized as a relevant acylating agent.The reaction process was monitored by thin-layer chromatography,and purity of the product was determined by melting point measured with capillary tube method.The infrared spectra of GAA,triacetyl gallic acyl anthocyanins,and original anthocyanins were compared and the results proved synthesis successfully.Acylation degree was measured with HPLC.The antioxidant activity of GAA was tested through comparison with original blueberry anthocyanin extracts by using different techniques.The antiradical activity,reducing O2-·activity,and inhibition toward lipid peroxidation of GAA were measured by using 1,1-diphenyl-2-picrylhydrazyl,pyrogallot autoxidation,and lecithin liposome method,respectively.The IC50values of GAA for the aforementioned assays were 26.8,17.5,171.7μg/mL,respectively.The IC50values of the original anthocyanin extracts were 39.8,27.0,219.7μg/mL,respectively.The IC50values of ascorbic acid were 45.1,51.2,1084.8μg/mL,respectively. Results showed that the acylation method could increase the antioxidant activity of original anthocyanin extracts.
blueberry;anthocyanin;gallic acid;antioxidant
TS255.1
A
1002-0306(2014)06-0102-05
2013-06-20 *通讯联系人
李路宁(1989-),男,硕士研究生,研究方向:天然产物开发与利用。
国家自然科学基金(31271981)。

