鲢鱼鱼糜采肉下脚料碱溶蛋白的制备工艺研究
陈二生,许学勤,许艳顺,姜启兴
(江南大学食品科学与技术国家重点实验室,食品学院,江苏无锡214122)
鲢鱼鱼糜采肉下脚料碱溶蛋白的制备工艺研究
陈二生,许学勤*,许艳顺,姜启兴
(江南大学食品科学与技术国家重点实验室,食品学院,江苏无锡214122)
以鲢鱼鱼糜采肉下脚料为原料,采用酸碱法(pH-shifting)制备碱溶蛋白,主要探讨原料的储藏、提取pH、提取时间、提取温度、提取料液比以及沉淀pH对碱溶蛋白制备工艺的影响。结果表明,最佳提取pH为12.0,提取时间为15min,提取温度为5℃,采用两段式提取、提取料液比为1∶6(3+3),最佳沉淀条件为pH5.5,在此条件下,碱溶蛋白回收率约为82%。原料的不同处理对碱溶蛋白的制备无显著影响。
鲢鱼鱼糜采肉下脚料,酸碱法,碱溶蛋白
鲢鱼是我国养殖产量最大的大宗淡水鱼,由于多肌间刺,及风味较差,因此鲜销价格较低,一定程度上制约了这种鱼的市场价值[1]。近年来,随着淡水鱼糜制备技术的发展,人们尝试将鲢鱼加工成鱼糜,也取得到了一定成效。然而,鲢鱼鱼糜制备中的采肉过程会产生鲜鱼总重约32%的下脚料[2]。到目前为止,这类下脚料尚未得到很好利用,既造成了资源浪费,也带来环境污染压力。
酸碱法(pH-shifting)提取动物蛋白是国外学者发明的一种蛋白质回收的技术[3-4]。该方法应用于新鲜鱼肉可获得约80%的蛋白回收率[3-12],而应用于鱼类加工下脚料时,蛋白回收率往往只有约50%[13-14]。这种差异主要是因为新鲜鱼肉蛋白质中约90%为碱溶蛋白[15],而鱼体中的蛋白质按对0.1mol/L NaOH的溶解性可分为碱溶蛋白和碱不溶蛋白部分[16],其中碱溶蛋白部分具有良好的萃取性,采用酸碱法可以获得较高的蛋白回收率;碱不溶蛋白部分80%以上为胶原蛋白[15],较弱酸碱条件下难以溶解。鱼类加工下脚料蛋白质中约40%为碱不溶蛋白[17],采用酸碱法制备蛋白的回收率不高。为了提高蛋白回收率并对鲢鱼鱼糜采肉下脚料中的蛋白质进行综合利用,首先采用酸碱法对鲢鱼鱼糜采肉下脚料中的碱溶蛋白进行制备,然后以剩余的沉淀为原料制备明胶,本文主要对碱溶蛋白的制备工艺进行介绍。
在本工作中,主要研究了原料的储藏、提取pH、提取时间、提取温度、提取料液比以及沉淀pH对碱溶蛋白制备工艺的影响,旨在为提高鲢鱼鱼糜加工副产品的附加值提供技术参考。
1 材料与方法
1.1 材料与仪器
鲢鱼 鲜活,体重3.0~4.0kg,购于无锡雪浪市场;氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钠、磷酸氢二钾、三氯乙酸(TCA)等常用化学试剂 均为分析纯。
FE20型pH计 梅特勒-托利多仪器(上海)有限公司;IKA基本型分散机(高速分散机) 上海施迪曼流体技术有限公司;SIGMA4K15型台式高速冷冻离心机 北京亚力恩科学器材公司;DS-1型高速组织捣碎机 上海标本模型厂;IKA电动搅拌器 广州市博勒泰贸易有限公司;YCR-180型鱼糜采肉机 上海华夏渔业机械仪器工贸公司;其他 为实验室常用仪器。
1.2 实验方法
1.2.1 鲢鱼鱼糜采肉下脚料的制备及处理 新鲜鲢鱼去头、去鳞、去内脏后,冲洗干净,切成片状然后立即通过鱼糜采肉机,并收集采肉下脚料作为原料。然后,用高速组织捣碎机把下脚料处理成稠浆状,封装塑料袋中,并在不同条件下保存。-20℃条件下储藏10h(标记为A);-20℃储藏6个月(标记为B);-20℃储藏1年(标记为C)。提取前,下脚料用流动的自来水解冻。
1.2.2 下脚料碱溶蛋白制备工艺流程 采用酸碱法(pH-shifting)制备鲢鱼鱼糜采肉下脚料碱溶蛋白质的工艺流程如下:采肉下脚料→取样→加冰蒸馏水均质→调pH→低温搅拌提取→第一次离心分离→收集上清液、调pH至蛋白等电点使蛋白沉淀→第二次离心分离→沉淀(即为碱溶蛋白)。
1.2.3 制备工艺要点
1.2.3.1 原料 鲢鱼鱼糜采肉下脚料,处理和储藏条件同1.2.1所述。
1.2.3.2 提取 原料在恒定的温度下在适当的时间内与提取液混合,均质1m in,悬浊液放入大的烧杯中并采用IKA电动搅拌器搅拌,搅拌的速度为200r/m in。在提取过程中根据需要加入2mol/L盐酸或2mol/L氢氧化钠,以保持提取液中pH的恒定。
1.2.3.3 离心 提取后把蛋白提取液转移到塑料离心杯中,使用冷冻离心机(-20℃,10000×g,20m in)离心,收集上清液,记录所得上清液的体积,采用凯氏定氮法测定蛋白含量,并计算蛋白的提取率。
1.2.3.4 等电点沉淀 取在最适提取条件下的蛋白离心上清液各50m L,分别加入2mol/L HCL或NaOH溶液调节其pH(变化范围:pH=1~11),然后-20℃条件下保持30min,保证蛋白质能充分沉淀,然后使用冷冻离心机(-20℃,10000×g,20m in)离心,记录所得上清液的体积,采用凯氏定氮法测定蛋白质含量,并计算蛋白质的沉淀率。
1.2.4 提取工艺条件的确定
1.2.4.1 提取pH的确定 取50g-20℃条件下保存10h的下脚料匀浆,固定料液比为1∶9,提取温度10℃,提取时间10m in。分别将匀浆液的pH调节至2、3、4、5、5.5、6、7、8、9、10、11、12,然后进行提取并分别测定对应pH提取液的提取率。
1.2.4.2 提取时间的确定 取50g-20℃条件下保存10h的下脚料匀浆,提取pH为前面步骤所确定,固定料液比为1∶9,提取温度10℃。测定在不同提取时间的提取率(提取时间变化范围:5~60min)。
1.2.4.3 提取温度的确定 取50g-20℃条件下保存10h的下脚料匀浆,提取液pH、提取时间为前面步骤所确定,固定料液比为1∶9。测定在不同提取温度的提取效果(提取温度变化范围:5~30℃)。不同温度所得离心上清液中加入50%三氯乙酸(TCA)使上清液中TCA浓度最终达到10%,在离心机中以10000×g离心20min,上清液部分为非蛋白氮,沉淀部分为蛋白质,总上清氮、蛋白质氮和非蛋白质氮含量测定均采用凯氏定氮法。
1.2.4.4 提取料液比的确定 取50g-20℃条件下储藏10h的下脚料匀浆,提取液pH、提取时间、提取温度为前面步骤所确定。分别采用两种方式进行提取,一段式:在提取时间内仅进行一次提取,然后把提取液转移到塑料离心杯中,使用冷冻离心机(-20℃,10000×g,20min)离心,丢弃沉淀,收集上清液;两段式:在提取时间内进行两次提取,第一次提取离心后的沉淀,再次用新鲜的提取液进行二次提取,并合并两次提取所得的上清液。两段式每次提取时间为一段式的一半。测定在不同料液比的提取率,一段式(料液比变化范围:1∶3~1∶15),两段式[料液比变化范围:1∶4(3+1)~1∶8(4+4),其中1∶4(3+1)表示两段式第一次提取的料液比为1∶3,第二次提取的料液比为1∶1,总提取料液比为1∶4]。
1.3 测定方法
1.3.1 基本理化指标的测定 水分、脂肪、蛋白和灰分含量采用AOAC方法进行测定[18]。
1.3.2 蛋白组分的测定 鲢鱼鱼糜采肉下脚料蛋白质组分的分离测定参照Wonnop Visessanguan等方法[16],并略加改进。具体方法如下:取下脚料匀浆100g,加入10倍体积的0.1mol/L NaOH连续搅拌提取8h,离心(10000×g,20m in),上清液中的蛋白为碱溶蛋白,沉淀部分的蛋白为碱不溶蛋白。上清液中的碱溶蛋白调节pH至7.0,冷冻干燥后得碱溶蛋白。
碱溶蛋白组分离测定如下:取10g碱溶蛋白,加入10倍体积溶液A(15.6mmol/L Na2HPO4,3.5mmol/L KH2PO4,pH 7.5),用高速分散机在10000r/m in下均质1min,均质液在冷冻离心机中离心(-20℃,10000×g,20m in),此提取过程重复操作二次,沉淀部分即为肌原纤维蛋白。上清液部分:加入50%TCA使上清液最终TCA浓度达到10%,在离心机中离心(-20℃,10000× g,20min),上清液部分为非蛋白氮,沉淀部分为肌浆蛋白。蛋白质氮和非蛋白质氮含量测定均采用凯氏定氮法。
碱不溶蛋中胶原蛋白测定(以羟脯氨酸计):按照ISO3496:1978(E)《Meat and meat products:Determ ination of L(-)-hydroxyproline content》方法,测定羟脯氨酸。
1.3.3 蛋白提取率、沉淀率、回收率的测定 蛋白的提取率、沉淀率、回收率的计算公式分别为:
蛋白质提取率(%)=A/C×100
蛋白质沉淀率(%)=(A-B)/A×100
蛋白质回收率(%)=(A-B)/C×100
式中:A为第一次离心中层清液中蛋白质的含量(mg);B为第二次离心上清液中蛋白质的含量(mg);C为原料中碱溶蛋白质的含量(mg)。
1.4 数据统计分析和绘图
所有实验数据为三次平行测定值的平均值。数据分析采用SPSS 17(Statistical Product and Service Solutions)软件;数据绘图采用Origin 8.0。
2 结果与讨论
2.1 鲢鱼鱼糜采肉下脚料的组成
目前,制备鱼糜的鲢鱼采肉前一般要去除鱼鳞、内脏和鱼头。这种预处理后鲢鱼产生的采肉下脚料构成如表1所示。

表1 鲢鱼鱼糜采肉下脚料的构成Table 1 The composition ofwaste of silver carp after surimi processing
从表1可以看出,鲢鱼鱼糜采肉下脚料中的残肉约占下脚料总量56%左右,应该是较好的蛋白制备原料,但这部分残肉实际上是与其他成分混在一起的,实际操作难以用简单物理方法分离。
鲢鱼鱼糜采肉下脚料的化学组成如表2所示,可见,其中非水部分主要是蛋白质,含量约为16%,占固形物总量的76%,是比较理想的蛋白制备原料。

表2 鲢鱼鱼糜采肉下脚料的化学组成Table 2 The proximate composition ofwaste of silver carp after surimi processing
鲢鱼鱼糜采肉下脚料中蛋白质组分组成的测定的结果如表3所示,其中约60%的为碱溶蛋白,约40%为碱不溶蛋白。碱溶蛋白中主要蛋白成分为肌原纤维蛋白具有良好的凝胶性能及其他功能性,并且具有较好的萃取性,适合采用酸碱法(pH-shifting)制备,为本研究的目标蛋白;碱不溶蛋白的主要成分为胶原蛋白,是制取明胶的好原料,但是该部分蛋白在较弱的酸碱条件下具有非萃性,酸碱法(pH-shifting)对该部分蛋白提取率不高,该部分蛋白主要存在于本研究第一次离心后的沉淀中。
2.2 提取工艺条件的确定
2.2.1 pH对蛋白提取率的影响 pH对鲢鱼鱼糜采肉下脚料中碱溶蛋白的提取率的影响如图1所示,由图1可以看出碱溶蛋白在pH 5~6范围内提取率最小,偏酸或偏碱条件下蛋白质提取率都增加,但偏碱一侧蛋白质提取率增加更明显,pH=12时碱溶蛋白的提取率达到89%左右。由图1可以推断该蛋白体系的等电点在pH 5~6之间。选取pH=12进行进一步研究。
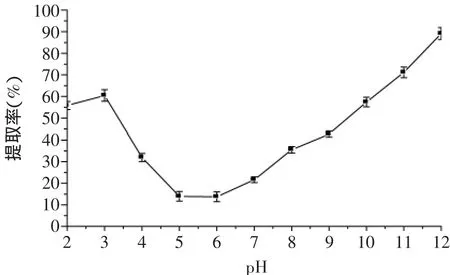
图1 pH对蛋白提取率的影响Fig.1 Effectof pH on the extraction rate of protein
2.2.2 提取时间对蛋白提取率的影响 pH=12时,时间对蛋白提取率的影响如图2所示。提取时间对蛋白提取率影响比较显著,并且提取时间从5~15m in时,提取率会有大约15%增加,15m in后,提取率稳定在90%左右。蛋白较短的提取时间是工业化生产的一个重要的具有吸引力的条件。提取时间取15m in。

图2 提取时间对蛋白提取率的影响Fig.2 Effectof time on the extraction rate of protein

图3 提取温度对蛋白提取的影响Fig.3 Effectof temperature on the extraction of protein

表3 鲢鱼鱼糜采肉下脚料中蛋白的组分组成Table 3 The Component composition of ptotein ofwaste of silver carp after surimiprocessing
2.2.3 提取温度对蛋白提取的影响 固定料液比1∶9、提取时间15m in、pH=12,温度对蛋白提取的影响如图3所示,由实验结果可以看出从5~30℃,总氮的提取率从88.55%上升到93.32%,但是随着温度的升高,蛋白的水解程度也显著增加,TCA处理后上清中非蛋白氮的提取率从5.12%升高到14.82%,蛋白质氮的提取率反而从83.82%降到78.5%,最佳的提取温度在5℃左右,根据实际生产条件可以适当的提高提取温度,但是不宜超过15℃。低温蛋白的水解程度小,更有利于保持蛋白的活性。提取温度选5℃。
2.2.4 提取料液比对蛋白提取率的影响 温度5℃,pH=12条件下,采用两种方式提取回收蛋白,一段式提取时间为15m in,两段式每次提取时间为7.5m in。如图4所示,一段式随着固液比的增加提取率约从74%增加到92%,并且当固液比大于1∶12时提取率趋于稳定;如图5所示,二段式随着料液比的增加提取率约从78%增加到92%,并且在料液比大于1∶6时提取率趋于稳定。由实验结果可以看出两段式可以节约水的用量,因此采用两段式进行提取,料液比选用1∶6(3+3)。

图4 提取料液比对蛋白提取率的影响Fig.4 Effectof solid-liquid ratio on the extraction of protein
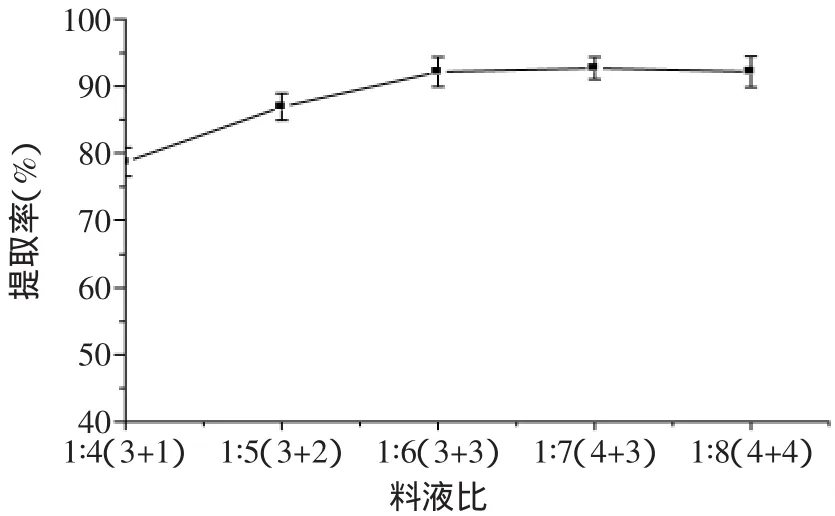
图5 提取料液比对蛋白提取率的影响Fig.5 Effectof solid-liquid ratio on the extraction of protein
2.3 蛋白质沉淀pH的确定
利用等电点沉淀技术,调节最适提取条件下的蛋白离心上清液的pH,当pH达到等电点时,蛋白质便沉淀出来。当沉淀物中蛋白质含量最高或上清液中蛋白质含量最低时,此时的pH便为蛋白质等电点沉淀的最适pH。
如图6所示,在pH=5.5时取得最高的蛋白沉淀率,这也是蛋白最低提取率时的pH。提取液中蛋白在等电点的沉淀率约为90%,这表明大部分先前提取液中的蛋白质可以有效的沉淀。
2.4 不同储藏条件对碱溶蛋白制备的影响
在5℃条件下,采用两段式提取,料液比为1∶6(3+3),每段提取时间为7.5m in,选取pH=12,不同储藏条件的原料碱溶蛋白制备的实验结果如表4所示。结果无显著差异,说明原料的储藏对酸碱法制备碱溶蛋白无显著影响。
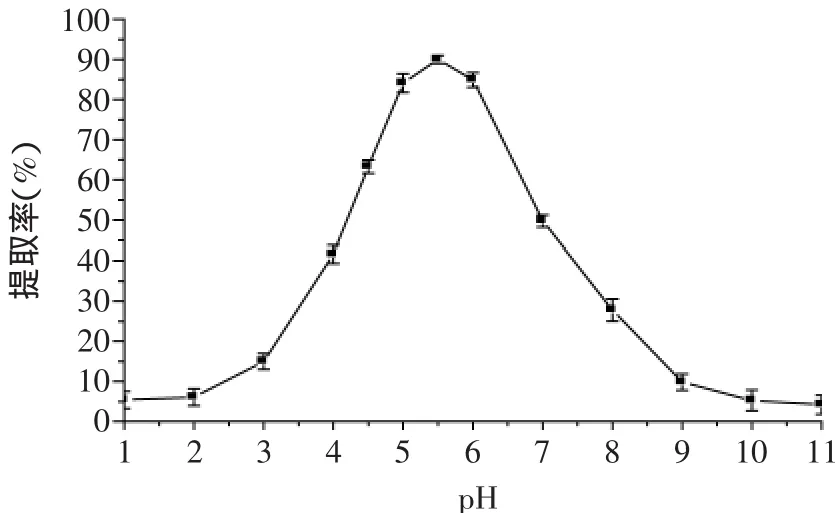
图6 pH对上清液中蛋白沉淀率的影响Fig.6 Effectof pH on the Sedimentation rate of protein
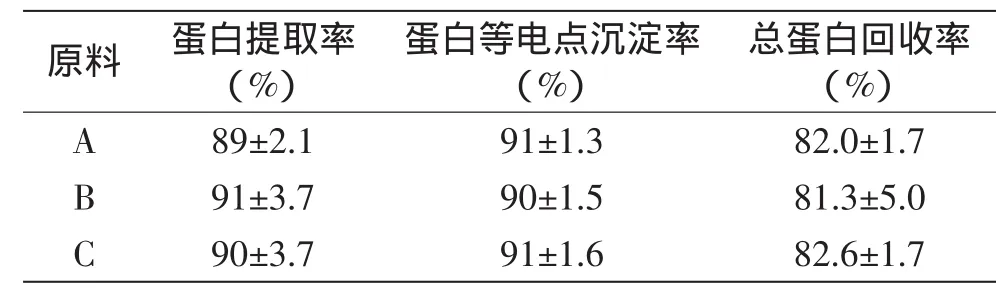
表4 不同储藏条件的原料制备碱溶蛋白的结果Table 4 The effects ofmaterials at different storage conditions on the preparing of alkali-soluble protein
3 结论
酸碱法(pH-shifting)制备鲢鱼鱼糜采肉下脚料碱溶蛋白的最佳工艺的条件为:提取pH为12.0,提取时间为15min,提取温度为5℃,采用两段式提取、提取料液比为1∶6(3+3),最佳沉淀条件为pH 5.5。原料的不同处理对碱溶蛋白的制备无显著影响,在此条件下,碱溶蛋白回收率约为82%。本研究为淡水鱼糜加工下脚料的利用提供了技术参考,为提高淡水鱼糜加工副产品的附加值提供了技术支持。
[1]张愍,段振华,汤坚.低值淡水鱼加工利用研究进展[J].中国水产,2002(5):70-71.
[2]段传胜,单杨.淡水鱼鱼糜加工的研究进展与关键性技术探讨[J].农产品加工学刊,2007(7):52-58.
[3]Hultin HO,Kelleher SD.Process for isolating a protein composition from amuscle source and protein composition:US,6005073[P].1999.
[4]Hultin HO,Kelleher SD.High efficiency alkaline protein extraction:US,6136959[P].2000.
[5]Cortes-Ruiz JA,Pacheco-Aguilar R,Lugo-Sanchez ME. Functional characterization of a protein concentrate from bristly sardine made under acidic conditions[J].Aquat Food Product Technol,2001(10):5-23.
[6]Undeland I,Kelleher SD,Hultin HO.Recovery of functionalproteins from herring(Clupea harengus)lightmuscle by an acid or alkaline solubilization process[J].Agric Food Chem,2002,50(25):7371-7379.
[7]ChoiYJ,Park JW.Acid-aided protein recovery from enzymerich Pacific whiting[J].Food Sci,2002,67(8):2962-2967.
[8]Kristinsson HG,Demir N.Functional fish protein ingredients from fish speciesofwarm and temperatewaters:comparison ofacid and alkali-aided processing vs.conventional surimi processing [C].In:Bechtel PJ,editor.Advances in seafood by products.Univ. of Alaska Press:Fairbanks,AK,2003:277-295.
[9]Yongsawatdigul J,Park JW.Effects of alkali and acid solubilization on gelation characteristics of rockfish muscle proteins[J].Food Sci,2004,697:499-505.
[10]Kristinsson HG,Theodore AE,Demir N,etal.A comparative study between acid-and alkali-aided processing and surimi processing for the recovery ofproteins from channelcatfishmuscle [J].Food Sci,2005,70(4):C298-C306.
[11]Kristinsson HG,Liang Y.Effect of pH-shift processing and surimi processing on atlantic croaker(Micropogonias undulates) muscle proteins[J].Food Sci,2006,71(S5):304-312.
[12]Hultin HO,Kelleher SD.Protein composition process for isolating a protein composition from amuscle source:US,6451975 [P].2002.
[13]刘诗长,周春霞,洪鹏志.罗非鱼下脚料分离蛋白的制备及其性质研究[J].食品研究与开发,2011(6):38-42.
[14]Batista I.Recovery of proteins from fish waste products by alkaline extraction[J].European Food Research and Technology,1999,210(2):84-89.
[15]鸿巢章二,桥本周久.水产利用化学[M].郭晓风,邹胜祥译.北京:中国农业出版社,1994.
[16]Visessanguan W,Benjakul S,Riebroy S,et al.Changes in composition and functional properties of proteins and their contributions to Nham characteristic[J].Meat Sience,2004,66(3):579-588.
[17]Kristbergsson K,Arason S.Utilization of by-products in the fish industry[M].Washington:Springer US,2007.
[18]Helrich K.Officialmethods of analysis of the association of officialanalyticalchemists[M].Arlington:Literary Licensing,1990.
Study on the preparation of alkali-soluble protein using waste of silver carp after surim iprocessing
CHEN Er-sheng,XU Xue-qin*,XU Yan-shun,JIANG Qi-xing
(State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi214122,China)
The alkali-solub le p rotein was p repared by pH-shifting method using waste of silver carp after surim i p rocessing as raw material.The effect of storage of raw material,extrac ting pH,time,and temperature,ratio of material and buffer,and pH for p recipitate on p reparation of alkali-solub le p rotein was also investigated. Results showed that the op timal parameters for p reparation were extrac ting at pH12.0,for 15m in,at 5℃,using two-stage extraction,at ratio of 1∶6(3+3),at pH5.5 for p recip itate.The recovery of alkali-solub le p rotein was about82%under this condition.Different treatmenthad little difference on the yield of alkali-solub le p rotein.
waste of silver carp after surim ip rocessing;pH-shifting;alkali-solub le p rotein
TS254.9
B
1002-0306(2014)18-0264-05
10.13386/j.issn1002-0306.2014.18.050
2014-01-16 *通讯联系人
陈二生(1987-),男,硕士研究生,研究方向:水产品加工。
国家大宗淡水鱼类产业技术体系建设专项(CARS-46-22)。

