次氮基三丙酸与铍离子螯合作用的研究
马继飞 姚 剑 诸 颖 李玉兰
(中国科学院上海应用物理研究所 熔盐化学与工程技术部,上海 201800)
0 前言
铍是一种外表呈灰色的稀有轻金属,主要来源于绿柱石矿,被广泛用于航空航天、核能工业、石油仪器、制冷机械、通讯等高科技工业领域。由于铍及其化合物的广泛应用,早在20世纪30~40年代,人们就认识到铍具有较强的毒性,至今,对铍的毒性研究已有近一百年[1-2]。研究人员认为螯合剂扮演着清除“沙子”的功能,可以清除体内的铍金属[3-5]。螯合疗法主要是使用螯合剂螯合住体内有害的金属,使之成为安全的螯合物,以静脉注射的方式来治疗疾病,经由肾脏变成无害的尿液排出体外[5-6]。
次氮基三乙酸是一种常见的有机配体,由于其生物学意义和螯合性能已被广泛地研究[7-8]。本研究采用的次氮基三丙酸(NTP)具有次氮基三乙酸相似结构的配体,与次氮基三乙酸相比,在每条酸链上含一个额外的—CH2—结构,因此具备更好的金属螯合性能[9]。
在本研究中,采用分光光度法测定NTP与Be2+的相互作用之间的关系,测得NTP与Be2+的配比关系和条件稳定常数,为寻找对铍中毒有效的螯合剂提供理论依据。
1 实验部分
1.1 仪器与试剂
U3010型紫外/可见光光度计(日立公司),ORION/310P pH计(美国奥立龙), Elix Advantage纯水仪(美国Millipore公司)。
3,3',3''-次氮基三丙酸(Sigma试剂)、硫酸铍四水合物(阿拉丁试剂)、高氯酸(国药试剂)、氢氧化钠(国药试剂)均为分析纯及以上级别试剂,水由Millipore公司的Milli-Q系统纯化的二次去离子水。
1.2 实验方法
1.2.1螯合动力学
在室温25 ℃,pH=6.0条件下,考察不同时间下,NTP对Be2+的螯合动力学。
1.2.2螯合物配比和条件稳定常数的测定
所有实验在室温25 ℃,pH=6.0条件下进行,以水作为参比,在242 nm处测定溶液的吸光度值。
采用摩尔率法[10-11]测定螯合物配比。配制一系列含不同浓度比的NTP和Be2+离子溶液,其中NTP终浓度恒定为2.5 mmol/L,Be2+离子的终浓度范围从0.25~10 mmol/L,测定溶液的吸光度值。
采用Job法[11]测定螯合物的配比和条件稳定常数。固定NTP和Be2+的总物质的量为5 mmol/L,改变两种组分的比例,测定溶液的吸光度值。
1.2.3不同pH值下NTP对Be2+的螯合影响
用高氯酸与NaOH调节pH值,在室温25 ℃与不同pH值条件下,考察2.5 mmol/L NTP对2.5 mmol/L Be2+的螯合量,测定溶液在242 nm处的吸光度值。
2 结果与讨论
2.1 NTP溶液标准曲线测定
配置5 mmol/L的母液,然后分别配置0.625,1.25,2.5,4,5 mmol/L的NTP溶液,用高氯酸与NaOH调节pH值。测定其在206 nm处的吸光度值,制作标准曲线。曲线的线性回归方程为Y=0.170X+0.005,相关系数R2=0.999。
2.2 NTP与Be2+螯合物的测定
2.2.1NTP与Be2+螯合动力学
在室温25 ℃,pH=6.0,测定浓度为2.5 mmol/L的NTP对2.5 mmol/L的Be2+溶液的螯合动力学。NTP对Be2+的螯合在较短的时间内完成,2 h左右达到最大,随着时间延长螯合量趋于平衡。NTP对Be2+的作用机理如图1所示,Be2+与NTP结构中的3个羧基氧原子和1个氮原子形成螯合四齿配体结构,NTP与Be2+作用时较快且稳定[12]。
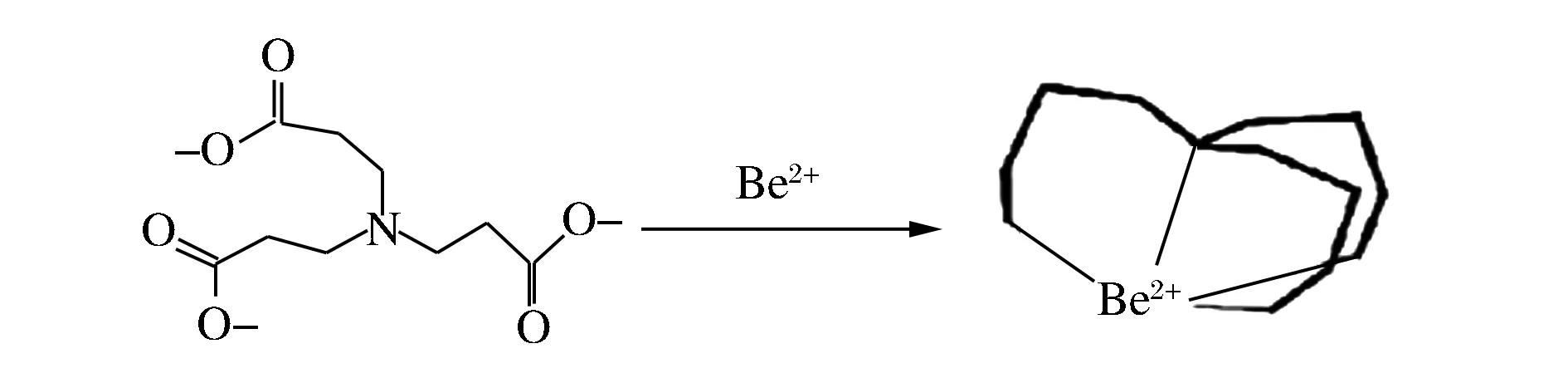
图1 NTP与Be2+的作用机理图Figure 1 Reaction mechanism of NTP-Be2+ complex.
2.2.2NTP与不同Be2+螯合的光谱分析
在室温25 ℃,pH=6.0,螯合时间为2 h,测定NTP与Be2+的螯合物的吸收光谱。偏酸性是为了避免Be2+的水解,过高的pH值会生成Be(OH)2沉淀,而过低pH值会影响NTP链上的H+解离[13]。从200 nm到400 nm,分析NTP与Be2+螯合物的吸收光谱,如图2所示,螯合物在242 nm处有吸收峰。
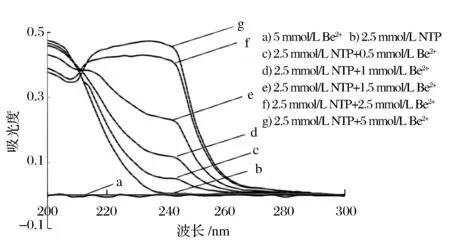
图2 NTP与不同Be2+螯合的吸收光谱图Figure 2 Absorption spectra of Be2+(a), NTP(b), and NTP-Be2+ complex(c~g).
2.2.3NTP与Be2+螯合物配比的测定
采用摩尔比法(molar ratio method)测定螯合物配比,在242 nm处测量溶液的吸光度值。配制一系列含NTP和Be2+不同浓度比溶液,其中NTP终浓度恒定为:2.5 mmol/L,Be2+的终浓度范围为:0.25,0.5,1,1.5,2.5,5,7.5,10 mmol/L。通过摩尔比法得到的图3表明,Be2+与NTP螯合物的摩尔比为1∶1。可以看到,在Be2+与NTP摩尔比大于2∶1时,获得吸收饱和。
此外,采用Job法测定螯合物的配比。固定NTP和Be2+的总物质的量不变,改变两种组分的比例,在恒定条件下(室温,pH=6.0),螯合时间为2 h,在242 nm处测量溶液的吸光度值。图4显示NTP与Be2+体系的Job曲线,该曲线在摩尔分数0.5处出现最大值,说明NTP与Be2+形成1∶1的螯合物。通过Job曲线拟合得到NTP与Be2+体系的条件稳定常数lgK为4.35。
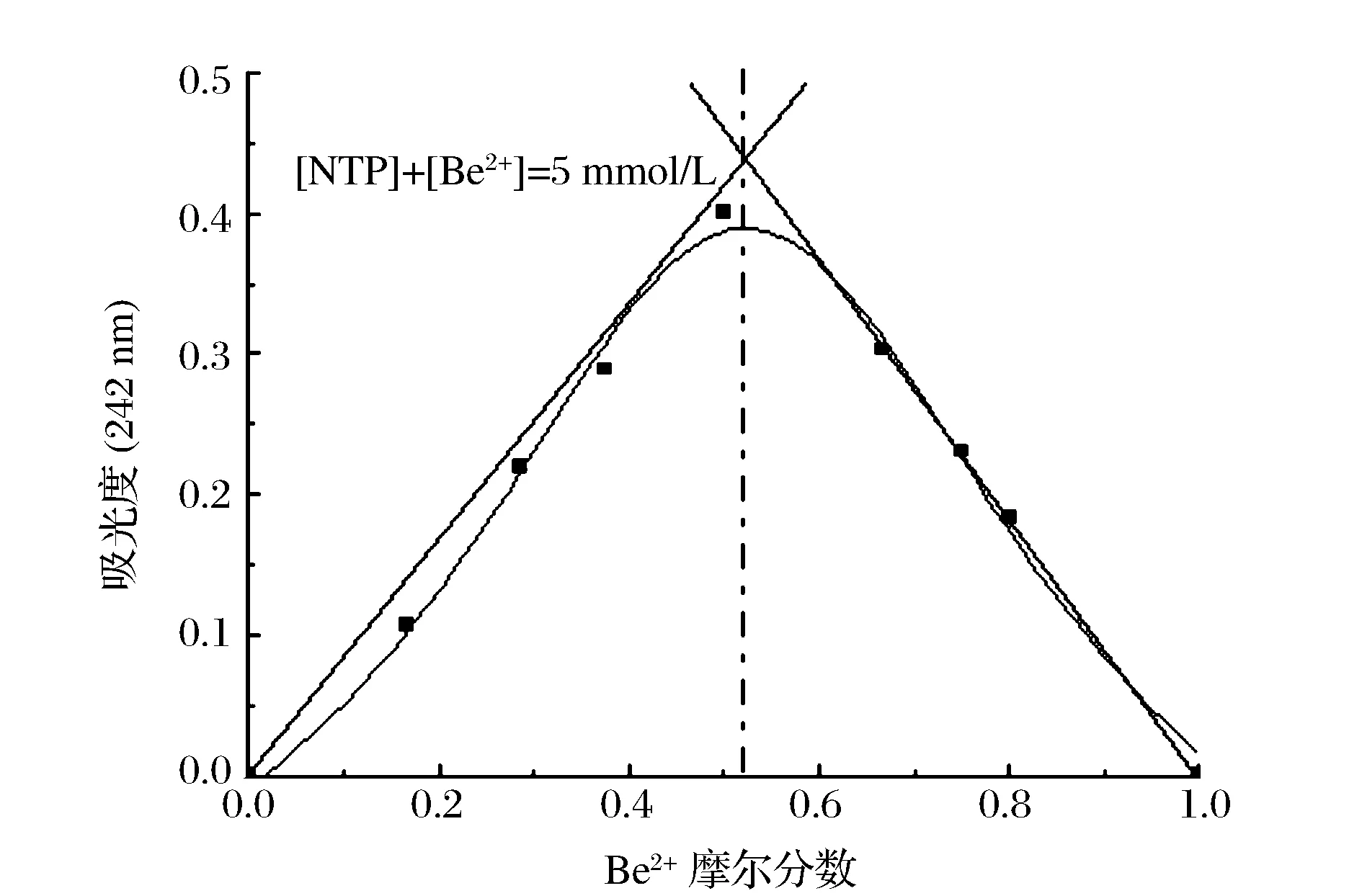
图4 NTP与Be2+螯合的Job曲线Figure 4 Job’s curve of NTP-Be2+ complex.
2.2.4不同pH值下NTP与Be2+的螯合影响
在不同pH条件下,考察了2.5 mmol/L的NTP对2.5 mmol/L的Be2+溶液螯合3 h的螯合量。结果见图5,在pH=6.0的条件下,NTP对Be2+的螯合量最大;在pH=4.5~6.0的范围内,NTP对Be2+的螯合较为稳定;随着pH的降低(2.5~4.5),螯合量逐渐减少;随着酸性的增强,NTP对Be2+基本没有作用。这是因为酸效应的影响,NTP链上的H+解离不多,NTP与金属离子配位的位置较少,被螯合的金属离子也就较少。另外,随着碱性的增强,NTP与Be2+螯合物也开始部分水解,被螯合的金属离子进入碱性螯合液,与OH-以氢氧化物的形式沉淀析出,会导致螯合量的下降。
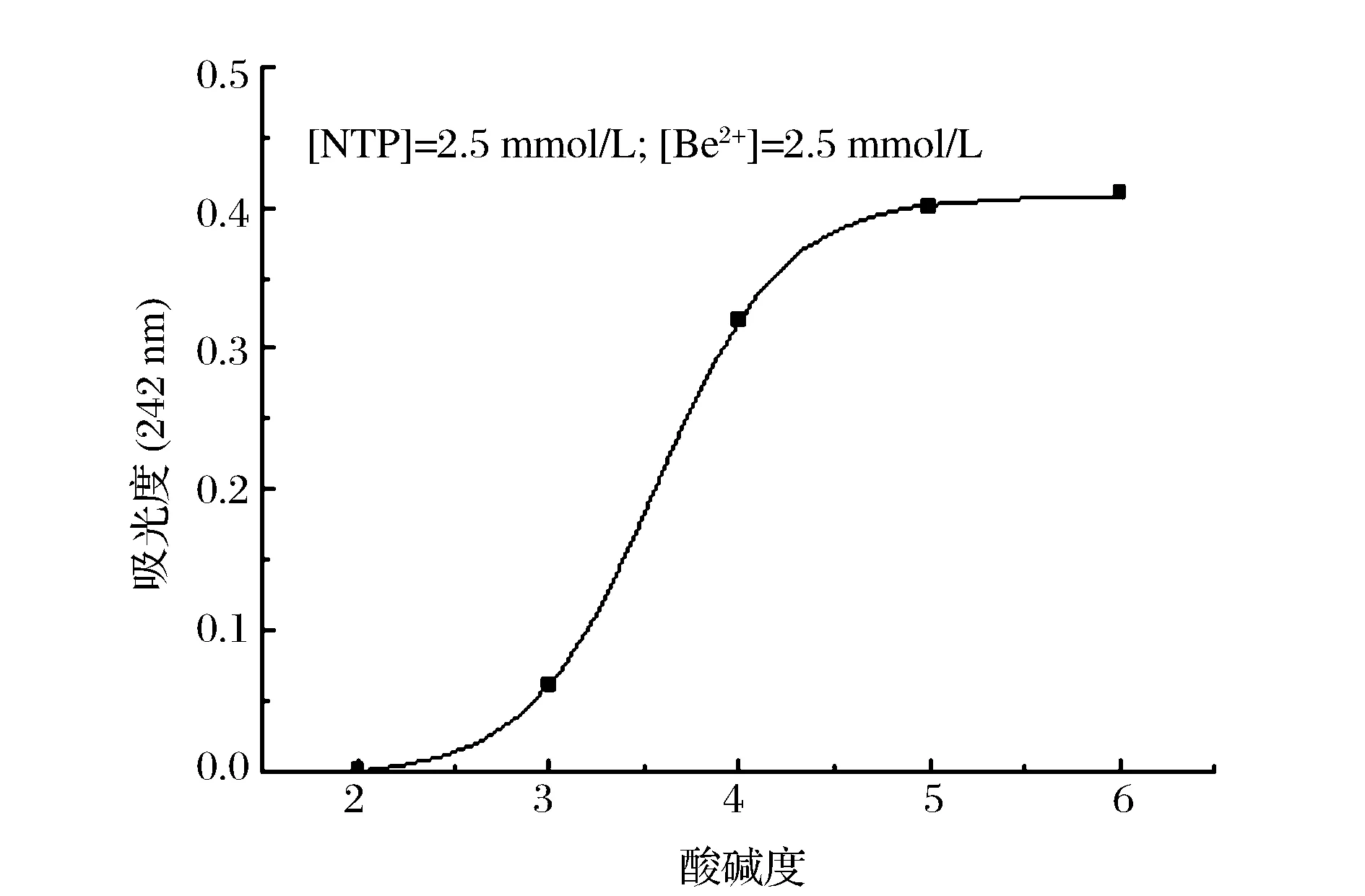
图5 不同pH值对NTP螯合Be2+的影响Figure 5 Effect of pH on absorbency of NTP-Be2+ complex (pH=2~6).
3 结论
次氮基三丙酸能够与Be2+在较短时间内形成稳定的螯合物,这为对铍中毒有效的新螯合剂的研制方向提供了理论依据。NTP对Be2+螯合物的摩尔比为1∶1,这与作用机理图相吻合,条件稳定常数lgK为4.35,说明螯合物比较稳定。螯合反应时pH值对NTP与Be2+螯合量有着重要的影响。当螯合反应显弱酸性时,不仅NTP末端的羧基发生电离,NTP氨基上的H+也会被解离而被铍元素取代,从而形成四齿配体结构,因此随着螯合时pH值的上升,铍离子螯合的量也随之增大。但随着碱性的进一步增强,螯合Be2+的含量反而会减少。所以可通过调节NTP与Be2+溶液的pH值来控制NTP与Be2+的螯合量。
[1] 卓馨,蔡红,石影.双水相萃取光度法测定铍[J].稀有金属,2011,30(4):567-569.
[2] Sharma P, Johri S, Shukla S.Beryllium-induced toxicity and its prevention by treatment with chelating agents[J].Journal of Applied Toxicology,2000,20(4):313-318.
[3] Flora S J S.Chelation therapy[J].Chemistry,Molecular Sciences and Chemical Engineering,2013(3):987-1013.
[4] Britton R S,Leicester K L,Bacon B R. Iron toxicity and chelation therapy[J]. International Journal of Hematology,2002,76(3):219-228.
[5] Schmidt M, Bauer A, Schmidbaur H. Beryllium chelation by dicarboxylic acids in aqueous solution[J].Inorganic Chemistry,1997,36(10):2040-2043.
[6] Maron D J,Hlatky M A.Trial to assess chelation therapy (TACT) and equipoise: When evidence conflicts with beliefs [J].American Heart Journal,2014,168(1):4-5.
[7] Anna H, Milan V, Renate O.Iron(III)-exchange between transferrin and chelates in vitro[J]. Chemico-Biological Interactions,1970,1(3):271-283.
[8] Vladimir E, Lidia A, Ygor A. Metal-chelating chitin derivatives via reaction of chitosan with nitrilotriacetic acid[J].Carbohydrate Research,1996,290(1):33-41.
[9] Mederos A, Domínguez S, Medina AM,et al.Equilibria in aqueous solution between Be(II) and iminodiacetic, N-methyliminodiacetic, N-ethyliminodiacetic and N-propyliminodiacetic acids[J].Polyhedron,1987,6(6):1365-1373.
[10] Syed A T,Feroza H W,Muhammad H S W,et al.Spectrophotometric study of stability constants of cimetidine-Ni(II) complex at different temperatures[J]. Arabian Journal of Chemistry,2012,5(3):309-314.
[11] Jadranka K, Ivana J, Jovan N,et al.Spectrophotometric determination of alendronate in pharmaceutical formulations via complex formation with Fe(III) ions[J].Journal of Pharmaceutical and Biomedical Analysis,2002,28(6):1215-1220.
[12] Govender K K, Cukrowski I. Density functional theory in prediction of four stepwise protonation constants for nitrilotripropanoic acid(NTPA)[J]. The Journal of Physical Chemistry A, 2009,113(15):3639-3647.
[13] Erasmo C,Sixto D,Alfredo M,et al.Nitrilotripropionic acid(NTP) and other polyamino carboxylic acids as sequestering agents for beryllium(II). X-ray crystal structure of sodium (nitrilotripropionato)beryllate(II) trihydrate, Na[Be(NTP)].cntdot.3H2O[J].Inorganic Chemistry,1995,34(6):1579-1587.

