KOH/DMSO促进的Sonogashira偶联反应
尤惠卿,史少辉,曾庆乐
(1泉州幼儿师范高等专科学校,福建 泉州 362000;2成都理工大学 材料与化学化工学院 绿色催化合成研究所,四川 成都 610059)
KOH/DMSO促进的Sonogashira偶联反应
尤惠卿1,史少辉2,曾庆乐2
(1泉州幼儿师范高等专科学校,福建 泉州 362000;2成都理工大学 材料与化学化工学院 绿色催化合成研究所,四川 成都 610059)
在无过渡金属催化剂和无配体存在下,KOH/DMSO超强碱能够促进Sonogashira偶联反应。碱的类型、溶剂对Sonogashira反应的影响,以及底物的范围做了考察。研究结果表明:在没有钯或铜和配体形成的催化剂、也没有相转移试剂存在下,在比较温和的反应条件下,强碱就可以促进Sonogashira反应。
Sonogashira偶联反应;碱促进;超强碱(KOH/DMSO);无过渡金属;无配体
卤代芳烃或卤代烯烃与末端炔烃之间偶联形成新的Csp2-Csp键的反应,即Sonogashira偶联反应,是构建C-C键的重要合成工具,该类反应广泛用于共轭烯炔[1]、天然产物的合成[2-4],在光电子技术方面也有很好的应用前景[5]。
Pd、Cu和Ni等催化剂是Sonogashira反应被普遍使用的催化剂。迄今为止,绝大多数的碳-碳和碳-杂偶联反应使用了含Pd和Ni的催化剂。尽管这样的偶联反应有较佳的催化性能,然而,Pd高昂的价格以及Pd和Ni较强的毒性阻碍了这类偶联反应在很多场合中的应用[6]。
鉴于以上的种种问题,最近几年来人们对Sonogashira反应做了多方面的探索与研究,以寻求更为廉价、安全、高效的催化剂体系为主要趋势,并取得了一些重要进展[7]。但是,这些研究绝大多数还是停留在金属催化方面,重点在寻找新配体、合成新催化剂。
近年来研究人员开始把注意力转向强碱存在下的有机催化C-C偶联[8-9]、C-S偶联[10-11]、C-O偶联[12]和C-N偶联[13-15]等偶联领域,这类有机催化剂主要是邻位二胺,一般要配合KOtBu和KOH等强碱一起使用才能起到催化效果。
另外KOH与DMSO混合使用成为一种超强碱[16],最近,Bolm报道了这类超强碱促进C-N、C-O、C-S偶联反应[17]。
受到Bolm对超强碱促进碳-杂原子偶联的启发,在我们长期做包含C-N偶联在内的有机合成研究基础上[18-22],我们把以前只应用在构建C-X(O、S、N)键的方法延伸到构建Csp2-Csp键的Sonogashira反应上,如图 1所示。采用KOH-DMSO体系促进卤代芳烃与端炔的偶联反应,取得较好的结果。该方法不仅可以使反应在相对温和的条件下进行,由于避免了钯、铜等金属的使用,会大大提高反应的原子经济性,降低污染。

图1 Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker Advance II 300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker TENSOR-27型红外光谱仪;85-2型加热磁力搅拌器(上海司乐仪器有限公司);RE3000 A型旋转蒸发仪(上海亚荣生化仪厂);2XZ型旋片式真空泵(上海君泽泵业);AL104电子天平(梅特勒-托利多仪器(上海)有限公司)。
实验中所用试剂均为进口试剂或者分析纯试剂,使用前未做纯化处理。
1.2 实验方法
实验操作方法:在烘干过的20 mL的试管中,放入磁力搅拌子一枚,加入2.5 mmol氢氧化钾,然后迅速用翻口塞盖紧,该试管抽真空,充氩气,反复操作3次,然后用250 μL的微量进样器注入卤代芳烃0.1 mmol,5 mL的针筒注入DMSO 3.0 mL,将该试管放入120℃的油浴中片刻,用微量进样器分两次向试管中加入端炔1.2 mmol,每次0.6 mmol,间隔为10 min。在该温度的油浴中搅拌反应,24小时停止加热搅拌,冷却至室温,然后用5 mL的饱和氯化铵溶液淬灭反应,并加入乙酸乙酯10 mL,用分液漏斗萃取,乙酸乙酯萃取3次,合并有机相,15 mL饱和氯化钠洗涤有机相,然后有机相用无水硫酸镁干燥、过滤,减压浓缩滤液,得到的粗产物用石油醚为洗脱剂进行快速硅胶柱层析,收集产物的洗脱液,经过浓缩得到偶联反应的目标产物。
部分代表化合物图谱表征数据如下:
芳基端炔与卤代芳烃的偶联产物,二苯基乙炔:白色晶体,m.p.58~60℃;
1H NMR(300 Hz,CDCl3),δ=7.55~7.52(m,4H),7.38~7.30(m,6H);
13C NMR(300Hz,CDCl3),δ=131.0,128.2,128.0,123.1,89.1;
IR(neat):ν=3027,1598,1491,1443,1238,1074,1029,785,760,698 cm-1。
脂肪端炔与卤代芳烃的偶联产物,1-正丁基-2-苯基乙炔:无色液体;
1H NMR(300 Hz,CDCl3),δ=7.45~7.36(m,2H),7.24~7.13(m,3H),2.43(t,J=7.1Hz,2H),1.44(m,2H), 1.30(m,2H),0.89(t,J=7.9 Hz,3H);
13C NMR(300 Hz,CDCl3),δ=129.2,122.0,102.4,81.2,30.8,22.2,21.3,13.6;
IR(neat):ν=3056,2970,2870,2242,1598,1499,755,692 cm-1。
卤代杂化芳烃与苯乙炔的偶联产物,2-苯乙炔基吡啶:白色固体,m.p.78~80℃;
1H NMR(300Hz,CDCl3),δ=7.96(d,J=7.2,1H),7.62(t,J=7.8,1H),7.56~7.52(m,2H),7.36~7.30(m, 3H),7.26(t,J=3.6,1H),6.96(d,J=7.2,1H);
13C NMR(300 Hz,CDCl3),δ=149.6,142.0,135.8,132.2,128.0,124.1,123.2,90.4,87.2;
IR(KBr):ν=3049,2922,2852,2149,1668,1591,1569,1483,1439,1176,1156,1067,915,848,751,682 cm-1.
2 结果与讨论
先选择碘苯和苯乙炔作为Sonogashira偶联反应的底物,如图2反应方程式所示,分别考察了碱的类型、活化剂、溶剂、对反应的影响,寻找Sonogashira偶联反应的最佳反应条件。

图2 Scheme 2
2.1 碱的种类及活化剂的影响
在碘苯1 mmol苯乙炔1.2 mmol、碱2.5 mmol,溶剂为DMSO,反应24 h的条件下碱的种类以及活化剂的类型对反应收率的影响见表1。
由表1可见,各种强碱中氢氧化钾和叔丁醇钾的活性是最高的(Table 1,entries 1~4),弱碱条件下不会发生Sonogashira反应(Entries 5~6),加入偶联反应活化剂(Entries 7~10)邻位二胺对本反应的影响不大,不能有效提高反应的收率,这就说明对芳基卤化物与苯偶联反应有活化作用的邻位二胺对Sonogashira偶联没有活化作用。由于叔丁醇钾相对于氢氧化钾的价格较贵,而且反应收率相当,故本次研究不采用活化剂、只采用氢氧化钾为本反应的促进剂。
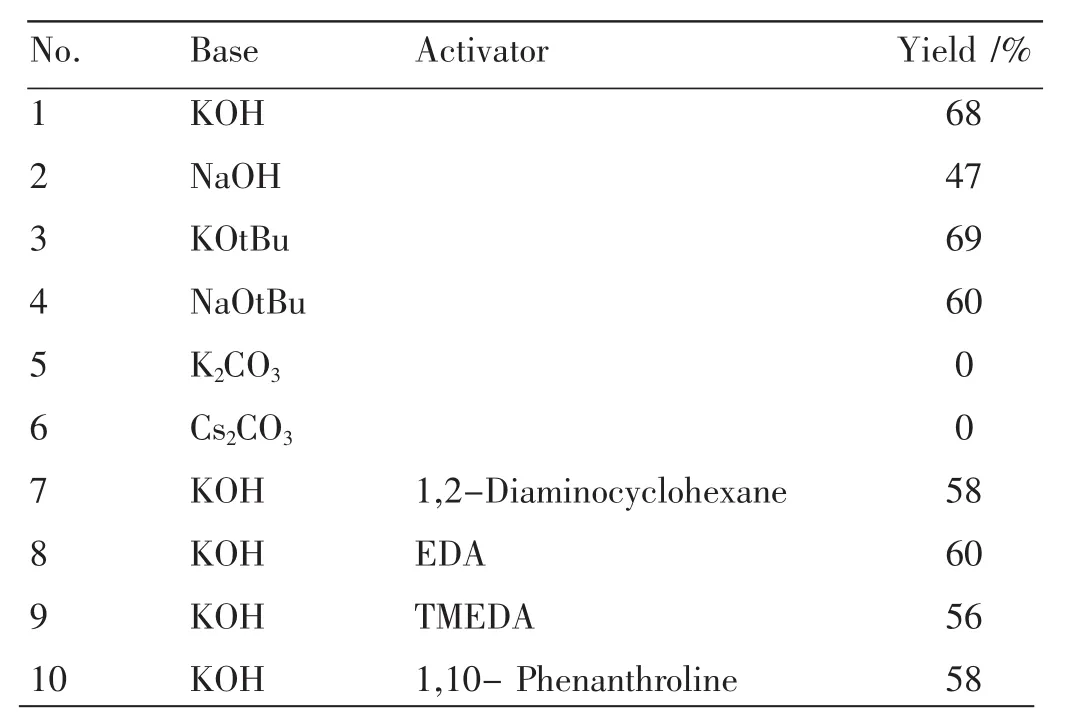
表1 碱和活化剂对Sonogashira偶联的影响
2.2 温度及溶剂的影响
在选用氢氧化钾为反应的催化剂的条件下,研究考察了反应温度以及溶剂对反应产率的影响,为了确定KOH只有在DMSO中才能发挥更好的促进反应的效果,试验选用了表2中4种不同的溶剂考察了在不同的温度下对反应产率的影响,由表2可以看出DMSO明显优于其它3种溶剂,并且在120℃得到最高的反应产率。这可能是由于氢氧化钾在二甲亚砜中有非常高的的碱性 (pKa 30~32),而在其它溶剂中相对碱性较低的原因造成的。因此KOH和DMSO为最佳的组合。
综上所述,碘苯与苯乙炔合成二苯乙炔的最佳Sonogashira偶联反应的条件为:碘苯1 mmol,苯乙炔1.2 mmol,KOH 2.5 mmol,DMSO 3 mL,氮气气氛中于120℃反应24 h。
2.3 优化条件下底物的考察
根据碘苯与苯乙炔反应合成二苯乙炔的反应结果,在最优化的条件下对其它卤代芳烃与末端炔烃进行反应,如Scheme 1反应方程式所示,实验结果见表3。
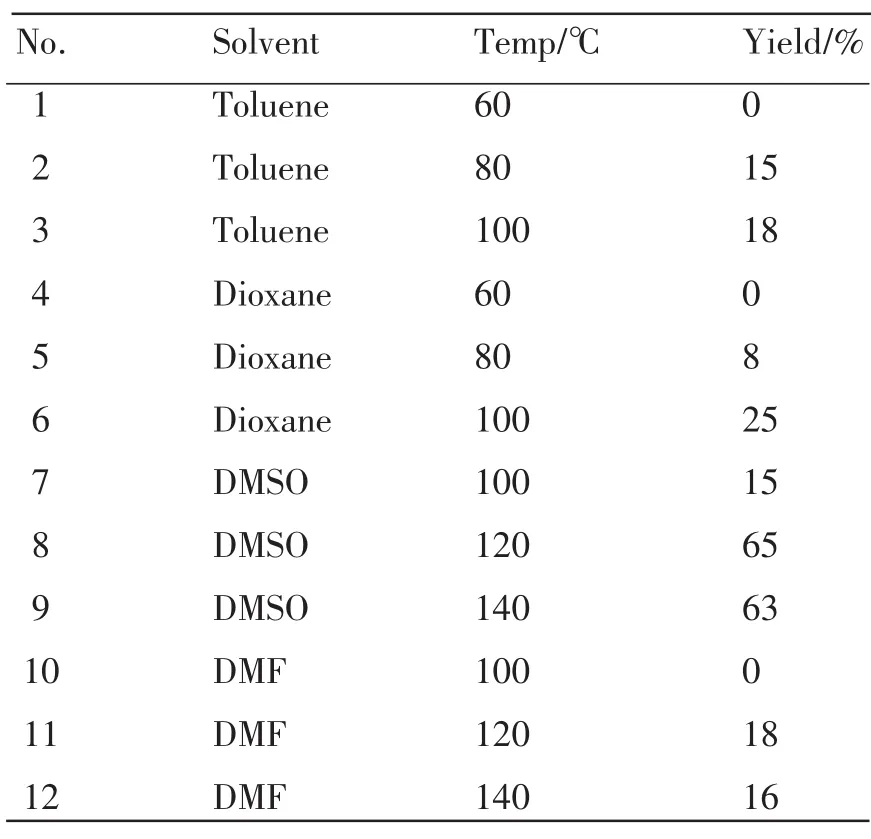
表2 反应温度及溶剂对Sonogashira偶联反应的影响

表3 在最优反应条件下底物的考察
由表3可见,在KOH/DMSO体系的促进作用下,许多卤代芳烃与末端炔烃都能顺利偶联产物,有些还得到比较理想的产率。碘代芳烃的反应活性高于溴代芳烃,氯代芳烃在这种反应条件下不反应。这主要是由于各种卤代芳烃的卤原子的离去能力不同造成的。从表3中还可以看出,苯环上连有给电子基团的溴代芳烃反应活性优于连有吸电子基团的。这可能是由于吸电子基团的存在使得离去基团卤素负离子更加难于离去,进而芳基阳离子中间体不容易形成的结果。
从表3中我们还可以看出,空间效应对本反应的影响不大,甚至邻位取代基团溴代芳烃的反应活性优于对位取代的溴代芳烃(表3,Entries 3~4,Entries 8~9,Entries 13~14)。本反应条件对脂肪端炔也有较好的适用性,但反应产率低于芳香端炔。2-溴吡啶和2-溴喹啉也得到了相对较好的结果(Entries 16~17)。可见本反应条件有较好的底物普适性。
3 结论
本研究报道了一种新的Sonogashira偶联反应促进体系,该Sonogashira反应无需膦配体、无需钯、铜等金属催化剂就可以成功实现卤代芳烃与端炔的偶联反应,反应条件温和、成本低廉。
该催化体系具有广泛的底物适用性,不但适用于各种电子效应的芳基碘和末端炔烃,而且对杂环卤代烃和直连端炔等底物取得了良好的催化效果,而且,对多种官能团有广泛的适用性,例如,羟基、甲基、醛基、硝基等。因此有可能在复杂的天然产物合成中得到应用。
[1] HENRI DOUCET,JEAN CYRILLE HIERSO.Palladium-based catalytic systems for the synthesis of conjugated enynes by sonogashira reactions and related alkynylations[J].Angew Chem Int Ed,2007(46):834.
[2]PATERSON I M,DAVIES R D,MARQUEZ R.Total synthesis of the callipeltoside aglycon[J].Angew Chem int ed,2001,40(3):603-607.
[3]LOPEZ DEBER M P,CASTEDO L,GRANJA J R.Synthesis of N-(3-Arylpropyl)amino acid derivatives by sonogashira types of reaction in aqueous media[J].Org Lett,2001,3(18):2823.
[4]DAKIN LA,LANGILLE N F,PANEK J S.Synthesis of the C1'-C11'oxazole-containing side chain of leucascandrolide A.Application of a Sonogashira cross-coupling[J].Org Chem,2002,67:6812-6815.
[5] 张炜,黄鹏程.系列苯炔化合物和苯炔树枝大分子的合成及其光学性质的研究[J].化学学报,2005,63:1433-1438.
[6] 王晔峰,邓维,刘磊,等.Sonogashira反应研究的最新进展[J].有机化学,2005(25):8.
[7]LIANG B,DAI M J,CHEN J H.Copper-free sonogashira coupling reaction with pdcl2 in–water under aerobic conditions[J].Org Chem,2005(70):391-393.
[8]YANAGISAWA S,UEDA K,TANIGUCHI T,et al.Potassium t-butoxide alonecan promote the biaryl coupling of electron-deficient nitrogen heterocycles and haloarenes[J].Org Lett,2008(10):4673.
[9]LIU W,CAO H,ZHANG H,et al.Organocatalysis in cross-coupling:DMEDA-catalyzed direct C-H arylation of unactivated benzene[J].Am Chem Soc,2010,132:16737-16740.
[10]BRADSHAW J S,CHEN E Y,HALES R H,et al.Convenient method for the preparation of naphthyl ethers and sulfides[J].Org Chem,1972,37:2051-20152.
[11]VARALA R,RAMU E,ALAM M M,et al.CsOH·H2O-promoted synthesis of aryl sulfides via direct coupling of aryl halides and thiols[J].Chem Lett,2004,33:1614-1615.
[12]BATES R B,JANDA K D.High-yield benzyne synthesis of diaryl ethers[J].Org Chem,1982,47:4374-4376.
[13]SHI L,WANG M,FAN C A,et al.Rapid and efficient microwave-assisted amination of electron-rich aryl halides without a transition-metal catalyst[J].Org Lett,2003(5):3515.
[14]BOLLIGER J L,FRECH C M.Transition metal-free amination of aryl halides—a simple and reliable method for the efficient and high-yielding synthesis of N-arylated amines[J].Tetrahedron,2009,65:1180.
[15]POIRIER M,GOUDREAU S,POULIN J,et al.Metal-free coupling of azoles with 2-and 3-haloindoles providing access to novel 2-or 3-(azol-1-yl)indole derivatives[J].Org Lett,2010,12:2334.
[16]CAUBERE P.Unimetal super bases[J].Chem Rev,1993,93:2317.
[17]YUAN Y,THOM I,KIM S H,et al.Dimethyl sulfoxide/potassium hydroxide:a superbase for the transition metalfree preparation of cross-coupling products[J].Adv Synth Catal,2010,352:2892-2898.
[18]FORS B P,DOOLEWEERDT K,ZENG Q,et al.An efficient system for the Pd-catalyzed cross-coupling of amides and aryl chlorides[J].Tetrahedron,2009,65:6576.
[19]ZENG Q L,TANG H Y,ZHANG S,et al.Enantioselective sulfide oxidation catalyzed by 2,10-camphanediol derived titanium complex and its mechanism[J].Chinese J Chem,2008,26:1435.
[20]ZENG Q,WANG H,WANG T,et al.Vanadium-catalyzed enantioselective sulfoxidation and concomitant,highly efficient kinetic resolution provide high enantioselectivity and acceptable yields of sulfoxides[J].Adv Synth Catal,2005,347:1933.
[21]ZENG Q,LIU H,CUI X,et al.Highly enantioselective hydrogenation of α-dehydroamino acids by rhodium complex with H8-MonoPhos[J].Tetrahedron Asymmetry,2002,13:115.
[22]刘洋,曾庆乐,唐红艳,等.绿色化学试剂过氧化氢在有机合成中的应用研究进展[J].有机化学,2011,31:986.
(责任编辑:朱联九)
KOH/DMSO Promoted Sonogashira Coupling
YOU Hui-qing1,SHI Shao-hui2,ZENG Qingle2
(1.Quanzhou Preschool Education College,Quanzhou 362000,China 2.Institute of Green Catalysis and Synthesis,College of Materials and Chemistry&Chemical Engineering, Chengdu University of Technology,Chengdu 610059,China)
Without transition metal catalysts and ligands,KOH/DMSO super base can promote Sonogashira cross coupling reaction.The effect of bases,solvents on Sonogashira reaction,and the scope of substrates are examined in this paper.The resultsdemonstrated thattransition metal-free,ligand-free Sonogashira reaction undermild conditionscan give good results.
Sonogashira cross coupling;base promotion;superbase(KOH/DMSO);transition metal free;ligand free
O643.32
A
1673-4343(2014)04-0012-05
10.14098/j.cn35-1288/z.2014.04.003
2014-03-16
国家自然科学基金(21372034);成都理工大学优秀创新团队培育计划项目(HY0084)
尤惠卿,男,福建泉州人,副教授。研究方向:化学教育理论与实践。

