高效液相色谱法测定笃斯越桔制品中7种有机酸的含量
魏铭,顾盼,李程洁,杨航宇,刘树勋,张嘉月,颜志秀,张柏林,朱保庆
(北京林业大学生物科学与技术学院食品科学系,林业食品加工与安全北京市重点实验室,北京100083)
高效液相色谱法测定笃斯越桔制品中7种有机酸的含量
魏铭,顾盼,李程洁,杨航宇,刘树勋,张嘉月,颜志秀,张柏林,朱保庆*
(北京林业大学生物科学与技术学院食品科学系,林业食品加工与安全北京市重点实验室,北京100083)
采用高效液相色谱方法测定6种笃斯越桔制品中的有机酸含量,色谱条件为色谱柱:Venusil ASB C18(4.6 mm×250 mm,5 μm);流动相:96.9%超纯水-3%甲醇-0.1%甲酸;流速:0.5 mL/min;柱温:室温;检测波长:210 nm;进样量:20 μm。该方法能够快速、准确地分离笃斯越桔相关制品中所含的7种有机酸,包括草酸、奎宁酸、苹果酸、莽草酸、乳酸、乙酸、柠檬酸。检测结果表明,笃斯越桔中的有机酸主要为奎宁酸,其次是柠檬酸和苹果酸,乳酸和乙酸的含量较少。
笃斯越桔制品;有机酸;高效液相色谱法
蓝莓属于杜鹃花科(Ericaceae)越橘属(Vaccinium)植物,其果实不仅营养丰富,而且含有有机酸、氨基酸、花色苷等独特的功能性成分[1-4],具有防治心血管疾病、抗癌、抗衰老等多种功效[5-8]。有机酸是蓝莓果实中重要的营养和风味成分,它的种类和含量是衡量果实及相关产品品质的重要指标[9]。因此,准确测定蓝莓及其相关制品中有机酸的组成对研究蓝莓果实的风味特征及加工特性具有重要意义。
笃斯越桔(Vaccinium uliginosumL.)是大小兴安岭地区特有的一种野生蓝莓,有着很高的营养和保健价值[10]。目前,蓝莓及其制品中有机酸含量的相关报道多数集中在栽培种高丛蓝莓和矮丛蓝莓[11-14],有关笃斯越桔中有机酸的含量检测尚无研究报道。本研究采用高效液相色谱方法系统分析了以笃斯越桔为原料制备的汁、果酱及发酵果酒中有机酸的组成和含量,该研究为进一步深入认识笃斯越桔产品酸感形成的机制奠定了基础,也对笃斯越桔加工产品的开发有较强的指导意义。
1 材料与方法
1.1 材料与试剂
蓝莓果汁(鲜榨汁)、大兴安岭蓝莓果酱:内蒙古呼伦贝市鄂伦春自治旗原生态公司;大兴安岭2013年发酵酒的桶储和瓶储样品、大兴安岭2014年发酵酒样、小兴安岭2013发酵瓶储酒样:北京林业大学食品科学系中试产品。
L-苹果酸、草酸、乳酸、乙酸、柠檬酸:美国Sigma-Aldrich公司;奎宁酸、莽草酸:成都曼思特生物科技有限公司。以上试剂均为色谱纯。
1.2 仪器与设备
LC-20 AT型高效液相色谱仪(配SPD-M20A二极管阵列检测器):日本岛津公司;Venusil ASB C18色谱柱:天津博纳艾杰尔科技有限公司;Milli-Q Academic超纯水器:百壹星辰(北京)生物科技有限公司;FA(N)/JA(N)系列电子分析天平:上海舜宇恒平科学仪器有限公司;TGL-16G台式高速离心机:上海菲恰尔分析仪器有限公司;KQ3200DE型数控超声波清洗器:昆山市超声仪器有限公司。
1.3 方法
1.3.1 标准溶液的配制
用超纯水将各有机酸标准品配成单标,分别进样,确定各自的出峰时间和先后顺序,然后配制9种物质的混合标准储备溶液,各组分的质量浓度见表1。使用时将混合溶液用超纯水依次稀释2.0倍、2.5倍、3.3倍、5.0倍、10.0倍,得到不同质量浓度梯度的标准溶液,经0.45 μm滤膜过滤后,进样20 μL,以峰面积为纵坐标,各组分质量浓度为横坐标,绘制标准曲线。
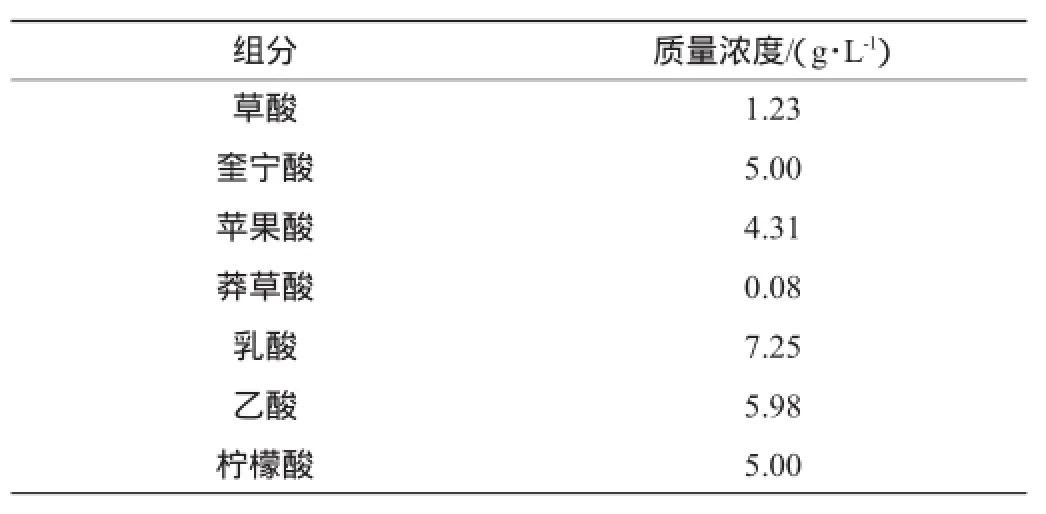
表17 种有机酸混合标准溶液的组成Table 1 Mixed standard solution of seven compounds
1.3.2 样品前处理方法
进样前取1mL样品,10000r/min离心10min,经0.45μm滤膜过滤,取上清液稀释一定倍数后进行高效液相检测。
1.3.3 定性与定量
在相同的色谱条件下,将样品色谱图与有机酸混标的色谱图进行对照,根据保留时间确定样品中各有机酸组分的色谱峰,结合有机酸的标准曲线,对样品中的有机酸进行定量。
1.3.4 色谱条件
色谱柱Venusil ASB C18(4.6 mm×250 mm,5 μm);流动相:96.9%超纯水-3.0%甲醇-0.1%甲酸;流速:0.5 mL/min;柱温:室温;检测波长:210 nm;进样量:20 μL。
2 结果与分析
2.1 标准曲线的建立
在1.3.4的色谱条件下,对7种有机酸的混合标准溶液进样,得到混标的色谱图见图1。

图1 混合标准溶液的色谱图Fig.1 Chromatograms of mixed standard solution
由图1可知,各物质分离度较好,出峰顺序和出峰时间为草酸(6.406 min)、奎宁(7.173 min)、苹果酸(8.575 min)、莽草酸(9.154 min)、乳酸(9.595 min)、乙酸(10.313 min)、柠檬酸(13.690 min),所有样品在20 min内出峰完毕。
依次测定梯度稀释的有机酸混标,以各有机酸质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制标准曲线,进行线性回归,并计算相关系数,结果如表2所示。
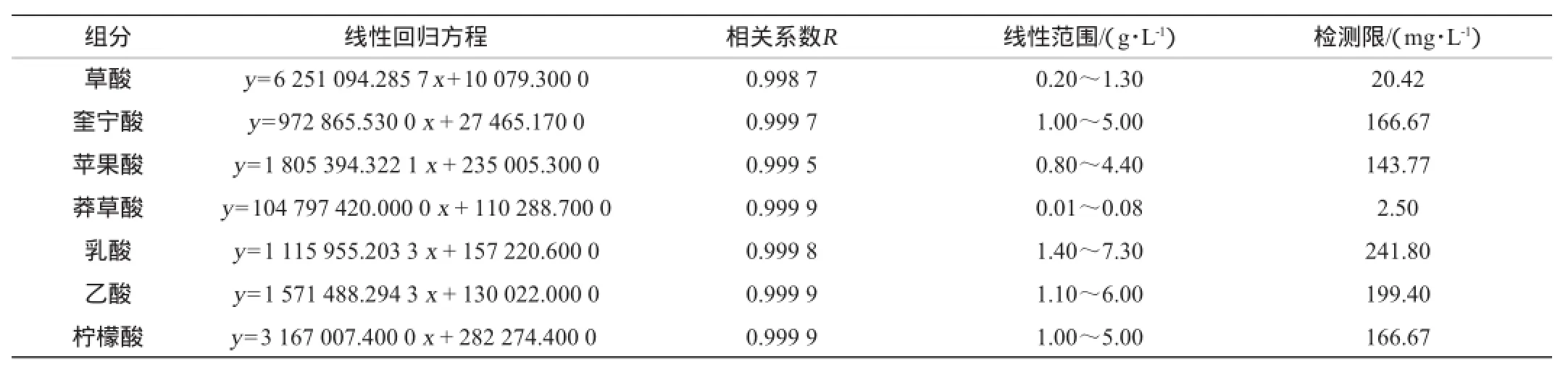
表27 种有机酸的回归方程和线性范围Table 2 Regression equations and linear range of seven organic acids
由表2可知,各组分在相应的线性范围内,相关系数R为0.998 7~0.999 9,表明线性关系良好,检测限为2.50~241.80 mg/L,能满足定量分析的要求。
2.2 6种蓝莓制品中有机酸含量的检测
本实验对6种笃斯越桔制品中的有机酸进行定量分析,高效液相色谱图分别见图2及图3,有机酸含量分析结果见表3。
由表3可知,笃斯越桔制品中的有机酸以奎宁酸为主,其次是苹果酸和柠檬酸,草酸、莽草酸的含量很低,乳酸和乙酸则几乎没有检出。魏鑫等[15]的研究主要分析了4种常见栽培蓝莓果实斯巴坦(Spartan)、伯克利(Berkeley)、泽西(Jersey)和北陆(Northland)中所含的有机酸主要是柠檬酸和苹果酸;PHILLIPS M M等[13]从北高丛蓝莓(Vaccinium corymbosum)SRM3287果实中检测到奎宁酸(2.696±0.095)mg/g,但含量要低于柠檬酸(3.19±0.14)mg/g。
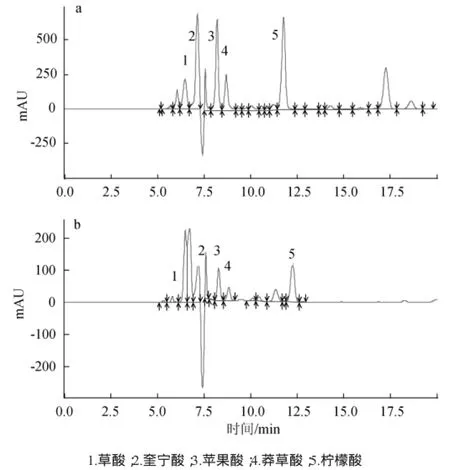
图2 大兴安岭蓝莓果汁(a)和果酱(b)的高效液相色谱图Fig.2 HPLC chromatogram of blueberry juice(a)and blueberry jam (b)made in Greater Khingan Mountains
蓝莓酒样中的有机酸种类与原料(果汁和果酱)基本相同,但含量有差别,奎宁酸、苹果酸和柠檬酸在发酵后的酒样中质量浓度均有所下降,而草酸和莽草酸的含量变化幅度都不大,乳酸和乙酸质量浓度依然较低。对比前后两年的发酵酒样可以发现,2014年发酵样品中各有机酸的含量普遍比2013年的样品高,而且经过木桶陈酿后,各组分质量浓度变化并不明显。
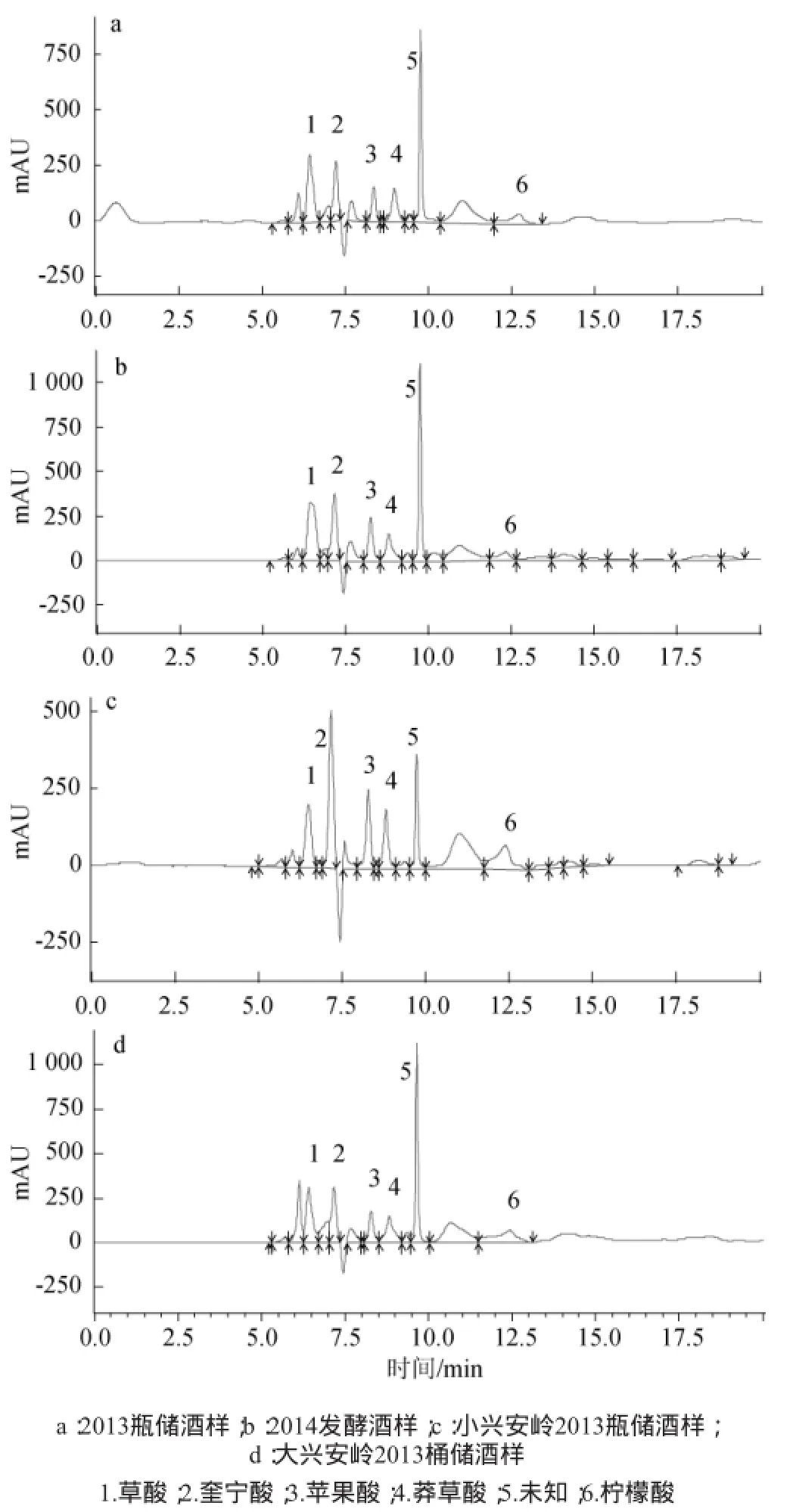
图3 4种蓝莓酒样的高效液相色谱图Fig.3 HPLC chromatogram of four blueberry wine samples
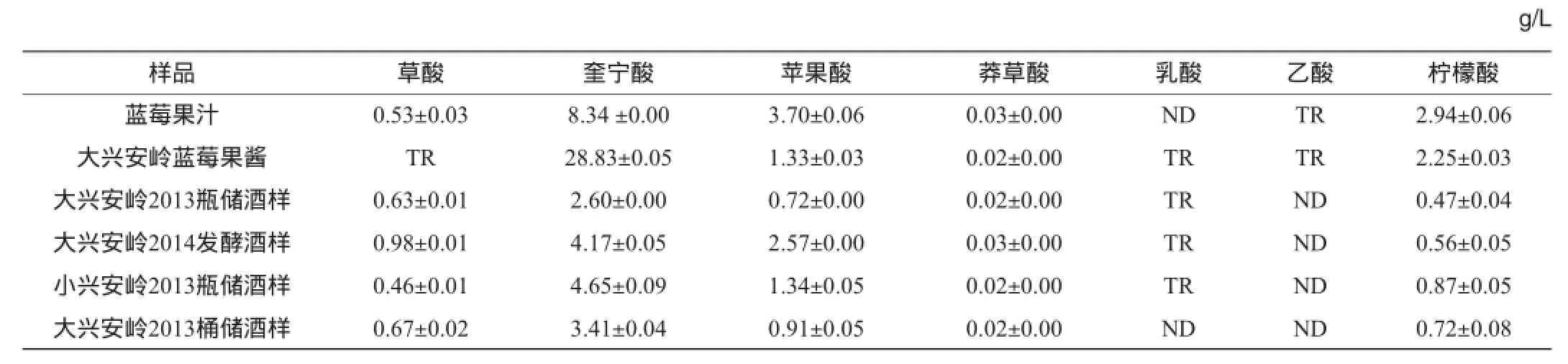
表3 蓝莓制品中有机酸的含量测定结果(n=3)Table 3 Determination results of organic acids in different blueberry sample(n=3)
表3结果表明,奎宁酸含量远高于苹果酸和柠檬酸,奎宁酸、苹果酸和柠檬酸是野生笃斯蓝莓制品中含量最为丰富的有机酸。
2.3 回收率实验
以大兴安岭蓝莓果汁为基底进行加标回收实验,在样品中分别加入苹果酸、奎宁酸和柠檬酸,经0.45 μm滤膜过滤后直接进样,结果见表4。
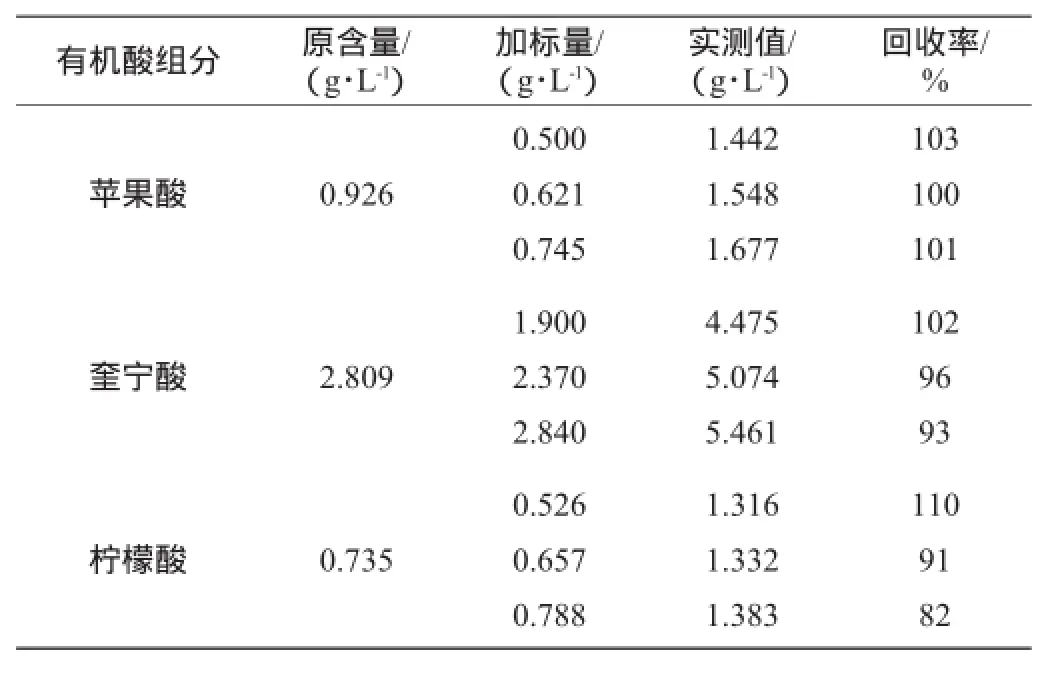
表4 蓝莓果汁中有机酸的加标回收实验结果Table 4 Adding standard recoveries results of organic acids in blueberry juice
由表4可知,各有机酸的加标回收率为82%~110%,表明本方法准确度高,重现性较好。
3 结论
本实验采用Venusil ASB C18色谱柱,建立了同时测定笃斯越桔制品中7种有机酸的定性和定量方法,该方法准确可靠,实现了对6种蓝莓制品中有机酸高效、快速、准确的检测。检测结果表明,笃斯越桔果汁、果酱和果酒中的有机酸主要为奎宁酸、苹果酸和柠檬酸3种,其中奎宁酸含量最多,乳酸和乙酸的含量很少;在发酵后的果酒中奎宁酸、苹果酸和柠檬酸的含量均有所下降。各有机酸的加标回收率为82%~110%,表明本方法准确度高,重现性较好。本研究建立的方法可以为笃斯越桔产品中有机酸的定性定量检测提供借鉴,对利用野生蓝莓为原料开发相关产品具有重要意义。
[1]OCHMIAN I,OSZMIAN′SKI J,SKUPIEN′K.Chemical composition, phenolics,and firmness of small black fruits[J].J Appl Bot Food Qual, 2012,83(1):64-69.
[2]史经略.蓝莓啤酒的研制[J].中国酿造,2009,28(1):180-182.
[3]RODRIGUEZ-MATEOS A,CIFUENTES-GOMEZ T,TABATABAEE S,et al.Procyanidin,anthocyanin,and chlorogenic acid contents of highbush and lowbush blueberries[J].J Agr Food Chem,2012,60(23): 5772-5778.
[4]陈亮,杨志勇,辛秀兰,等.蓝莓果酒发酵期间抗氧化成分及活性研究[J].中国酿造,2013,32(12):25-28.
[5]LACOMBE A,WU V C H,WHITE J,et al.The antimicrobial properties of the lowbush blueberry(Vaccinium angustifolium)fractional components against foodborne pathogens and the conservation of probioticLactobacillus rhamnosus[J].Food Microbiol,2012,30(1):124-131.
[6]郑红岩,高梦,刘建兰,等.不同品种蓝莓果实品质分析[J].食品与发酵工业,2013,39(11):245-249.
[7]李影,韩立杰,刘子菱,等.不同种类酵母对蓝莓果酒品质的影响[J].食品科技,2014,39(4):73-77.
[8]YOUSEF G G,BROWN A F,FUNAKOSHI Y,et al.Efficient quantification of the health-relevant anthocyanin and phenolic acid profiles in commercial cultivars and breeding selections of blueberries(Vacciniumspp.) [J].J Agr Food Chem,2013,61(20):4806-4815.
[9]MIKULIC-PETKOVSEK M,SCHMITZER V,SLATNAR A,et al.Composition of sugars,organic acids,and total phenolics in 25 wild or cultivated berry species[J].J Food Sci,2012,77(10):C1064-C1070.
[10]LI R,WANG P,GUO Q Q,et al.Anthocyanin composition and content of theVaccinium uliginosumberry[J].Food Chem,2011,125(1):116-120.
[11]FORNEY C F,KALT W,JORDAN M A,et al.Blueberry and cranberry fruit composition during development[J].J Berry Res,2012,2(3):169-177.
[12]胡小露,刘卉,鲁宁,等.HPLC法同时测定蓝莓汁及其发酵酒中9种有机酸[J].食品科学,2012,33(16):229-232.
[13]PHILLIPS M M,CASE R J,RIMMER C A,et al.Determination of organic acids inVacciniumberry standard reference materials[J].Anal Bioanal Chem,2010,398(1):425-434.
[14]GIBSON L,RUPASINGHE H P,FORNEY C F,et al.Characterization of changes in polyphenols,antioxidant capacity and physico-chemical parameters during lowbush blueberry fruit ripening[J].Antioxidants, 2013,2(4):216-229.
[15]魏鑫,魏永祥,刘成,等.高效液相色谱法测定4个蓝莓品种果实中糖酸组分及含量[J].中国果树,2013(3):64-67.
Determination of 7 organic acids inVaccinium uliginosumproducts by HPLC
WEI Ming,GU Pan,LI Chengjie,YANG Hangyu,LIU Shuxun,ZHANG Jiayue,YAN Zhixiu,ZHANG Bolin,ZHU Baoqing*
(Beijing Key Laboratory of Forest Food Processing and Safety,Department of Food Science,School of Biological Science&Technology, Beijing Forestry University,Beijing 100083,China)
A HPLC method was developed to determine organic acids in 6Vaccinium uliginosumproducts.The HPLC separation was achieved on C18column(4.6 mm×250 mm,5 μm)at room temperature.The mobile phase was 96.9%ultrapure water-3%methanol-0.1%formic acid at a flow rate of 0.5 ml/min.The detection wavelength was set as 210 nm and sample size was 20 μl.Seven organic acids could be successfully separated from V.uliginosumproductsusing this method,including oxalic acid,quinic acid,malic acid,shikimic acid,lactic acid,acetic acid and citric acid.The results indicated that the main organic acid existing inV.uliginosumproducts was quinic acid,followed by citric acid and malic acid;the contents of lactic acid and acetic acid were quite low.
Vaccinium uliginosumproducts;organic acids;HPLC
O657.7
A
0254-5071(2014)11-0145-04
10.11882/j.issn.0254-5071.2014.11.033
2014-09-11
国家自然科学基金青年项目(C150101);中央高校基本科研业务费专项资金(BLX2012040);北京林业大学大学生创新创业训练计划(X1310022033)
魏铭(1991-),女,硕士研究生,研究方向为食品微生物与生物技术。
*通讯作者:朱保庆(1982-),男,讲师,博士,研究方向为食品生物技术。

