响应面法优化三氯乙酸脱除滑子菇粗多糖蛋白质的工艺
臧玉红,李仁杰
(1.承德石油高等专科学校化工系,河北承德067000;2.中国药科大学生命科学与技术学院,江苏南京211196)
食用菌多糖是食用菌最重要的功能性物质之一,具有多方面的生物活性,如抗病毒、抗肿瘤、抗氧化、抗溃疡、抗衰老、抗辐射等生理功能。且对防止软骨病、预防感冒、降低血清胆固醇、增强免疫等也有良好的效果[1-4]。因此,近年来对提取食用菌多糖的研究越来越引起人们的关注。但要想对多糖的组成、结构和功能等进行更深入的研究,还需对粗多糖进行纯化,在多糖杂质中,影响最大、最难除去的杂质就是蛋白质,因为蛋白质不仅能与多糖形成复合物,增加对多糖的吸附性,而且蛋白质还具有热源性,影响多糖的分离,所以脱除蛋白质是纯化多糖的关键[5]。
目前,常用于脱除蛋白质的方法主要有:Sevag法、氯化钠法、壳聚糖絮凝法、三氯乙酸法(TCA)[5]、盐酸法、三氟三氯乙烷法、蛋白酶法[6]、超滤法[7]、大孔树脂法[8]等。经研究,每种脱除蛋白的方法各具特点[9-10],徐韧博等[5]对三氯乙酸法纯化多糖有一定的研究,但目前采用响应面法,对多糖的保留率及蛋白质的脱除率进行双响应值分析,纯化滑子菇多糖的优化工艺还未见报道,本实验采用三氯乙酸法,选择多糖溶液与三氯乙酸的比例(料液比)、脱除时间、三氯乙酸浓度等作为考察因素,在单因素实验基础上,采用三因素三水平的Box-Behnken确定多糖纯化条件,以蛋白质脱除率和多糖保留率作为评价指标,利用响应面拟和所得方程对滑子菇多糖纯化工艺进行优化,确定多糖保留率和蛋白质脱除率的最佳工艺,为滑子菇粗多糖的进一步纯化提供了科学依据,并且为合理地开发和利用滑子菇资源奠定了理论基础。
1 材料与方法
1.1 材料与仪器
滑子菇 市场采购;盐酸、氢氧化钠、正丁醇、95%乙醇、三氯甲烷、蒽酮、硫酸、葡萄糖、丙酮、三氯乙酸、苯酚等 均为分析纯;考马斯亮蓝G-250、牛血清蛋白 为生化试剂。
101-2型干燥箱 郑州市万博仪器设备有限公司;组织捣碎机 上海比朗仪器有限公司;80-2B型离心机 上海安宁科学仪器厂;HH-6型恒温水浴锅 国华电器有限公司;SHB-B型真空抽滤机 郑州长城科工贸有限公司;KDM型电热套 山东鄄城华鲁电热仪器有限公司;721型及722型分光光度计 上海第三分析仪器厂;JY3002型电子天平 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 三氯乙酸法脱除滑子菇多糖蛋白质的工艺流程图 滑子菇→粉碎→过筛→(脱脂)→称重→热水浸提→抽滤→滤液浓缩→醇沉→洗涤→烘干→粗多糖→加入TCA→静置→醇沉→离心→冷冻干燥→脱蛋白质多糖。
1.2.2 多糖含量的测定 苯酚-硫酸法[11-12]。标准葡萄糖溶液用苯酚-硫酸试剂处理后,在490nm处测吸光度,以葡萄糖质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,再测定待测样品溶液的吸光度,根据回归方程计算出相应的浓度,从而求出多糖的含量。
1.2.3 蛋白质含量的测定 采用考马斯亮蓝法[5-6,13]。以牛血清蛋白为标准,在595nm处测吸光值,以蛋白质浓度为横坐标,以吸光值为纵坐标,绘制标准曲线。
1.2.4 计算方法
1.2.4.1 多糖保留率 计算公式为:

其中:Y1—多糖保留率(%);A0—为初始样品中多糖的含量;A1—为脱除蛋白后样品中多糖的含量。
1.2.4.2 蛋白质脱除率计算[14]计算公式为:

其中:Y2—蛋白质脱除率;C0—为初始样品中蛋白质的含量;C1—为除蛋白处理后样品中蛋白质的含量。
1.2.5 单因素实验
1.2.5.1 多糖溶液与三氯乙酸的比例(料液比) 将10mg/m L滑子菇粗多糖溶液与10%的三氯乙酸试剂分别于3∶1、2∶1、1∶1、1∶2、1∶3、1∶4的体积比混合,静置60m in后,醇沉、3500r/m in离心10m in,分别测定蛋白质及多糖的含量,确定料液比对蛋白脱除率及多糖保留率的影响。
1.2.5.2 三氯乙酸浓度的选择 将滑子菇多糖提取液分别与1%、3%、5%、7%、9%、12%、15%(W/W)的TCA,充分摇匀后,静置60m in后,醇沉、3500r/m in离心10min,分别测定多糖和蛋白质的含量,确定三氯乙酸浓度对脱蛋白率及多糖保留率的影响。
1.2.5.3 脱除时间 将滑子菇多糖提取液与10%的TCA按1∶2混合后分别静置10、30、50、70、90、120、150min,醇沉、3500r/min离心10min,分别测定多糖和蛋白质的含量,确定作用时间对脱蛋白率及多糖保留率的影响。
1.2.6 响应曲面优化实验 在单因子实验的基础上采用中心组合实验Box-Behnken进行方案设计[15-19],优化脱蛋白工艺。选择料液比,脱蛋白时间,三氯乙酸浓度三个因素为自变量,分别以X1、X2、X3表示,并以+1、0、-1分别代表自变量的高、中、低水平进行编码,以蛋白质脱除率、多糖损失率为响应值,因素编码及水平见表1。
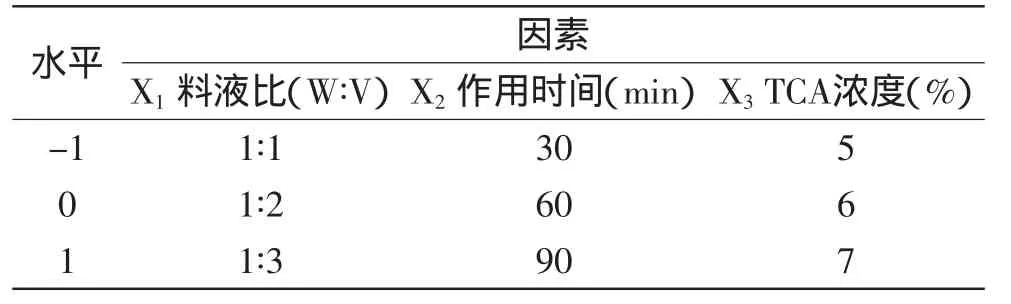
表1 Box-Behnken实验设计因素水平及编码Table1 Factors and coded levels in the Box-Behnken experimental design
2 结果与讨论
2.1 多糖含量测定和蛋白质含量测定的标准曲线
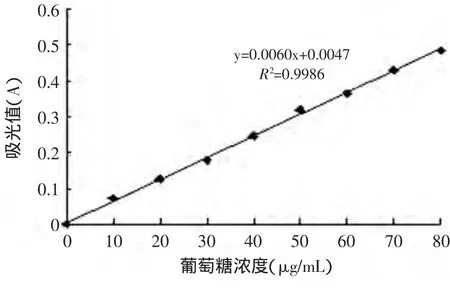
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
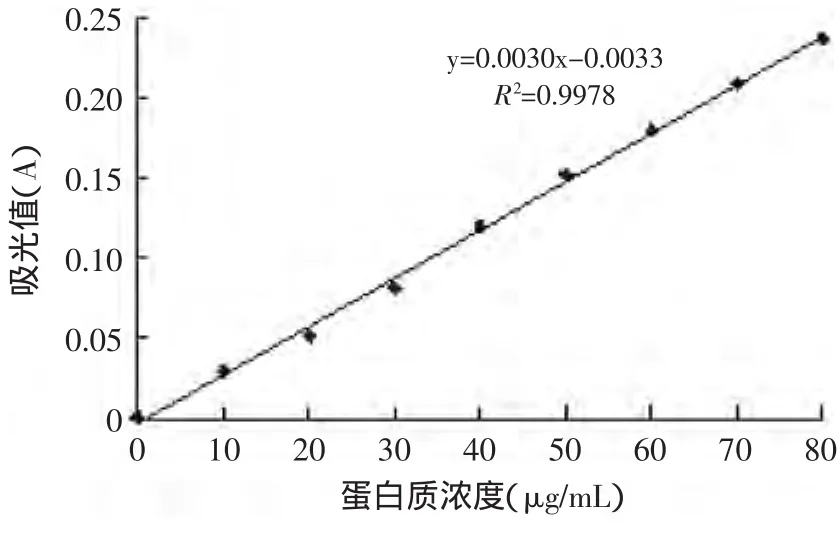
图2 蛋白质测定标准曲线Fig.2 The standard curve of protein
根据实验方法,得到多糖含量与吸光值的标准曲线如图1所示。蛋白质含量与吸光值的标准曲线如图2所示。
2.2 TCA法脱除蛋白单因素实验
2.2.1 滑子菇多糖提取液与三氯乙酸比例(料液比)对蛋白质脱除率及多糖保留率的影响 结果如图3所示。通过图3分析可知,料液比对蛋白质的脱除率和多糖的保留率都有比较明显的影响,其中蛋白质的脱除率随着料液比的升高呈现上升趋势,而糖的保留率则呈下降趋势,料液比1∶1后,脱除蛋白的能力缓慢增加,但多糖损失率则明显下降,综合考虑,多糖样品与TCA的比值在1∶2附近较好。
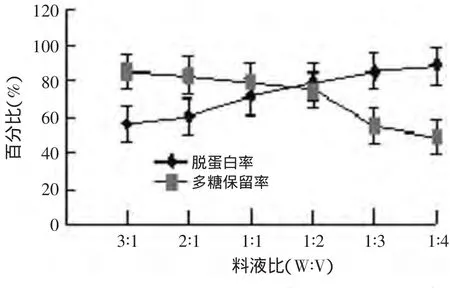
图3 料液比对蛋白质脱除率和多糖保留率的影响Fig.3 Effectof solid-liquid ratio on the removal protein yield and polysaccharide
2.2.2 三氯乙酸浓度对蛋白质脱除率及多糖保留率的影响 结果如图4所示。通过分析可知,TCA浓度变化对脱除蛋白质及多糖的保留值都有显著的影响,增加TCA用量可以明显提高蛋白质的脱除率,但多糖损失率也在显著增加。当TCA用量7%以上时,随TCA浓度继续增加,蛋白质脱除率增加缓慢,而多糖保留率则大幅度下降,从蛋白质的脱除率及多糖保留率两方面综合考虑,6%的TCA浓度能对滑子菇多糖中蛋白质的脱除有较好的效果,且多糖保留率较高。
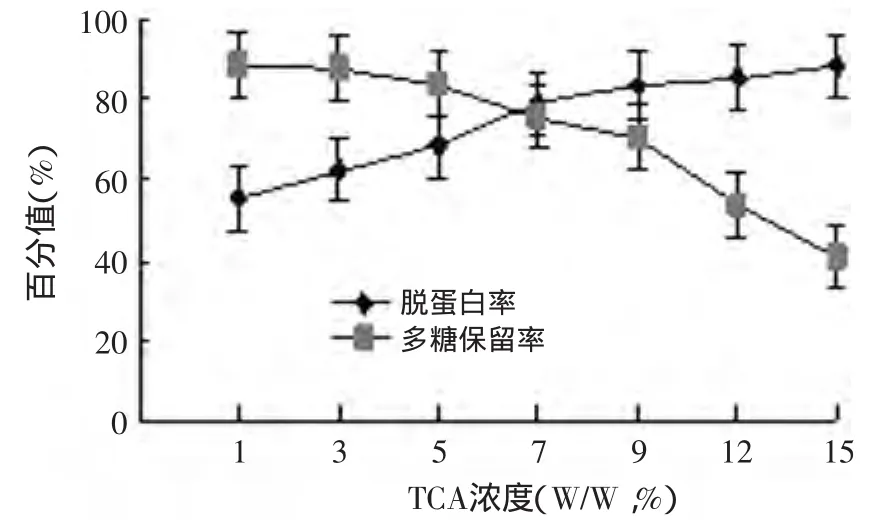
图4 TCA浓度对蛋白质脱除率及多糖保留率的影响Fig.4 Effectof concentration of TCA on the removal protein yield and polysaccharide retention yield
2.2.3 作用时间对蛋白质脱除率及多糖保留率的影响 结果如图5所示。由图5分析可知,TCA与多糖提取液混合后静置时间对多糖和蛋白质都有影响,开始时,随着静置时间的延长,蛋白质的脱除效果明显增大,60m in后,蛋白质脱除趋于平稳,而多糖的保留率则继续下降,综合考虑,60m in是最佳处理时间。
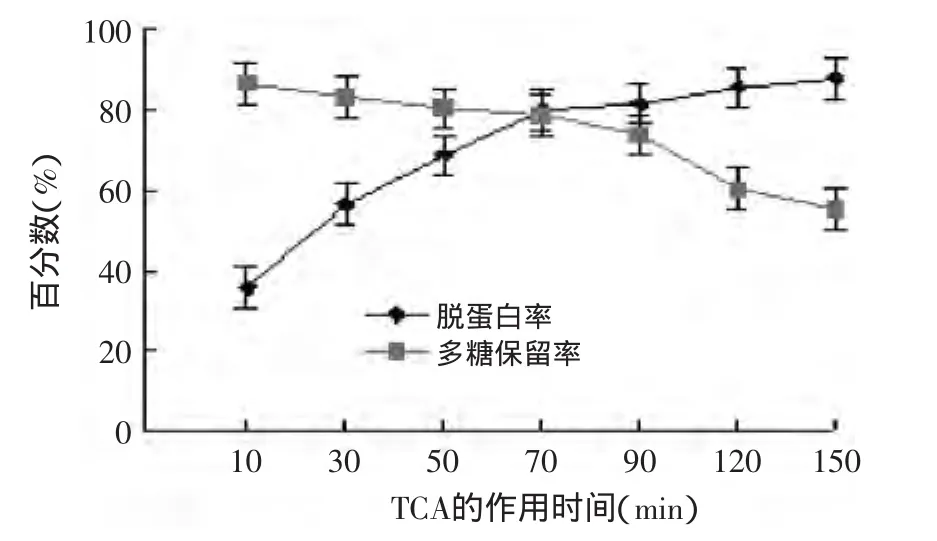
图5 TCA作用时间对蛋白质脱除率及多糖保留率的影响Fig.5 Effect of TCA role of times on the removal protein yield and polysaccharide retention yield
2.3 响应曲面的设计实验
按照表1的Box-Behnken实验设计方案进行3因素与3水平实验,结果如表2所示。
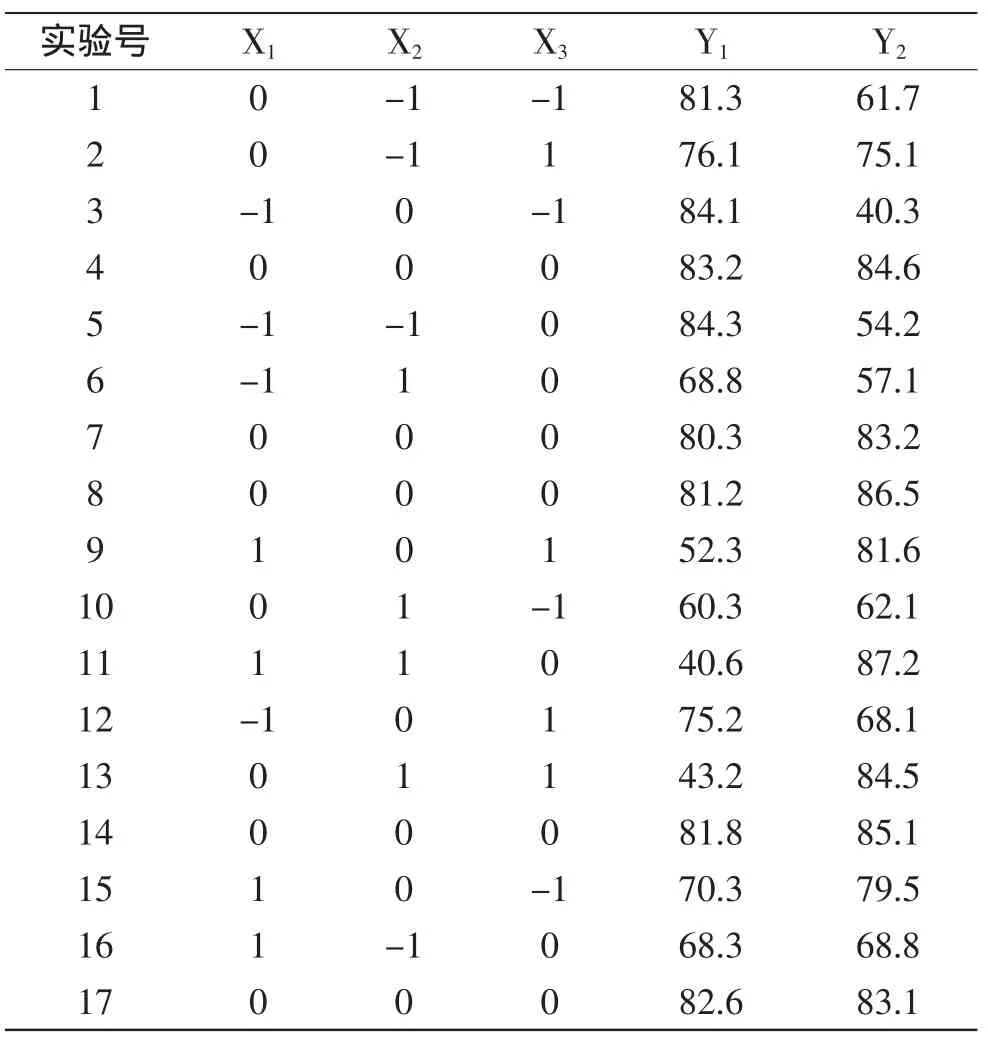
Table2 Box-Behnken实验设计与结果Table2 Box-Behnken experimental designmatrix and experimental results
2.4 回归模型的建立及其显著性检验
利用Design Expert 8.05b软件对表2的实验数据进行多元回归拟合,获得多糖保留率(Y1)和蛋白质脱除率(Y2)对自变量料液比(X1)、脱除时间(X2)、TCA浓度(X3)的二次多项回归方程为:
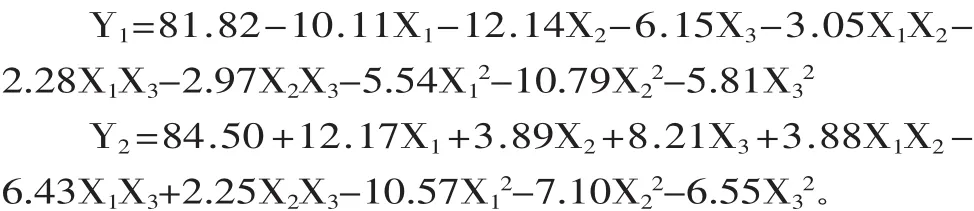
多糖保留率(Y1)和蛋白质脱除率(Y2)的回归方程方差分析及模型系数显著性检验结果分别见表3和表4所示。
通过表3分析可知,该模型中各因素对滑子菇多糖保留率影响的程度分别为:X1、X2、X3、X影响高度显著;X、X影响极显著;X1X2、X2X3影响显著;而只有X1X3影响不显著。所考察因素的显著性排序为:X2、X1、X3,即:作用时间、样液与TCA的比值、TCA浓度。
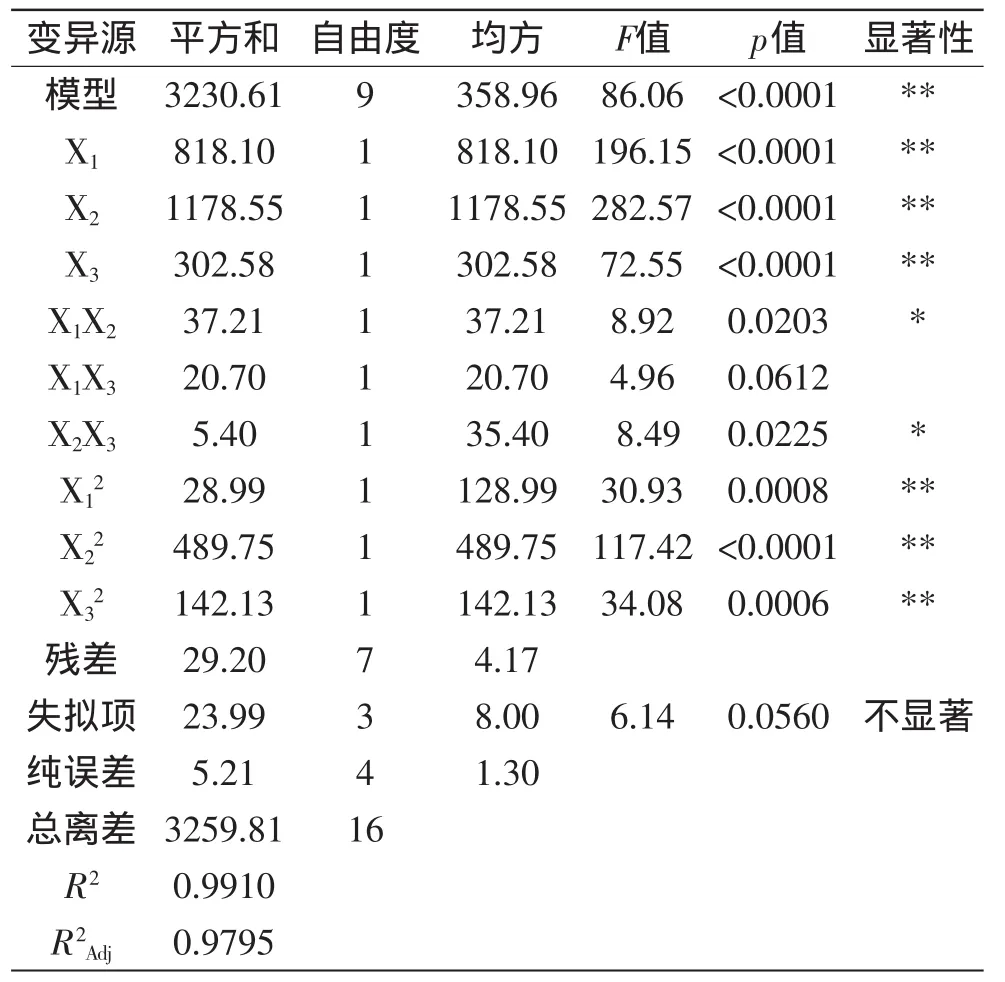
表3 多糖保留率(Y1)回归方程模型方差分析及方程系数显著性检验Table3 Analysis of variance and significance test for each of the fitted regression equationmodel of the polysaccharide retention yield(Y1)
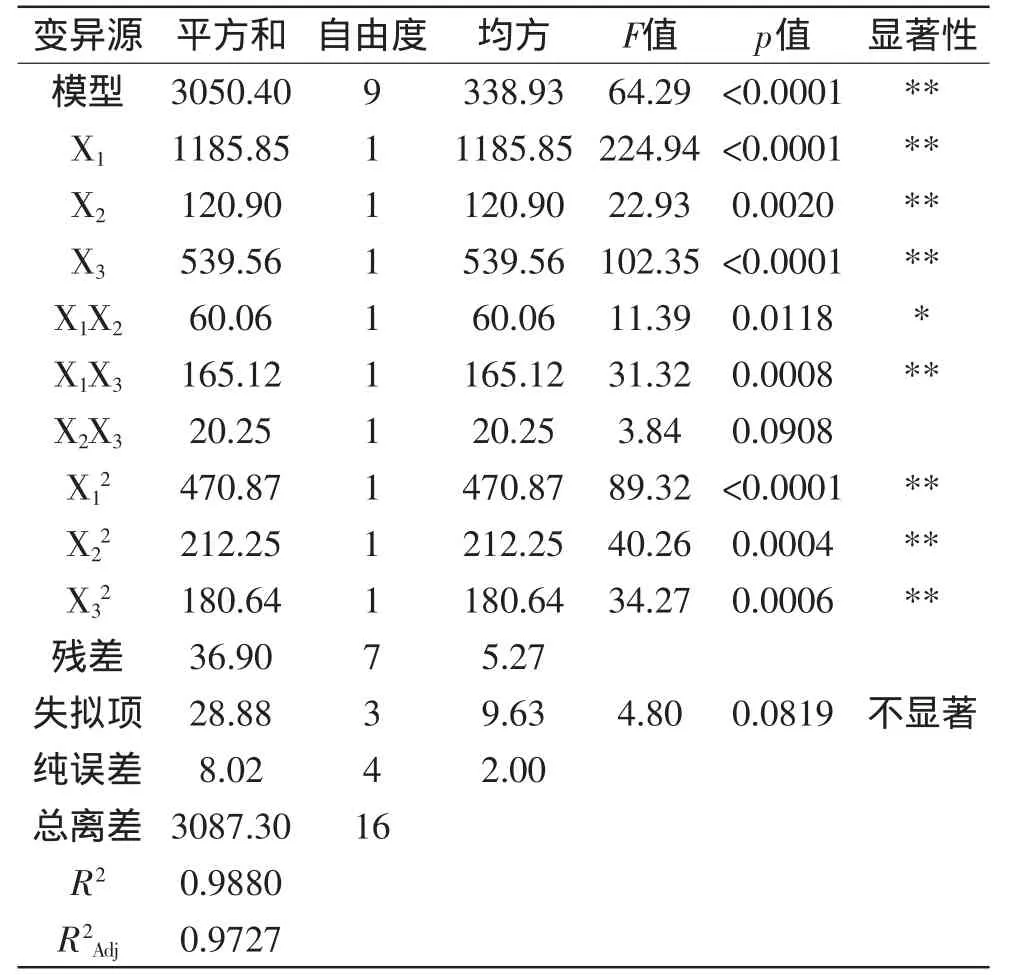
表4 蛋白质脱除率(Y2)回归方程模型方差分析及方程系数显著性检验Table4 Analysisofvariance and significance test foreach of the fitted regression equationmodel of the removal protein yield(Y2)
由表4分析可知,该模型中各因素对脱除蛋白质影响的程度分别为:X1、X3、X影响高度显著;X2、X1X3、X、X影响极显著;X1X2影响显著;而只有X2X3影响不显著。所考察因素的显著性排序为:X1、X3、X2,即:样液与TCA的比值、TCA浓度、作用时间。
由表3、表4综合分析可知,Y1、Y2回归模型的R2分别为0.9910、0.9880,R分别为0.9795、0.9727,说明该模型的拟合度非常好,p值均<0.0001,表明此模型是高度显著的,可以采用回归模型对响应值多糖的保留率(Y1)和蛋白质的脱除率(Y2)进行预测,说明该模型是有意义的。该模型失拟项的p值分别为0.0560、0.0819(p>0.05),说明其影响不显著,即失拟项与纯误差没有显著差异,则说明实验操作可信,可以用回归方程代替实验真实点对实验结果进行分析和预测。
2.5 响应面分析
根据回归方程,作响应曲面图,考察所拟合响应曲面的形状,分析各影响因素对多糖保留率和蛋白质脱除率的影响以及各因素间的交互效应,如图6(a~f)所示。各图显示作用时间、料液比、TCA浓度中任意两个变量编码为零水平时,其余两个变量对多糖保留率的影响(图6a~c)和对蛋白质脱除率的影响(图6d~f)。
从图6(a~f)中可以看出,当三个因素中任意一个因素取中间值,其余两个因素同时变化时,随着二者的增加,多糖保留率Y1均呈现比较明显的下降趋势,而蛋白质脱除率Y2则呈现明显的上升趋势。其中,图6(e)的曲面最陡峭,表明TCA浓度和料液比之间对蛋白质脱除率交互性最强,图6(a)、图6(c)、图6(d)曲面较陡峭,而图6(b)、图6(f)曲面坡度较为缓慢,表明脱除时间和料液比之间对多糖保留率、蛋白质脱除率均有较强的交互作用,脱除时间和TCA浓度对多糖保留率有较强的交互作用,这与方差分析的结果相一致。
根据Box-Behnken实验所得到的数据结果和回归方程,利用Design Expert 8.05b软件处理所得数据,从中可以获得一组最佳工艺参数:料液比1∶2.76,作用时间51.96m in,TCA浓度5.78%,在此条件下,多糖保留率预测值为75.40%,蛋白质脱除率为84.39%。根据实际情况,确定料液1∶3,作用时间50min,TCA浓度6%,实际测得多糖保留率为75.08%,蛋白质脱除率为84.16%,与预测值接近,可见该模型对滑子菇多糖保留效果和蛋白质的脱除效果能进行较好的预测。
3 结论
3.1 在单因素实验的基础上,采用响应面分析法对主要影响因素进行中心组合设计实验,并利用Design Expert 8.05b软件对实验数据进行多元回归拟合,通过方差分析,得到该模型中各因素对滑子菇多糖保留率影响的显著性排序为:X2、X1、X3,即:作用时间、样液与TCA的比值、TCA浓度。对蛋白质脱除率影响显著性排序为:X1、X3、X2,即:样液与TCA的比值、TCA浓度、作用时间。
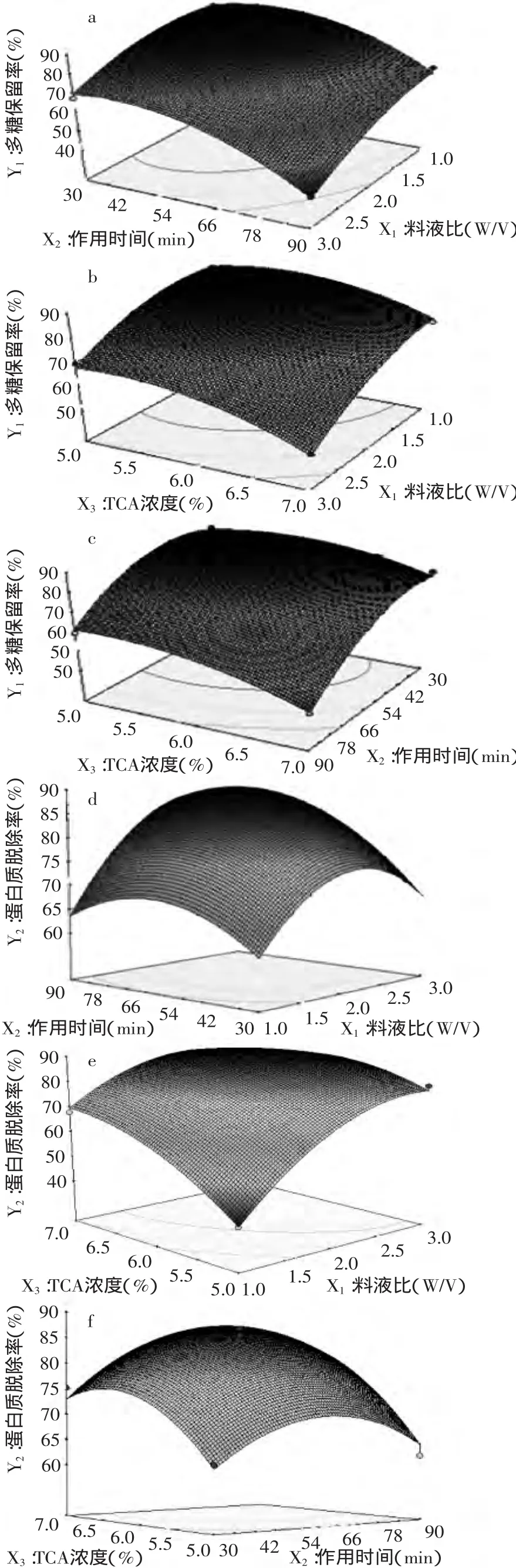
图6 各因素交互作用对多糖保留率(a~c)和蛋白质脱除率(d~f)的影响Fig.6 The effectof experimental factors interaction on the polysaccharide retention yield(a~c)and the removal protein yield(d~f)
3.2 根据回归方程对多糖保留率和蛋白质脱除率两个方面进行考核,得到三氯乙酸法纯化滑子菇多糖的最佳工艺参数为:多糖提取液与TCA体积比为1∶3,脱除时间为50min,TCA浓度为6%,在此条件下多糖保留率为75.08%,蛋白质脱除率为84.16%,与预测值接近,可见该模型对滑子菇多糖保留效果和蛋白质的脱除效果能进行较好的预测。
[1]TONG Hai-bin,XIA Feng-guo,FENG Kai,et al.Structural Characterization and Invitro Antitumor Activity of Anovel Polysaccharide Isolated from the Fruiting Bodies of Pleurotus ostreatus[J].Bioresour Technol,2009,100(4):1682-1686.
[2]王雪冰,赵天瑞,樊建.食用菌多糖提取技术研究概况[J].中国食用菌,2010,29(2):3-6.
[3]林英,曹松屹,曹冬煦,等.海带多糖提取方法研究进展[J].水产科技情报,2008,35(4):168-170.
[4]LAI Fu-rao,WEN Qi-biao,LI Lin,et al.Antioxidant activities of water-soluble polysaccharide extracted form Mungbean(vigna radiate L)hullwith ultrasonic assisted treatment [J].Carbohydrate Polymers,2010,81(2):323-329.
[5]徐韧博,邹攀,杨鑫.红松松塔多糖三氯乙酸法脱蛋白工艺的研究[J].中国甜菜糖业,2013(1):5-8.
[6]杨辉,闫明明.响应面法优化酸性蛋白酶脱除大枣多糖蛋白工艺[J].粮食与油脂,2012(11):49-52.
[7]毕华,张民,王婵,等.超滤对大蒜粗多糖中蛋白质的脱除效果[J].天津科技大学学报,2013,28(1):14-16.
[8]李德海,孙常雁,刘利.滑菇子实体多糖纯化工艺的初步研究[J].中国林副特产,2011,114(5):43-46.
[9]乔茜茜,祁英,孙建忠,等.啤酒花多糖的提取及脱蛋白工艺研究[J].食品工业科技,2012,33(16)16-18.
[10]张唐伟,柳青海,李天才.地木耳多糖的提取与纯化研究[J].中国野生植物资源,2011,30(3):34-37.
[11]臧玉红,牛桂玲,李丽娟,等.滑子菇水溶性多糖提取工艺的研究[J].食品科技,2006(11):135-139.
[12]刘菲霞,李红娟,徐强,等.滑菇子实体多糖提取条件优化及抗氧化活性研究[J].山东农业科学,2013,45(1):117-121.
[13]王文平,郭祀远,李琳,等.考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J].食品研究与开发,2008,29(1):115-117.
[14]王龙艳,王文侠,张慧君,等.豆渣碱溶性粗多糖除蛋白工艺的研究[J].中国食品添加剂,2013,(1):98-103.
[15]谢丽源,彭卫红,甘炳成.桑黄多糖脱蛋白方法与条件优[J].西南农业大学,2011,24(1):363-365
[16]杨润亚,杨树德,董洪新.响应面法优化猪肚菇多糖的提取工艺[J].食品科学,2011,32(14):29-33.
[17]黄芳,梁倩倩,周宏.响应面法优化龙须菜多糖提取工艺[J].食品工业科技,2013,34(7):260-264.
[18]岳金玫,蒲彪,周月霞,等.响应面法优化块菌多糖的酶法辅助提取工艺[J].食品科学,2013,34(2):119-124.
[19]魏桢元,钟耀广,刘长江.响应面优化法对香菇多糖提取的工艺研究[J].辽宁农业科学,2010(2):11-14.

