多发性骨髓瘤中p15基因甲基化及其mRNA表达的研究
李灿美,杨 凌,刘 琳,李一辉,杨善兰,金美四,贺振新
(1.大理州人民医院 血液肿瘤科,云南 大理 671000;2.昆明医科大学第一附属医院 血液科,云南 昆明 650032;3.昆明医科大学第二附属医院 血液科,云南 昆明 650101)
多发性骨髓瘤(multiple myeloma,MM)是起源于B淋巴细胞的恶性克隆性疾病,其具体发病机制尚未阐明,常规化疗效果差,迫切需要探索其发病机制,寻找新的治疗途径。近年来国内外的大量研究均已证实DNA甲基化是血液肿瘤抑癌基因失活的常见机制。p15基因都是细胞周期蛋白依赖性激酶抑制剂(CDKI)家族的重要成员,是目前研究较多的抑癌基因。近十年来的文献报道中,MM患者p15基因甲基化的阳性率在1.8%~75%之间[1,2]。各家的结果很不一致。为了探讨p15基因甲基化与MM发生、发展及预后的关系,我们采用甲基化特异性聚合酶链反应(MSP) 研究MM中p15基因甲基化与其mRNA转录阻抑的关系,为该病的治疗提供一定的理论基础。
资料与方法
一、临床资料 选取2009年1月~2011年6月确诊的54例多发性骨髓瘤患者骨髓标本,标本来自昆明医学院第一附属医院血液科和第二附属医院血液科,其中男性35例,女性19例,年龄38~79岁,中位年龄64岁,平均年龄(63.44±8.94)岁,包括初诊患者27例,复发患者27例。Druie-Salmon分期:I期A组2例,II期A组16例,II期B组16例,III期A组19例,III期B组13例。所有病例诊断均符合标准[3]。对照组为非血液肿瘤患者骨髓标本(主要为营养不良性性贫血和免疫性血小板减少症患者),共40例。
二、试剂和仪器 DNA提取试剂盒,RNA提取试剂盒为杭州Axygen Bioscigens公司产品。EZ DNA Methylation-GoldTM Kit,Zymo Taq PreMix TM Kit为美国ZYMO Research公司产品。 TRIzol Reagent抽提液,Platinum SYBR Green qPCR SuperMix-UDGKit等购自美国Invitrogen公司。PCR扩增仪,qPCR扩增仪和全自动凝胶图像分析仪均为美国Bio-rad公司的产品。p15基因甲基化的引物序列(参照文献[4)]由上海invitrigen公司合成。qPCR引物采用primer3.0软件设计,产物长度控制在100-150bp,并用NCBI primer blast进行引物检测,确认为单一性产物。所有引物具体序列、产物长度及退火温度见附表。
三、DNA与RNA的提取 基因组DNA的提取、DNA亚硫酸氢盐修饰、修饰后模板的纯化按Herman[4]方法。RNA的提取采用杭州Axygen Bioscigens公司的RNA提取试剂盒,按试剂盒操作步骤提取,并用分光光度仪测定RAN浓度。
四、MSP法检测p15基因启动子区的甲基化状态 1.已修饰并纯化的DNA2μl,加入上下游引物各1μl,热启动酶Zymo Taq Pre Mix25μl,加入RNase-Free&DNase-Free ddH2O21μl,构成总体积50μl的反应体系。在反应条件是95℃预变性10min,95℃变 性30s,58℃退 火30s,72℃延 伸30s,共35个循环,72℃链接7mim。最后进行结果判定,取PCR产物5μl,2%琼脂糖凝胶TBE电泳。电泳完毕后,取下凝胶,紫外线灯下观察结果。以DNA marker2000bp标准分子质量,泳动位置与预期片段长度相符的特异性产物判断为阳性,拍片记录。2.将MSP扩增产物50μl冰盒保存,送上海Invitrogen公司行全自动测序技术测序,测序结果运用DNAstar软件进行拼接,BiQAnalyzer软件进行比对分析。
五、RT-qPCR检测p15基因mRNA表达情况1.RT-qPCR反应体系,将提取的RNA用Easy Script First-Strand cDNA Synthesis SuperMix Kit将其逆转录为cDNA保存。取cDNA4μl,加入上下游引物 各1μl,Platinum SYBR Green qPCR Super-Mix-UDG 25μl,加 入RNase-Free&DNase-Free ddH2O 19μl,构成总体积50μl的反应体系。在反应条件是50℃、95℃预变性各2mim,95℃变性15s,60℃退火30s,共40个循环,65-95℃溶解曲线1min下进行PCR反应。实验中以GAPDH作为内标基因,以标准化各个标本中p15基因相对表达量,以Hela及HEPG2为质控,以P15基因作为目的基因。2.结果判定标准,反应的数据由Bio-Rad CFX软件进行收集及分析。通过目的基因和内参基因拷贝数的比值进行样本间相对定量的比较。所有数值以相对于GAPDH基因升高或减少的倍数(Fold)表示。所有标本的基因复制的数值均以阈值循环(Cycle threshold Ct)表达[3]。具体如下:目的基因的表达量=2-△△Ct,△△Ct=(Ct目的基因-Ct内标基因)实验组-(Ct目的基因-Ct内标基因)对照组,表示的是实验组目的基因相对于对照组的变化倍数,使用这一方法可直接得到目的基因相对于内参基因组的定量[4]。

附表 引物序列及退火温度
六、统计学方法 甲基化情况分析采用四格表χ2检验,基因表达分析以中位数加减四分位数间距进行描述,两组间采用随机样本秩和检验统计分析,均以P≤0.05时有统计学差异(统计用SPSS17.0统计软件包)。
结 果
一、MM患者p15基因的甲基化状态 54例MM患者的MSP检测结果为:p15基因启动子区CpG岛甲基化阳性者有15例,甲基化率是27.778%,其检测结果通过电泳均可见到一条148bP的甲基化阳性PCR扩增产物,大多数同时伴有154bp的甲基化阴性PCR扩增产物(如图1所示)。其余的39例多发性骨髓瘤患者只检测到一条154bP的甲基化阴性PCR扩增产物。40例正常人及非累及骨髓的血液病患者仅检测到154bp的甲基化阴性PCR扩增产物,均无甲基化。MM患者p15基因的甲基化率与对照组比较差异有统计学意义(P<0.05)。
二、p15基因CpG岛甲基化与多发性骨髓瘤某些临床特征之间的关系
1.根据病程阶段将所收集的多发性骨髓瘤患者分为初发及复发两组。结果为初发组27例中9例p15基因甲基化,阳性率为33.333%;而复发组27例中9例发现甲基化,阳性率22.22%。初发和复发两组多发性骨髓瘤患者P15基因CpG岛甲基化率呈逐渐降低趋势,初发组>复发组。但统计学分析显示初发组患者的p15基因甲基化率虽然高于复发组,但无显著性差异(P>0.05)。
2.根据所收集资料将多发性骨髓瘤患者以65岁的年龄分为两组。结果为年龄≥65的组p15基因甲基化率为26.923%,而年龄<65的组p15基因甲基化率28.571%对多发性骨髓瘤患者进行年龄分组对p15基因CpG岛甲基化率进行比较,统计学分析显示均无显著性差异(P>0.05)。
3.根据所收集资料我们将多发性骨髓瘤患者以性别分为两组。结果为男性的组p15基因甲基化率为26.923%,而女性组p15基因甲基化率28.571%。对多发性骨髓瘤患者进行性别分组对p15基因CpG岛甲基化率进行比较,统计学分析显示均无显著性差异(P>0.05)。
4.不同临床分期,分组间多发性骨髓瘤患者p15基因CpG岛甲基化状态。对I,Ⅱ及Ⅲ期多发性骨髓瘤患者p15基因CpG岛甲基化率进行比较,统计学分析显示均无显著性差异(P>0.05)。对A组和B组多发性骨髓瘤患者p15基因CpG岛甲基化率进行比较,统计学分析显示均无显著性差异(P>0.05)。
5.甲基化与非甲基化标本测序结果分析。将MSP扩增阳性及阴性标本进行测序,测序结果运用DNAstar软件进行拼接,测序结果用BIQanalyzer软件进行分析,比对分析分析具体甲基化位点。结果显示(见图2):在p15基因启动子区5’端产物检测出19处碱基发生甲基化。
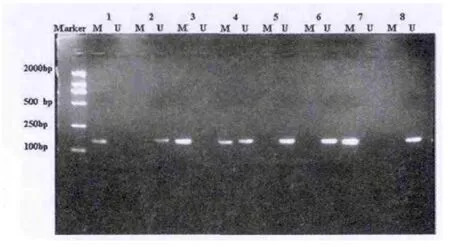
图1 MSP检测多发性骨髓瘤患者P15基因Cp G岛甲基化状态

图2 p15启动子区5'端甲基化与非甲基化序列比较图
6.p15基因甲基化与其mRNA表达结果分析。对实验数据进行正态性检验,偏度(Skewness,Sk)、峰度(Kutosis,Ku) 均>0,提示实验数据呈正偏态分布。随后对实验组和对照组、甲基化组和非甲基化组进行Wilcoxon两样本秩和检验。P15基因在mRNA表达水平上,实验组:28.64±28.77Fold;对照组:25.79±78.16Fold,实验组与对照组之间比较,差异无统计学意义(P>0.05)。甲基化组:28.64±19.13Fold;非甲基化组:29.86±29.24Fold;甲基化组与非甲基化组比较,差异无统计学意义(P>0.05);初诊组:23.92±26.46Fold;复发组:36.13±27.65 Fold;甲基化组与非甲基化组比较,差异无统计学意义(P>0.05)。
讨 论
DNA甲基化是哺乳动物遗传外修饰的重要调控方式,在基因表达调控,基因结构的稳定等方面有重要作用。研究表明,DNA甲基化模式改变与肿瘤形成有密切关系[5]。p15基因(又名CDKN2B cyclin-dependent kinase inhibitor 2B,inhibits CDK4) 是定位于人类第9号染色体9p21上的抑癌基因,是细胞周期素依赖激酶抑制剂(CDKI) 家族的重要成员。p15基因抑制细胞周期素依赖激酶(CDK4/6) 的活性,阻止Rb(视网膜母细胞瘤蛋白) 基因磷酸化,抑制转录因子E2F解离,使细胞周期在G→S转换中停滞,导致细胞恶性转化。研究发现,多种血液系统恶性肿瘤都存在p15基因的甲基化失活现象,在各种类型的急性白血病、慢性髓细胞性白血病、前髓性白血病、成人淋巴细胞性白血病和淋巴瘤中都有p15基因启动子区的甲基化[6-7];Martin等[8]发现p15基因的异常与浆细胞疾病有关,在多发性骨髓瘤中p15基因高甲基化是重要的事件。但Galm[1]等人的结论与之相反,他们在53例患者中仅发现1例p15基因启动子区的甲基化。
我们的研究显示,p15基因启动子区的异常甲基化比例明显高于对照组,表明p15基因异常甲基化可能在MM发生中为重要失活机制。电泳发现有甲基化等位基因(M)扩增的肿瘤标本中往往可见非甲基化等位基因(U)的同时扩增,考虑原因可能为多发性骨髓瘤细胞中混有正常细胞,难以排除正常DNA的干扰,在行MSP时非甲基化DNA和甲基化DNA的p15基因同时被扩增,或者肿瘤细胞中P15基因的两个等位基因有一个未发生甲基化之故,这两种原因在电泳中难以区分。所以,我们对MSP产物进行测序,其结果显示:在p15启动子区5’端产物检测出19处碱基位点发生甲基化。这表明p15启动子区异常甲基化是存在的。
我们试图寻找p15基因甲基化与MM临床特征和预后的关系。但研究表明,性别,年龄,I,Ⅱ及Ⅲ期和A,B组的多发性骨髓瘤患者的p15基因CpG岛甲基化率无统计学差异,与Esteban等的结论一致[9]。提示p15基因甲基化可能是多发性骨髓瘤发病中的一个早期作用环节。我们的研究表明,初发及复发两组多发性骨髓瘤患者p15基因CpG岛甲基化率呈降低趋势,尤其初发组甲基化率略高于和复发组,但统计上并无显著性差异(P>0.05),这种降低趋势提示p15基因甲基化可能与多发性骨髓瘤患者的化疗反应有关,但这种推测有待于进一步增加样本量来证实,因为传统的化疗药物很少具有逆转甲基化的作用,因此该结论的可信性有待进一步论证。
虽然甲基化直接与基因的转录有关,但是遗传物质DNA到蛋白质经历转录、翻译特别是转录过程中所转录的mRNA的多少直接影响着相关最终蛋白质的多少。因此本研究采用RT-qPCR检测转录抑制状态来了解MM的进展程度,治疗效果及预后的判断。研究结果显示多发性骨髓瘤患者的骨髓液中p15基因mRNA的表达水平与对照组之间无统计学差异(P>0.05) ,甲基化组与非甲基化组,初诊与复发组亦无统计学差异(P>0.05)。提示尚不能根据p15基因mRNA的表达水平判断多发性骨髓瘤的病理分期、进展情况等。此结果不排除标本量不足产生的结果偏差,需加大标本量进一步研究。同时该研究结果与王明鸣等[10]报道的U266细胞株接近,提示甲基化并非唯一调控p15mRNA表达的因素,其翻译为蛋白的过程中还受到其他机制的调控。
总之,p15基因作为与细胞周期调控有关的重要抑癌基因,其甲基化的异常在多发性骨髓瘤中确实存在,MSP方法灵敏性高,因此使用MSP方法检测p15基因的甲基化状态将有可能成为检测MM微小残留病的一个指标[11],去甲基化的药物可能是一种有效的治疗方法[12]。
[1]GALM O,WILOPS,REICHELT J,et al.DNA methylation changes in multiple myeloma[J].Leukemia,2004,18:1687-1692.
[2]CHIM CS,KWONG YL,FUNG TK,et al.Methylation profilingin multiplemyeloma[J].Leuk Res,2004,28:379-385.
[3]张之南,沈悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2007:232-235.
[4]HERMANJG,GRAFFJR,MYOHANENS,et al.Methylation-specific PCR:a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci USA,1996,93(18):9821-9826.
[5]BAYLINSB.DNA methylation and gene silencing in cancer[J].Nat Clin Pract Oncol,2005,Suppl 1:s4-11.
[6]AMARA K,TRIMECHEM,ZIADIS,et al.Prognostic significance of aberrant promoter hypermethylation of CpG islands in patients with diffuse large B cell lymphomas[J].Ann Oncol,2008,19(10):1774-1786.
[7]YANGY,TAKEUCHIS,HOFMANNWK,et al.Aberrant methylation in promoter associated CpG islands of multiple genes in acute lymphoblastic leukemia[J].Leuk Res,2006,30(1):98-102.
[8]MARTINP,GARCIA CM,SANTONA,et al.Aberrant gene promoter methylation in plasmacell dyscrasias[J].Exp Mol Pathol,2008,84(3):256-261.
[9]ESTEBANB,ANGELOM,MARIA E,et al.Methylation status of nine tumor suppressor genes in multiple myeloma[J].Int JHematol,2010,91:87-96.
[10]王明鸣,朱琦,任志宏,等.砷剂诱导多发性骨髓瘤细胞SOCS1基因去甲基化的研究[J].中国实验血液学杂志,2008,16(5):1064-1068.
[11]BRIANAW,GARETH JM.Could DNA methylation become a useful measure for multiple myeloma prognoses[J].Expert Rev Hematol,2011,4(2):125-127.
[12]SHENKER N,FLANAGAN JM.Intragenic DNA methylation:implication of this epigenetic mechanism for cancer research[J].Brit Jof Cancer,2012,106:248-253.

