抗病毒中药复方制剂对雏鸡IFN-γ水平影响的研究
王赛, 周李, 康莲莲, 杨荣, 刘群
(西南民族大学生命科学与技术学院, 四川 成都 610041)
抗病毒中药复方制剂对雏鸡IFN-γ水平影响的研究
王赛, 周李, 康莲莲, 杨荣, 刘群
(西南民族大学生命科学与技术学院, 四川 成都 610041)
为了探讨抗病毒中药复方制剂的抗病毒作用机理和为临床合理用药提供实验依据, 采用水萃取法制备抗病毒中药复方浸膏制剂, 将实验动物随机分为阴性对照组、阳性对照组、低剂量中药组、中剂量中药组和高剂量中药组, 在免疫接种NDV-Lasota株灭活疫苗的基础之上, 以IFN-γ(干扰素γ)为检测指标, 研究中药复方制剂对雏鸡血清IFN-γ水平的影响. 实验结果表明:抗病毒中药复方制剂具有诱导实验雏鸡在免疫应答过程中IFN-γ产生的作用, 诱导作用可能与中药剂量及机体的免疫状态有关.
抗病毒中药复方制剂; 雏鸡; IFN-γ(干扰素γ)
本研究在中医药理论指导下, 根据病毒性疾病的治疗原则, 以“祛邪”药白花蛇舌草、金银花和“扶正”药黄芪、甘草等组成抗病毒中药复方制剂, 在兽医临床上针对自然发病的鸡新城疫(ND)、鸡传染性法氏囊病(IBD)、鸭病毒性肝炎(DH)、禽流感(AI, H9)、禽肿头综合征等疾病的治疗取得良好效果的基础之上(刘群等, 2011), 为了探讨其抗病毒作用机理和扩大临床应用范围, 在14日龄雏鸡接种NDV-Lasota株灭活疫苗的基础之上, 连续给予不同剂量的该中药复方制剂, 观察其对雏鸡血清IFN-γ水平的影响,现将研究结果报告如下.
1 材料及方法
1.1 材料
1.1.1 疫苗
NDV油乳剂灭活疫苗, 由华南农业大学生物药品有限公司提供(NDV-Lasota株, 批号:2012001, 生产日期:20120101).
1.1.2 实验动物
14日龄青脚麻羽雏鸡, 由成都农业科技职业学院提供.
1.1.3 受试药物
抗病毒中药复方制剂由白花蛇舌草、金银花、黄芪、甘草等中药组成. 中药饮片购于四川省成都市北京同仁堂, 由四川省兽药监察所鉴定.
1.1.4 主要试剂和仪器
鸡IFN-γELISA试剂盒(北京雅安达生物技术有限公司, 201202); 超速离心机(德国, Eppendorf); Synergy HT多功能酶标仪(美国, BioTek)等.
1.2 方法
1.2.1 抗病毒中药复方制剂的制备
将中药饮片混合, 参照《中药复方总化学成分(浸膏)提取工艺研究》(江平康等, 2011)制备中药复方浸膏:浸泡0.5小时、12倍加水量、煎煮3次、煎煮时间1小时, 水提浸膏收率为57.8%, 换算成生药含量并分别制成
2g/ml、1g/ml、0.5g/ml浓度的口服液, 4℃冰箱保存.
1.2.2 实验动物分组及处理
14日龄青脚麻羽雏鸡150只, 随机分成5组, 每组30只. 各组处理如下:
阴性对照组:按0.5ml/只颈部皮下注射灭菌生理盐水, 常规饲喂.
阳性对照组:按0.5ml/只颈部皮下注射NDV油乳剂灭活疫苗, 常规饲喂.
高剂量中药组:按0.5ml/只颈部皮下注射NDV油乳剂灭活疫苗, 同时按4g(生药)/kg(体重)/天拌料口服中药复方口服液, 连续服用5天.
中剂量中药组:按0.5ml/只颈部皮下注射NDV油乳剂灭活疫苗, 同时按2g(生药)/kg(体重)/天拌料口服中药复方口服液, 连续服用5天.
低剂量中药组:按0.5ml/只颈部皮下注射NDV油乳剂灭活疫苗, 同时按1g(生药)/kg(体重)/天拌料口服中药复方口服液, 连续服用5天.
1.2.3 IFN-γ含量的测定
实验动物在分组处理前随机抽取5只雏鸡, 翅静脉采血1.5ml; 疫苗接种及处理后的第7、14、21、28d, 即21、28、35、42日龄, 每组随机抽取5只雏鸡, 翅静脉采血1.5ml, 待血液室温自然凝固10~20min后, 2000~3000rpm离心20min, 收集血清, 供IFN-γ的测定.
按照鸡IFN-γELISA试剂盒操作规程测定雏鸡血清IFN-γ的含量.
1.2.4 实验数据处理
实验数据以折线图、均数与标准差(±S)表示, 应用SPSS18.0统计分析软件对各组按不同检测点进行组内和组间比较分析.
2 结果与分析
2.1 鸡IFN-γ标准品结果
鸡IFN-γ标准品结果见表1, 图1

表1 鸡IFN-γ标准品吸光值(450nm)Table 1 Absorbance of Chicken IFN-γ standard product(450nm)
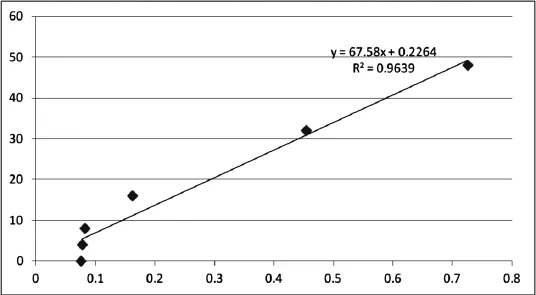
图1 鸡干扰素γ标准曲线Fig. 1 Chicken IFN-γ standard curve
标准曲线是以标准品浓度由低到高、从左至右作为横坐标X轴, 450nm下读取的各检测孔O.D值作为纵坐标Y轴, 在Logit-Log直线回归模式下绘制的曲线. 该实验标准品相关系数(R2)为0.9639, 已达到实验要求(>0.92)水平, 表明标准曲线方程可用.
2.2 各组实验动物组内IFN-γ水平的变化情况
各组实验动物组内IFN-γ水平的动态变化情况见表2
表2 各组实验动物组内IFN-γ水平的动态变化值(ng/L,±S, n﹦5)Table 2 Dynamic change value of IFN-γ in each group(ng/L ,±S, n﹦5)

表2 各组实验动物组内IFN-γ水平的动态变化值(ng/L,±S, n﹦5)Table 2 Dynamic change value of IFN-γ in each group(ng/L ,±S, n﹦5)
注:同行右肩有相同小写字母的数据表示无显著差异, P>0.05; 无相同小写字母有相同大写字母的数据表示有显著差异, P0<.05; 完全无相同字母的数据表示有极显著差异, P<0.01.Note:The dates with different lowercases within a row means significant difference(P<0.05); and without the same lowercase but with the same uppercases mean no significant difference(P>0.05); Completely without the same letter means most significant difference(P<0.01).
分组日龄14 21 28 35 42阴性对照组 20.9874±1.5487aA24.4131±1.2259bB40.1352±0.4868dD29.8797±2.0611cC27.5567±2.0047cC阳性对照组 20.9874±1.5487aA26.3543±1.6450bB46.4017±5.2315dD31.8123±1.4057cC29.4534±1.1000bcBC高剂量中药组 20.9874±1.5487aA24.4868±0.7527aA50.0835±3.5838dD30.3891±4.3265bB37.7183±3.2267cC中剂量中药组 20.9874±1.5487aA24.4500±1.0304bB44.0628±1.0181dD27.7289±1.8439cC27.6773±1.9194cC低剂量中药组 20.9874±1.5487aA26.2549±0.7086bB46.9905±3.2642dC28.0362±5.0479cB30.9365±1.0523cB
表2表明:除高剂量中药组外, 其它各组在免疫接种后第7d, 血清IFN-γ含量开始上升, 并在免疫接种后14d达到最大值, 与实验前比较差异极显著(P<0.01), 之后虽略有下降, 但仍高于实验前(P<0.01)水平; 高剂量中药组在免疫接种后第7d, 血清IFN-γ含量虽有所上升, 但差异不显著(P>0.05), 同样在疫苗接种后的14d达到最大值, 之后略有下降, 但仍高于实验前, 差异极显著(P<0.01). 实验表明:各组动物血清IFN-γ含量变化规律相似, 均在免疫接种后14d达到高峰, 之后略有下降, 但都高于实验前水平; 高剂量中药组虽然可能具有延缓机体IFN-γ产生的作用, 但具有使血清IFN-γ含量维持在一个较高的水平上的作用.
2.3 各组实验动物组间IFN-γ水平的变化情况
各组实验动物组间IFN-γ水平的动态变化情况见表3
表3 各组实验动物组间IFN-γ水平的动态变化值(ng/L,±S, n﹦5)Table 3 Dynamic change value of IFN-γ with each group(ng/L ,±S, n﹦5)

表3 各组实验动物组间IFN-γ水平的动态变化值(ng/L,±S, n﹦5)Table 3 Dynamic change value of IFN-γ with each group(ng/L ,±S, n﹦5)
注:同行右肩有相同小写字母的数据表示无显著差异, P>0.05; 无相同小写字母有相同大写字母的数据表示有显著差异, P0<.05; 完全无相同字母的数据表示有极显著差异, P<0.01.Note:The dates with different lowercases within a row means significant difference(P<0.05); and without the same lowercase but with the same uppercases mean no significant difference(P>0.05); Completely without the same letter means most significant difference(P<0.01).
分组日龄21 28 35 42阴性对照组 24.4131±1.2259a40.1352±0.4868aA29.8797±2.0611 27.5567±2.0047aA阳性对照组 26.3543±1.6450b46.4017±5.2315bcB31.8123±1.4057 29.4534±1.1000abA高剂量中药组 24.4868±0.7527a50.0835±3.5838cB30.3891±4.3265 37.7183±3.2267cB中剂量中药组 24.4500±1.0304a44.0628±1.0181abAB27.7289±1.8439 27.6773±1.9194aA低剂量中药组 26.2549±0.7086b46.9905±3.2642bcB28.0362±5.0479 30.9365±1.0523bA
表3表明:免疫接种后第7d, 阳性对照组和低剂量中药组血清IFN-γ含量显著高于其它各组(P<0.05); 免疫接种后第14d, 除中剂量中药组外, 其它各组IFN-γ均高于阴性对照组, 差异极显著(P<0.01), 同时高剂量中药组IFN-γ显著高于低剂量中药组和阳性对照组(P<0.05); 免疫接种后第21d, 所有各组之间IFN-γ差异不显著
(P>0.05); 免疫接种后第28d, 高剂量中药组IFN-γ高于其它各组, 差异极显著(P<0.01), 阴性对照组、阳性对照组、中剂量中药组之间没有显著差异(P>0.05), 低剂量中药组IFN-γ高于阴性对照组和中剂量中药组(P<0.05),但与阳性对照组无显著差异. 实验表明:高剂量中药组在连续给药5d后, 具有诱导机体IFN-γ产生的作用, 在免疫接种后的14d达到最高峰, 均高于其它中药组和阳性对照组, 之后虽略有下降, 但仍然高于其它中药组和阳性对照组(P<0.05).
综合以上分析, 结合各组实验动物IFN-γ水平变化折线图2, 实验结果表明:高剂量中药组在连续给药5d后, 能够促进实验雏鸡在接种新城疫灭活疫苗后7-14d的血清IFN-γ水平升高, 免疫14d后达到最高的50.0835ng/L, 以后虽有所下降, 但在免疫接种后的28d(37.7183ng/L)仍然高于(P<0.05)阳性对照组(29.4534 ng/L)和中剂量中药组(27.6773 ng/L)及低剂量中药组(30.9365 ng/L )的IFN-γ水平. 表明抗病毒中药复方制剂具有诱导实验雏鸡在免疫应答过程中IFN-γ产生的作用, 诱导作用可能与中药剂量有关.
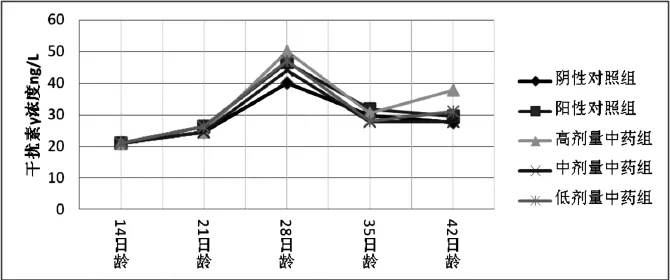
图2 各组实验动物鸡IFN-γ水平的动态变化折线图Fig. 2 The line graph of dynamic Change of Chicken IFN-γ with each group
3 讨论与结论
本研究采用纯化的鸡IFN-γ抗原包被微孔板制成固相抗原, 依次与IFN-γ和与HRP标记的鸡IFN-γ抗原结合, 形成抗原-抗体-酶标抗原复合物, 加底物TMB显色, 颜色的深浅与样本中IFN-γ呈正相关, 通过标准曲线计算出样品中IFN-γ的浓度(ng/L). 在生理情况下由于IFN基因处于被抑制的静止状态, 细胞不会自发产生, 但是在病毒、植物血凝素等有丝分裂原或特异性抗原诱发剂存在的情况下, 能摆脱抑制而获得表达; IFN-γ是由活化的Th1、CD8+CTL、NK细胞产生, 具有活化巨噬细胞、促进APC(S)表达MHC-Ⅱ类分子表达以提高抗原递呈功能、促进MHC-Ⅰ类分子表达以增强CTL细胞的杀伤活性、增强NK细胞的杀伤活性、促进B细胞分化增殖、抑制TH2细胞分化及细胞因子合成等, 是目前机体发挥抗病毒作用最快的第一病毒防御体系.
有研究表明(段亮亮, 刘群, 江平康等, 2010):以白花蛇舌草、金银花、黄芪、甘草等组成的抗病毒中药复方制剂在鸡胚内和成纤维细胞上具有抗鸡新城疫病毒的作用和增强小鼠腹腔巨噬细胞的吞噬功能和兔IFN-γ产生的作用. 对雏鸡血清IFN-γ含量的实验研究表明:高剂量中药组(4g/kg/d)在连续给药5d后, 能够促进实验雏鸡在接种新城疫灭活疫苗后7-14d的血清IFN-γ水平升高, 免疫14d后达到最高的50.0835ng/L, 之后虽有所下降, 但在免疫接种后的28d仍然高于(P<0.05)阳性对照组(29.4534 ng/L)和中剂量中药组(27.6773 ng/L)及低剂量中药组(30.9365 ng/L )的IFN-γ水平, 表明中药复方制剂具有诱导实验雏鸡在免疫应答过程中IFN-γ产生的作用, 从而增强机体的免疫能力, 诱导作用可能与中药剂量及机体的免疫状态有关. IFN-γ不仅具有增强机体的免疫功能, 而且能诱导宿主细胞合成抗病毒蛋白以降解病毒mRNA、抑制病毒蛋白合成、组装和释放, 从而中断病毒感染、限制病毒扩散, 体现了中兽医“扶正可以祛邪”、“祛邪可以扶正”、“扶正祛邪兼施”的治疗原则, 为扩
大该中药复方制剂的临床应用范围和探讨中药抗病毒作用机理提供了实验依据.
[1] 刘群, 朱子凤, 周李, 等. 中药复方对家禽病毒性疾病的治疗效果[J]. 安徽农业科学, 2011, 39(6): 3630-3632.
[2] 江平康, 刘群, 杨松沛, 等. 中药复方总化学成分(浸膏)提取工艺研究[J]. 中国畜牧兽医, 2011, 38(7): 242-245.
[3] 段亮亮, 刘群, 江平康. 中药复方在鸡胚水平上抗鸡新城疫病毒的作用研究[J]. 中国畜牧兽医, 2010, 37(4): 192-194.
[4] 刘群, 段亮亮, 江平康. 中药复方抗鸡新城疫病毒作用研究[J]. 安徽农业科学, 2010, 38(20): 10697-10699, 10724.
[5] 江平康, 刘群, 周李. 中药复方“病毒克”对小鼠腹腔巨噬细胞吞噬功能的影响[J]. 西南民族大学学报: 自然科学版, 2011, 37(5): 761-764.
[6] 江平康, 谢嘉宾, 刘群, 等. 抗病毒中药复方对兔HCLV模型IFN-γ影响的研究[J]. 黑龙江畜牧兽医, 2012, 11(21): 118-120.
Research on the effect of the Chinese antiviral herbal compound on IFN-γ level of the chicks
WANG Sai, ZHOU Li, LIU Qun, KANG Lian-lian, YANG Rong
(School of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
This study is to discuss the mechanism of antiviral effect of the Chinese herbal compound, which would provide some
for its safe and logical clinical medication. The water extraction method is adopted to produce Chinese herbal compound extractum, and different doses of extractum are mixed with fodder to feed the chicks. All the experimental animals are divided into five groups: positive control group, low dose group, midst dose group, high dose group, and negative control group. After they are immunized with inactivated vaccine of NDV-Lasota, IFN-γ is taken as the testing index to study the effect of the Chinese herbal compound on the chicken serous IFN-γ. The results show that Chinese herbal compound could induce the production of INF-γ in the progress of the immune response, while this effect could be closely related to drug dosage and immune state.
Chinese antiviral herbal compound; chick; INF-γ
S853
A
1003-4271(2014)01-0027-05
10.3969/j.issn.1003-4271.2014.01.06
2013-09-21
刘群(1965-), 男, 博士, 副教授; Email:liuqun2567@qq.com.
国家“十二五”科技支撑计划项目(2011BAD34B02-4); 中央高校基本科研业务费科研建设平台(11NPT03)

