利用双向电泳-质谱技术鉴定牦牛和犏牛睾丸中的差异表达蛋白质
付伟, 李彩霞, 刘文静, 马晓琴, 任亮, 黄林, 金素钰, 郑玉才
(1. 西南民族大学生命科学与技术学院, 成都 610041; 2. 西南科技大学生命科学与工程学院, 绵阳 621010)
利用双向电泳-质谱技术鉴定牦牛和犏牛睾丸中的差异表达蛋白质
付伟1, 李彩霞1, 刘文静2, 马晓琴1, 任亮1, 黄林1, 金素钰1, 郑玉才1
(1. 西南民族大学生命科学与技术学院, 成都 610041; 2. 西南科技大学生命科学与工程学院, 绵阳 621010)
比较了牦牛和犏牛睾丸组织中蛋白质的表达差异; 应用双向电泳-质谱技术, 对牦牛和犏牛的睾丸组织中差异蛋白质进行分离和鉴定; 对获得的22个差异表达点进行质谱鉴定和数据库搜索, 获得了19个蛋白质, 其中有3种分子伴侣可能与犏牛雄性不育有关; 研究结果表明, 牦牛和犏牛睾丸组织中存在差异表达蛋白, 并可利用双向凝胶电泳进行分离, 为进一步分析犏牛雄性不育的原因提供了线索.
牦牛; 犏牛; 睾丸; 双向电泳; 质谱
牦牛主要分布于我国青藏高原地区, 对恶劣环境有极强的适应能力, 是青藏高原地区牧民的主要生活和生产资料. 将普通牛同牦牛杂交, 其后代犏牛具有生长速度快、产肉产奶量高等特点. 然而, 由于物种间存在生殖隔离, 使得犏牛具有雄性不育的特点, 这极大阻碍了犏牛优良性状的横向遗传和保留. 为解决这一难题, 国内外牦牛研究者经过大量科学研究, 不断探索解决犏牛雄性不育的方法, 并已取得一定成果.
已有的研究主要涉及对犏牛的精子发生水平、生殖器官解剖和生殖内分泌、生化遗传学等方面研究[1]. 但迄今为止, 有关犏牛雄性不育的机制仍不清楚. 胡欧明等[2]对精子的发生进行了研究, 发现犏牛精子发生存在各个时期的生殖细胞, 但从精母细胞细胞开始以后逐级受阻; Huang等[3]通过对牦牛及犏牛的乳酸脱氢酶C基因选择性剪切变异体的定量分析发现, 选择性剪切在调控该基因在睾丸组织中的表达可能有一定影响, 可能与犏牛雄性不育有关. 对SYCP3、Dmc1等基因的分析发现, 犏牛与其他牛相比, 在转录、表达、修饰等环节存在一些差异, 可能与犏牛雄性不育有关[4-7]. 然而, 有关犏牛雄性不育的因果关系仍不清楚, 尤其缺乏蛋白质水平的证据.目前, 蛋白质组学已经应用于植物雄性不育及医学、农学等领域[8]. 本研究采用蛋白质组学方法, 分析牦牛和犏牛睾丸组织中蛋白质的表达差异, 探索犏牛雄性不育的可能机制. 将蛋白质组学应用于犏牛雄性不育的研究尚未见报道.
1 材料与方法
1.1 样品采集
麦洼牦牛(Bos grunnies)和犏牛睾丸组织均采自成都市青白江一屠宰场. 选取健康的成年公牦牛(n=4)和公犏牛(n=2), 屠宰后立刻取其睾丸, 纵切面剖开后用干冰带回实验室, -80℃保存至分析.
1.2 主要试剂和仪器
固相pH梯度胶条(IPG strips, pH3~10, 非线性)、Bio-Lyte 3/10、丙磺酸(CHAPS)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、十二烷基硫酸钠(SDS)、尿素均购自美国Bio-Rad公司; 苯甲基磺酰氟(PMSF)购自美国Amresco公
司; 硫脲购自Solarbio公司.
Protean IEF cell 等电聚焦系统、Protean II xi cell 垂直电泳槽、Versa Doc 1000凝胶成像系统及PDQuest Version 7.0.1软件均为Bio-Rad公司产品; Biowave紫外可见分光光度计为英国Biochrom公司产品; CR21G高速冷冻离心机为日本日立公司产品; 超声波破碎仪为美国Sonics公司产品.
1.3 睾丸组织总蛋白提取
从-80℃冰箱取出睾丸组织于冰上解冻, 分别称取牦牛(n=4)和犏牛(n=2)睾丸各0.4 g, 分别加入5倍体积的样品裂解液(7 mol/L尿素, 2 mol/L硫脲, 4%CHAPS, 65 mM DTT, 0.2% Bio-lyte, 1 mM PMSF), 用电动匀浆器在冰上匀浆, 并在冰浴下超声破碎2 min, 然后4℃静臵1 h; 裂解后的蛋白提取液在4℃下15000 g离心30 min, 取上清液分装.
为去除蛋白溶液中的盐类, 向上述上清液中加入4倍体积的预冷丙酮(含0.07%的β-巯基乙醇), 振荡混匀, -20℃沉淀过夜, 然后15000 g于4℃离心30 min, 弃上清液, 加冷丙酮洗涤后同上离心10 min, 弃上清液, 室温下干燥1 h. 向管中加入适量样品裂解液溶解沉淀蛋白质并分装, 用改良的Bradford法测定蛋白浓度. 样品-80℃保存备用.
1.4 睾丸组织蛋白的双向电泳
等电聚焦采用固相pH梯度胶条, 每根胶条蛋白上样1500 μg, 蛋白液和水化液共300 μl(7 mol/L尿素, 2 mol/L硫脲, 4%CHAPS, 65 mM DTT, 0.2% Bio-lyte, 0.001%溴酚蓝), 采用胶条20℃主动泡胀14 h的方法上样. 聚焦条件:恒温20℃下, 250 V 3 h(慢), 500 V 1 h(慢), 1000 V 1 h(慢), 5000 V 3 h(快), 10000 V 60 kVh.
随着社会的发展与进步,证据的种类也在不断发生变化,以往闻所未闻的电子邮件、短信、微信等,在信息化时代,经过必要的手续或程序后,也已跻身证据“家族”,发挥着重要的作用。不过,由于法律最终调整的是人与人之间的关系,所以无论时势如何变迁,相关的证人证言对于几乎所有的案件来说,都是必不可少的,证人出庭作证就成为庭审中一个重要的环节。只有在对质、质证过程中,才能揭示和发现案件的真相,特别是当一个人的证言对他人的定罪量刑起着关键作用的时候,更应该在法庭上“当面锣、对面鼓”地碰撞一番,证言的真伪才能得到有效地鉴别。在港剧、美剧或英剧中,控辩双方对证人的“交叉询问”,往往会成为最精彩的片段。
等电聚焦结束后, 胶条进行两次平衡, 平衡缓冲液Ⅰ: 6 M 尿素, 2% SDS, 0.375 M pH8.8 Tris-HCl, 20%甘油, 2% DTT; 平衡缓冲液Ⅱ: 6 M 尿素, 2% SDS, 0.375 M Tris-HCl, pH8.8, 20%甘油, 2.5%碘乙酰胺, 每次平衡15 min.然后用分离胶浓度为13%的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离. 电泳开始16 mA/胶条电泳30 min, 然后恒压200 V电泳直至溴酚蓝指示剂距凝胶底部约1.0 cm处停止电泳. 用0.1%的考马斯亮蓝R-250染凝胶50 min,脱色后保存于7%的冰乙酸中.
1.5 凝胶图像分析及蛋白质斑点鉴定
利用凝胶成像系统获取凝胶图谱. 用PDQuest图像分析软件分析凝胶蛋白质点, 包括蛋白质点的检测、背景消减、匹配、点的强度比较等. 将3次重复试验均有差异的蛋白点用灭菌枪头挖出, 送深圳华大基因进行串联质谱鉴定.
2 结果
2.1 牦牛和犏牛睾丸总蛋白双向电泳分析
利用双向电泳对牦牛和犏牛睾丸组织提取的总蛋白进行分离, 获得了分辨率和重复性较好的电泳图谱(图1).经PDQust凝胶分析软件分析蛋白点差异, 牦牛和犏牛睾丸组织蛋白中分别有970±13个和959±16个点得到分离.在相同实验体系下重复实验3次获得的凝胶图谱经软件对其进行背景消减后, 选取分离效果较好, 染色均匀, 拖尾较少, 斑点较多的蛋白质图谱作为参考胶, 对3次重复性实验凝胶的蛋白点进行匹配, 牦牛匹配点为837±12个,犏牛匹配点为805±14个, 匹配率分别为86%和84%. 随机选择3张凝胶图谱, 选择其上已匹配的50个蛋白点, 对凝胶在IEF方向和SDS-PAGE方向上偏差进行检验, 结果发现同一样本3块凝胶蛋白质点在位臵上有较好的重复性.
分析各种蛋白在牦牛和犏牛睾丸组织中的表达差异, 选取分别在3次重复试验中均有2倍及以上差异的点作为差异点, 结果共检测到20个差异表达的蛋白点, 鉴定得到了相应的17种蛋白质. 其中, 在牦牛睾丸组织表达量高于犏牛的点有13个, 分别为A2、A17、A29、A40、A23、A14、A27、A34、A26、A38、A16、A19、A33; 在犏牛睾丸组织表达量高于牦牛的点有4个, 分别为B22、B19、B2、B24. 另外, 实验还鉴定了在两种牛睾丸组织中表达相似的2个蛋白点, 分别为A11、A21.
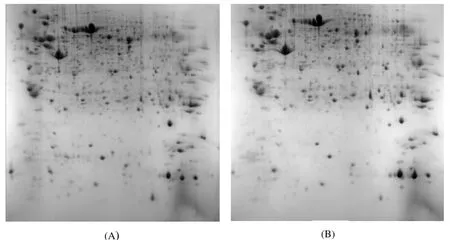
图1 牦牛(A)和犏牛(B)睾丸组织双向电泳图谱
2.2 牦牛和犏牛睾丸差异蛋白的鉴定
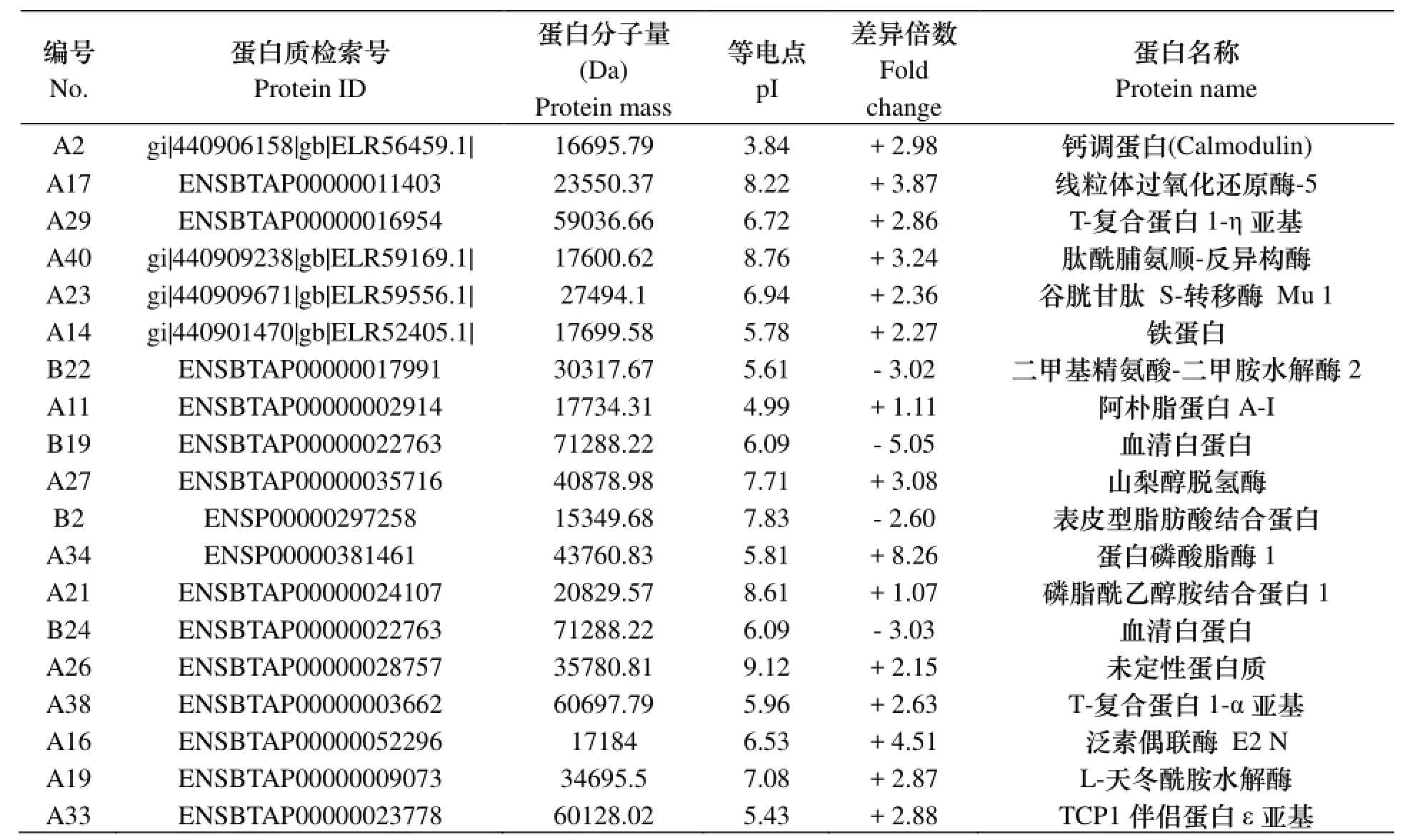
表1 牦牛和犏牛睾丸差异蛋白点的鉴定
3 讨论
蛋白质组学是后基因组时代的重要学科和研究手段. 利用双向电泳结合质谱鉴定的方法, 研究人员已经对睾丸组织蛋白质组进行了分析, 取得了十分有价值的资料[9-10]. 但对牦牛睾丸组织中蛋白质组学方面还未见研究报道. 本实验中分离并鉴定出了睾丸差异蛋白点19个, 其中在牦牛睾丸组织中高表达的蛋白点13个, 在犏牛睾丸组织中高表达的蛋白点4个, 在两种牛睾丸组织中表达量相当的蛋白点2个.
牦牛睾丸组织高表达的蛋白中, 钙调蛋白(CaM)是一类介导调节Ca2+信号传导途径的信号分子, 该蛋白通过与Ca2+结合形成Ca2+-CaM复合物的形式调控其他蛋白酶活性, 进而参与并调节细胞的增殖、生长、分化及细胞凋亡等代谢活动, CaM还有助于有丝分裂过程中纺锤体和纺锤丝以及胞质分裂的调节[11]; 线粒体过氧化还原酶-5即硫氧还蛋白还原酶(TrxR)有三种类型, TrxR1、TrxR2和TrxR3, 其中TrxR3特异性地存在于睾丸组织中,与雄性生育有关系[12]; L-天冬酰胺水解酶具有L-天冬酰胺酶和β-天冬氨酰肽酶活性, 在精子尾部中段表达, 可作为精子的自身抗原[13].
研究发现3种在牦牛睾丸中高表达的分子伴侣. T-复合蛋白1(TCP 1)是TCP 1分子伴侣家族的一员, 可调节精子和卵细胞的融合过程[14]; 肽酰脯氨顺-反异构酶D(PPI)是一种广泛存在于各种组织和器官的酶, 可催化肽酰脯氨基顺反异构化, 帮助寡肽及蛋白质折叠, 对蛋白的合成、运输、修饰及对变性蛋白的清除等也有促进作用[15];另外, PPI作为分子伴侣在热休克蛋白Hsp70、Hsp90特异性识别等方面有重要作用[16], 因而有保护机体免受伤害和促进细胞代谢的作用; 铁蛋白是生物体内储存铁的可溶性蛋白, 研究表明, 除了储存铁外, 铁蛋白还是一种组蛋白分子伴侣, 参与了受精时染色质的重建[17]; 上述3种蛋白均有分子伴侣活性, 且都在犏牛睾丸组织中表达偏低, 其表达量差异是否与犏牛雄性不育有关仍需进一步研究.
值得指出的是, 在牦牛中高表达的另外1种蛋白与精子成熟有关. 山梨醇脱氢酶(SDH1)是多元醇代谢通路的关键酶, 可将D-山梨醇氧化为D-果糖, 该通路作为能量来源, 在精子获能和精子生理机能调节等方面发挥着重要作用; 研究还发现该蛋白的分泌受雄性激素调节, 在附睾上皮细胞分泌的SDH1可从附睾液中运输蛋白到精子表面, 进而修饰精子并使之成熟[18]. 精子成熟和获能是卵细胞成功受精的基础, 上述蛋白在形成正常精子过程中占有缺一不可的地位, 其量在犏牛睾丸中非正常表达可能是导致犏牛雄性不育的原因之一.
犏牛睾丸组织高表达的蛋白点中, B19和B24均为血清白蛋白, Espinosa等[19]研究哺乳动物生精细胞时发现血清白蛋白和β-雌二醇可作为正负调控因子调节电压门控Ca2+通道, 但血清白蛋白过量表达是否对生精细胞有抑制作用还不得而知; 二甲基精氨酸-二甲胺水解酶(DDAH)在动物体内分为两种类型: DDAH1型和DDAH2型,其中DDAH2型广泛分布于睾丸和附睾中, 主要代谢非对称性二甲精氨酸(ADMA)[20], ADMA可抑制内皮型和神经型一氧化氮合酶(NOS), 而NOS是机体内催化一氧化氮(NO)生成最主要的酶, 它将L-精氨酸分解成NO和L-瓜氨酸[21]; NOS和NO参与了睾酮的分泌, 在生精过程、精子活力和活率、受精能力及精子脂质过氧化反应等过程中起着重要调节作用; Valenti等[22]在研究NO浓度对小鼠睾酮分泌量的影响时发现, 低浓度的NO可促进小鼠睾酮分泌, 而高浓度NO则相反; Rosselli等[23]同样提出过量的NO对精子有毒害作用, 影响其活力和活率, 增加不活动精子数量, 且精子受毒害程度与NO浓度成正比; 由此可见, 低浓度的NO对精子生成及成熟等有促进作用, 而随着浓度增加, 精子的活率反而下降, 可以推测犏牛睾丸组织中高表达的DDAH2将ADMA代谢之后,大量的NOS催化了NO的生成, 导致NO浓度过量, 严重影响了犏牛睾丸组织中精子发生、精子获能、受精能力等, 这极可能是犏牛雄性不育的原因之一.
在两种牛睾丸组织中表达量相当的蛋白质中, 阿朴脂蛋白A-I是精子激活蛋白复合物(SPAP)的组成元件, 和免疫球蛋白的轻链及重链一起构成了阿朴脂蛋白A-I-免疫球蛋白复合体, 该复合体可调节精子获能, 是成功受精的基础[24]; 同时, 阿朴脂蛋白A-I还特异性地与牛精清蛋白结合, 在调节精子生理活性等方面有特殊作用[25];磷脂酰乙醇胺结合蛋白1(PEBP1)是一类约23KDa大小, 结构高度保守, 生物学功能多样的碱性蛋白质; PEBP1存在于哺乳动物的睾丸和附睾内, 主要分布于精子的顶体、后顶体区和鞭毛等部位, 在精子形成过程中参与精子膜的构建; 作为去能因子受体, PEBP1与膜结合蛋白协同作用于精子头部和鞭毛的膜, 促进精子获能[26].
综上, 本实验利用双向电泳技术比较牦牛和犏牛睾丸组织中蛋白质表达差异, 获得了一批表达差异明显的蛋白质. 根据这些蛋白质的功能推测, 这些差异蛋白在牦牛生殖细胞发育与成熟等方面可能发挥重要作用.
[1] 张周平. 牦牛与黄牛远缘杂种雄性不育的研究现状及对策[J]. 黄牛杂志, 1996, 22(4): 11-14.
[2] HUANG L, JIN SY, XU YO, et al. Quantitation of alternative splicing variants of lactate dehydrogenase C gene in testes of adult yak, sexuallyimmature yak calf and sterile male hybrid of yak[J]. Can J Anim Sci, 2012, 92: 1-6.
[3] 胡欧明, 钟金城, 蔡立, 等. 犏牛精子水平的研究[J]. 西南民族学院学报: 自然科学版, 1999, 25(1): 80-83.
[4] BOUHALLIER F, ALLIOLI N, LAVIAL F, et al. Role of miR-34c microRNA in the late steps of spermatogenesis[J]. RNA , 2010, 16(4): 720-731.
[5] 屈旭光, 李齐发, 刘振山, 等. 牦牛、犏牛睾丸组织中SYCP 3基因mRNA表达水平研究[J]. 畜牧兽医学报, 2008, 39(8): 1132-1136.
[6] 李贤, 李齐发, 赵兴波, 等. 牦牛和犏牛Dmc1 基因序列分析及睾丸组织转录水平研究[J]. 中国农业科学, 2010, 43(15): 3221-3229.
[7] 周继平, 张周平, 胡勇, 等. 牦牛远缘杂交后代减数分裂与雄性不育关系的研究[J]. 黄牛杂志, 1999, 25(5): 12-15.
[8] 杨玉霞. 双向电泳技术在蛋白质组学研究中的应用进展[J]. 浙江农业科学, 2011(6): 1415-1416.
[9] 李飞, 皱亚光, 赵亮, 等. 成年无精子症男性睾丸活检组织双向电泳分析技术的初步建立及其优化[J]. 实用医学杂志, 2009, 25(24): 4139-4142.
[10] 于洁, 廖东江, 叶静, 等. 异体异位发育睾丸组织的蛋白质组图谱构建及差异蛋白分析[J]. 广东医学, 2009, 30(3): 357-361.
[11] TSANG WY, SPEKTOR A, LUCIANO DJ, et al. CP110 cooperates with two calcium-binding proteins to regulate cytokinesis and genome stability[J]. Mol Biol Cell, 2006, 17:3423-3434.
[12] MIRANDA-VIZUETE A, SADEK CM, JIMENEZ A, et al. The mammaliantestis-specific thioredoxin system[J]. Antioxid Redox Signal, 2004, 6: 25-40.
[13] BUSH LA, HERR JC, WOLKOWICZ M, et al. A novel asparaginase-like protein is a sperm autoantigen in rats[J]. Mol Reprod Dev, 2002, 62(2): 233-247.
[14] MATTHEW DD, NATHAN DS, MARK AB, et al. The chaperonin containing TCP1 complex (CCT/TRiC) is involved in mediating sperm-oocyte interaction[J]. J Biol Chem, 2011, 286(42): 36875-36887.
[15] LEVERSON JD, NESS SA. Point mutations in v-Myb disrupt a cyclophilin-catalyzed negative regulatory mechanism[J]. Mol Cell, 1998, 1: 203-211.
[16] PIRKL F, BUCHNER J. Functional analysis of the Hsp90-associated human peptidyl prolyl cis/trans isomerases FKBP51, FKBP52 and Cyp40[J]. J Mol Biol, 2001, 308(4): 795-806.
[17] 张云龙. 铁蛋白是一个组蛋白分子伴侣,参与了受精时精子染色质的重建[D]. 北京: 中国科学院研究生院, 2009.
[18] FRENETTE G, THABET M, SULLIVAN R. Polyol pathway in human epididymis and semen[J]. J Androl, 2006, 27: 233-239.
[19] ESPINOSA F, LÓPEZ-GONZÁLEZ I, MUÑOZ-GARAY C, et al. Dual regulation of the T-type Ca(2+) current by serum albumin and beta-estradiol in mammalian spermatogenic cells[J]. FEBS Letters, 2000, 475(3): 251-256.
[20] ACHAN V, BROADHEAD M, MALAKI M, et al. Asymmetric dimethylarginine causes hypertension and cardiac dysfunction in humans and is actively metabolized by dimethylarginine dimethylaminohydrolase[J]. Arterioacler Thromb Vaac Biol, 2003, 23(8): 1455-1459.
[21] LEIPER J, VALLANCE P. Biological significance of endogenous methylarginines that inhibit nitric oxide synthases[J]. Cardiovasc Res, 2003, 43(3): 542-548.
[22] VALENTI S, CUTTICAS CM, FAZZUOLI L, et al. Biphasic effect of nitric oxide on testosterone and cyclic GMP production by purified rat Leydig cells cultured in vitro[J]. Int J Androl, 1999, 22(5): 336-341.
[23] ROSSELLI M, DUBEY RK, IMTHUM B, et al. Effects of nitric oxide on human spermatozoa: evidence that nitric oxide decreases sperm motility and induces sperm toxicity[J]. Hum Reprod, 1995, 10(7): 1786-1790.
[24] AAKERLOEF E, JOERNVALL H, SLOTTE H, et al. Identification of apolipoprotein A1 and immunoglobulin as components of a serum complex that mediates activation of human sperm motility[J]. Biochemistry, 1991, 30: 8986-8990.
[25] MANJUNATH P, MARCEL YL, UMA J, et al. Apolipoprotein A-I binds to a family of bovine seminal plasma proteins[J]. J Biol Chem, 1989, 264: 16853-16857.
[26] GIBBONS R, ADEOYA-OSIGUWA SA, FRASER LR. A mouse sperm decapacitation factor receptor is phosphatidylethano lamine-binding protein 1[J]. Reproduction, 2005, 130(4): 497-508.
Identification of the differentially expressed testis proteins between yaks and cattle-yaks by two-dimensional electrophoresis combined with mass spectrometry
FU Wei1, LI Cai-xia1, LIU Wen-jing2, MA Xiao-qin1, REN Liang1, HUANG Lin1, JIN Su-yu1,
LIN Ya-qiu1, ZHENG Yu-cai1
(1. School of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.; 2. School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, P.R.C.)
The objective of this study is to analyze the differently expressed testis proteins between yaks and cattle-yaks. Two-dimensional electrophoresis is used to isolate the proteins, and the differential protein spots are identified by mass spectrometry. Twenty-two differential proteins are successfully identified by mass spectrometry, and the corresponding nineteen proteins, including three chaperons which may relate to the male sterility of cattle-yaks, are obtained successfully. The present results show that two-dimensional electrophoresis combined with mass spectrometry can be used to analyze the expression difference of proteins between yak and cattle-yak testes, helping to elucidate the molecular mechanism of infertility in male cattle-yaks.
yak; cattle-yak; testis; two-dimensional electrophoresis; mass spectrometry
S823, S852.23
A
1003-4271(2014)01-0011-05
10.3969/j.issn.1003-4271.2014.01.02
2013-10-16
郑玉才(1965-), 男, 教授, 博士, E-mail: yucaizheng65@hotmail.com.
国家自然科学基金资助课题(No. 31240053); 中央高校基本科研业务费资助课题(No. 12NZYTH06); 西南民族大学研究生创新型科研项目资助(No. CX2013SZ52).

