毛葱的镉吸收积累及亚细胞分布特征
邹金华,张忠贵,魏爱琪
(1.天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387;2.天津市市容环境宣传教育培训中心,天津300201)
近年来,随着工业“三废”和大量固液废弃物的处理不当,农业杀虫剂和肥料用量的增加[1],环境中重金属的含量大量增加[2].在农业生产上,镉(Cd)是环境中的主要重金属污染源,是生物毒性最强的重金属之一.Cd不是植物生长所必需的元素,具有很强的生理毒性,和其他重金属相比,Cd在土壤中的化学活性较强,更容易被植物根系吸收.这不仅会使农产品产量下降,还很容易被植物吸收而进入食物链,导致动植物的异常生理反应和遗传变异[3-4],甚至是猝死和细胞程序性死亡.Cd对植物的毒害作用,主要表现为根和叶长度的减小、叶片变黄、萎蔫[4]及生理生化指标的弱化等[5].植物在长期进化过程中,形成了自身的保护系统来对抗和适应镉胁迫[6-9].
毛葱(Allium cepa var.agrogarum)为百合科(Liliaceae)葱属(Allium)洋葱的变种,适应性强,是我国东北地区的名优特产.毛葱易培养,生根快,休眠期短,不受季节限制,是非常经典的抗逆研究材料.本文以毛葱为材料,利用营养液培养法和亚细胞组分差速分离技术,研究在不同浓度的Cd2+胁迫下,毛葱不同器官Cd吸收积累的特点、Cd吸收积累对几种矿质元素代谢的影响以及根、叶中Cd的亚细胞分布特点,探讨Cd胁迫对毛葱的毒害机理,为Cd污染的毒理学研究提供资料.
1 材料和方法
1.1 材料培养和Cd胁迫处理
选取长势相近的毛葱100个,平均分成4组,固定于带孔的泡沫板上,分别置于4个4L的培养盆中.室温20℃下于塑料盘中进行自来水培养,每24h更换1次水.培养1周后改用Hoagland全营养液进行培养,营养液配方为:Ca(NO3)2,5.78×10-3mg/L;KNO3,8.03×10-3mg/L;NH4H2PO4,1.34×10-3mg/L;MgSO4,4.18×10-3mg/L;MnSO4,8.91×10-6mg/L;H3BO3,4.84×10-5mg/L;ZnSO4,0.95×10-6mg/L;CuSO4,0.20×10-6mg/L;(NH4)2MoO4,0.015×10-6mg/L;Fe-EDTA,7.26×10-5mg/L.4组毛葱中,3组分别在Hoagland营养液中加入不同浓度的Cd2+,使其浓度分别为1、10、100μmol/L,胁迫12d;设1个对照组,仅用Hoagland营养液培养.
1.2 各部位Cd及Fe、Mn、Cu、Zn含量的测定
毛葱幼苗经Cd2+胁迫3、6、9、12d后,每组随机选取10株幼苗,进行根长和叶长的测定.幼苗经胁迫处理12d后,用去离子水冲洗,去掉表面的Cd2+和其他矿质离子,并将根、茎、叶分开,分别进行编号,放到干净的培养皿内.45℃下干燥3 d,80℃下干燥1d,105℃过夜,至样品恒重.用电动研磨机将样品研磨成粉末,装入小试剂瓶,密封.
称取0.25g干燥样品放入50mL烧杯中,加入浓硝酸和高氯酸,进行湿法消化[10].消化完全后向烧杯中加入10mL体积分数为10%的硝酸,转移至25mL容量瓶中,去离子水定容.样品溶液用电感耦合等离子体发射光谱仪(ICP-AES)进行Cd及Fe、Mn、Cu、Zn含量的测定.
1.3 各亚细胞组分分离、消化和Cd含量的测定
亚细胞组分中Cd的含量是指1g新鲜根或叶片细胞组织中Cd的质量.毛葱在Cd2+营养液中生长12d后,取叶片和根系,去离子水冲洗干净,然后用滤纸将叶和根表面的水分吸干.准确称取待测样品4g,加入20mL的组分提取液[蔗糖,0.25mol/L;Tris-HCl缓冲液(pH约7.5),50mmol/L;二硫赤藓糖醇,1mmol/L],在冰上充分研磨匀浆.匀浆后转移至离心管中,冷冻离心机4℃下离心:2000r/min离心10min,所得沉淀为细胞壁组分;上清液在4000r/min下离心15min,所得沉淀为细胞核和叶绿体组分;第2次离心后的上清液在10000r/min下离心20min,所得沉淀为线粒体组分,第3次离心后的上清液即为包含核糖体的可溶性组分.
将差速分级离心法分离出的不同细胞组分置于80℃的烘箱中烘干至恒重,然后转移至50mL的小烧杯中,分别加入浓HNO310mL和HClO41mL,盖上培养皿,放置在电热板上进行湿法消化[10].消化完全后转移到10mL的容量瓶中,去离子水定容,振荡摇匀,得待测含Cd的溶液.
所有待测样品均用电感耦合等离子体发射光谱仪(ICP-AES)进行Cd含量的测定.
1.4 数据分析
用Excel 2003和Sigmaplot 9.0软件对实验数据进行分析.
2 结果与分析
2.1 营养液中Cd2+对毛葱幼苗叶片和根生长的影响
各处理组和对照组毛葱幼苗根和叶片的生长情况如图1所示.
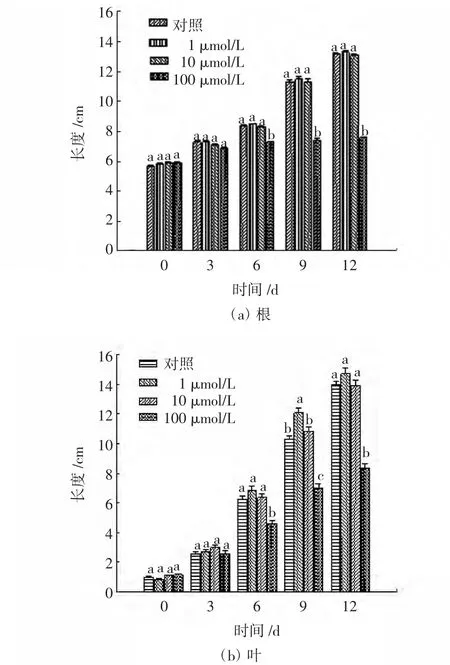
图1 不同浓度Cd2+对毛葱叶长和根长的影响Fig.1 Effects of different concentrations of Cd2+on root length and leaf length of Allium cepa var.agrogarum
整个实验过程中,对照组毛葱的根系发达,长势良好,为乳白色,有一定光泽,而且有侧根不断生长.1μmol/L Cd2+处理组的毛葱长势略好于对照组,差异不明显.10μmol/L Cd2+处理组的长势与对照组基本一致,植株上部生长良好,但根呈现淡黄色.100μmol/L Cd2+处理组的毛葱根系稀少,呈黄色,根脆且易断,后期根有腐烂现象,无侧根生长.由图1(a)可知,对照组、1μmol/L Cd2+处理组和 10μmol/L Cd2+处理组的根系生长幅度较大,长势良好,尤其在6~9d根长显著增加;100μmol/L Cd2+处理组则对根系有较强抑制作用,根系生长缓慢,后期甚至发生腐烂.
实验过程中对照组叶片呈油绿色,生长旺盛.1μmol/L Cd2+处理组比对照组长势好.10μmol/L Cd2+处理组与对照组的长势基本一致,但叶片颜色较浅.100μmol/L Cd2+处理组叶片较短,呈黄色,后期叶片有萎蔫干枯现象.由图1(b)可知,对照组、1μmol/L Cd2+处理组、10μmol/L Cd2+处理组的叶片生长幅度较大,尤其在6~9d显著增加,1μmol/L Cd2+处理对毛葱叶片生长有轻微促进作用,100μmol/L Cd2+处理组的叶片生长则受到较强的抑制作用,6d后叶片长度显著低于其他组叶片的长度.
2.2 营养液中Cd2+对毛葱幼苗各器官金属元素含量的影响
不同浓度的Cd2+胁迫12d后,毛葱根、茎、叶中Cd、Fe、Mn、Cu、Zn的含量如表1所示.
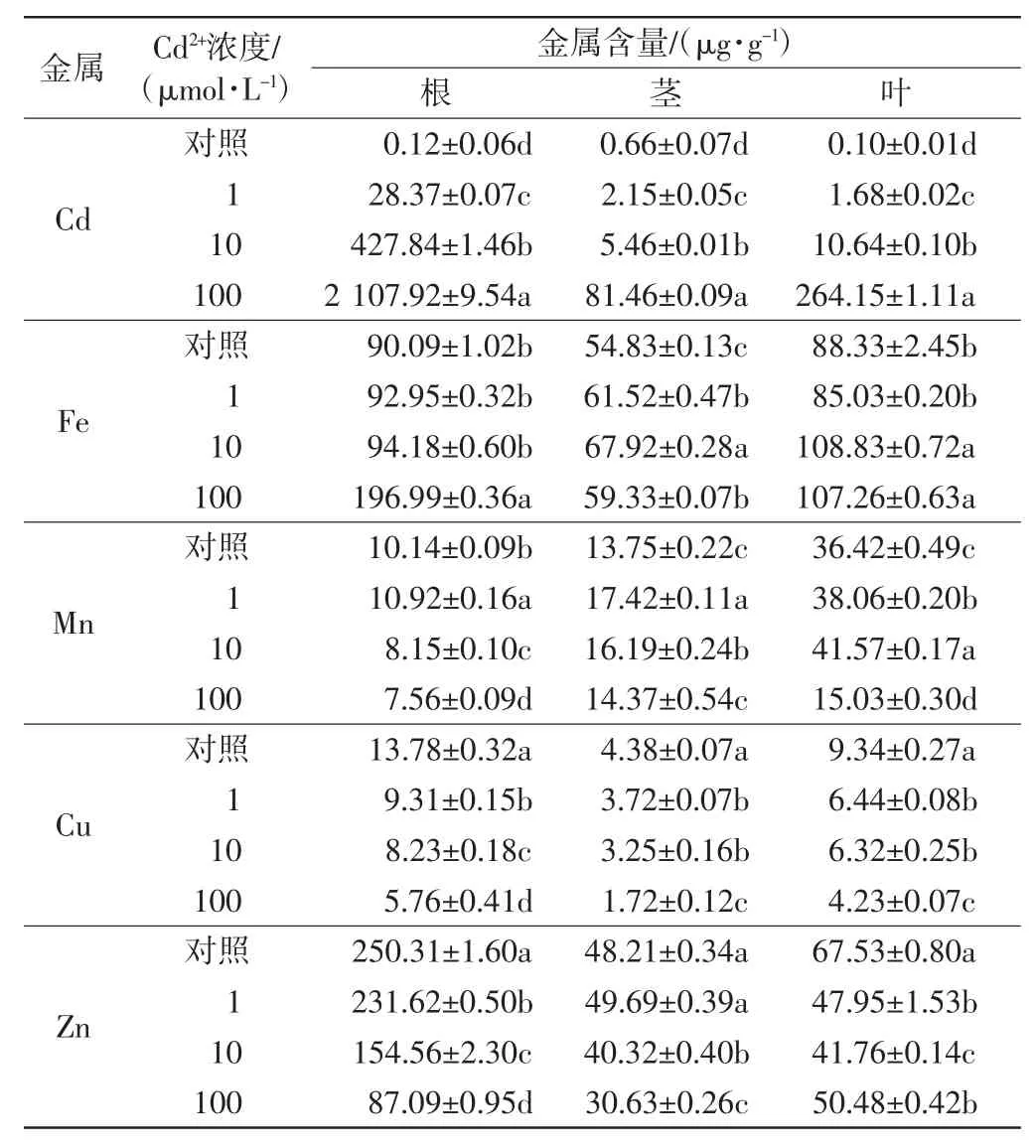
表1 不同浓度Cd2+胁迫后毛葱不同部位几种金属元素的含量Tab.1 Several minerals contents in different parts of Allium cepa var.agrogarum after treatments with different concentrations of Cd2+
由表1可知,对照组毛葱幼苗的根、茎、叶中Cd含量极低.3个处理组中根、茎、叶中Cd的含量均远远高于对照组,且同一部位Cd含量随营养液中Cd2+浓度的提高而大幅增加,尤其是Cd2+浓度达到100μmol/L时,3个部位中Cd的含量均呈几何级数增加.比较毛葱幼苗不同部位,除了对照组幼苗的茎中Cd含量高于根部外,3个处理组中,根中的Cd含量均远高于茎、叶中的,相差10倍以上;其次是叶片;茎中Cd含量最低.这些表明,毛葱根系从溶液中吸收的Cd主要积累在根部,向地上部转移的Cd量极低.
Cd2+胁迫总体上增加了毛葱幼苗各部位对Fe的吸收.根部Fe的含量随着Cd2+处理浓度的增大一直呈增加趋势;茎中3个处理组Fe的含量都高于对照组,但Cd2+处理浓度为100μmol/L时,茎中Fe的含量低于其他2个处理浓度;叶片中Fe的含量随着处理浓度的增加先降低,之后大幅增加,处理浓度为10μmol/L和100μmol/L时叶片中Fe的含量相近.部位之间进行比较,4组幼苗均是根中Fe的含量最大,茎中最低.Cd2+胁迫也影响了毛葱幼苗各部位对Mn的积累.总的来看,叶片中Mn含量最高,其次为茎,根中最少.与对照相比,低浓度Cd2+胁迫增加了毛葱各部位对Mn的积累,而高浓度则减少了各部位Mn的含量.不同浓度的Cd2+胁迫降低了毛葱根、茎、叶中Cu和Zn的含量,且营养液中Cd2+浓度越高,毛葱这2种金属的含量降低得越多.
2.3 Cd2+胁迫下毛葱幼苗根、叶中Cd的亚细胞分布
不同浓度的Cd2+胁迫下,毛葱幼苗根和叶片各亚细胞组分中Cd的含量如图2所示.
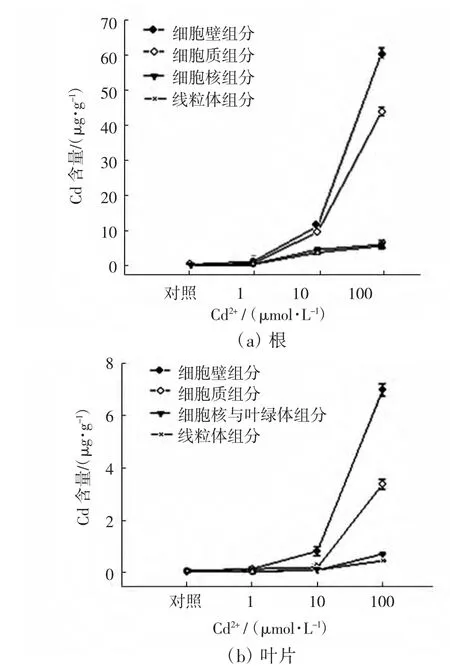
图2 不同浓度Cd2+处理对毛葱根、叶Cd亚细胞分布的影响Fig.2 Subcellular distribution of Cd in roots and leaves of Allium cepa var.agrogarum under the stress of different concentrations of Cd2+
由图2可以看出,在根和叶片的各亚细胞组分中,Cd含量均以细胞壁组分最高,可溶性细胞质组分次之,线粒体组分、细胞核与叶绿体组分的Cd含量相近,均低于细胞壁和细胞质组分中Cd的含量.随着Cd2+处理浓度的增加,各亚细胞组分中Cd含量均呈现上升趋势,尤其是Cd2+浓度由10μmol/L增加到100μmol/L时,细胞壁组分Cd含量的增加幅度最大,细胞质组分次之.
图3显示了不同的Cd2+处理浓度下,Cd在毛葱幼苗根和叶片各亚细胞组分中的分配比例.
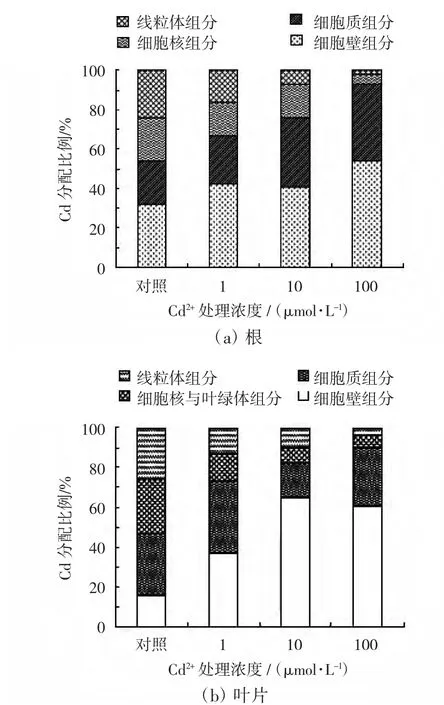
图3 毛葱根、叶各亚细胞组分Cd含量的分配比例Fig.3 Cd percentages in different subcellular fractions in roots and leaves of Allium cepa var.agrogarum
由图3(a)可以看出,随着营养液中Cd2+处理浓度的增加,Cd在根部的细胞壁和细胞质中的分配比例逐渐增加,在线粒体、细胞核中的分配比例下降.由图3(b)可以看出,随着营养液中Cd2+处理浓度的增加,Cd在叶片细胞壁中的分配比例先是大幅度增加,如当Cd2+浓度为10μmol/L时,Cd在细胞壁中的比例达到65%,随着Cd2+浓度进一步增加到100μmol/L时,Cd在细胞壁中的分配比例略有下降.Cd在细胞质中分配比例先是随着培养液中Cd2+浓度的增大而降低,在Cd2+浓度为10μmol/L时,分配比例仅为17%,但随着培养液中Cd2+浓度提高到100μmol/L,Cd在叶片细胞质中分配的比例又大幅度增加,达到29%.Cd在叶片线粒体、细胞核和叶绿体中的分配比例同在根中一样,也是随着培养液中Cd2+浓度的增大,分配比例逐渐下降.总体上,Cd在叶片各亚细胞组分中的分配比例与在根中相似,都是在细胞壁中的比例最大,其次是细胞质,在线粒体、细胞核及叶绿体中的Cd分配比例最小.
由以上结果可知,Cd在毛葱根和叶片亚细胞组分中的分配情况相似,根和叶片细胞吸收的Cd均主要分布在细胞壁组分和细胞质可溶性组分中,线粒体、叶绿体和细胞核组分中相对较少.与对照组相比,随着Cd2+处理浓度的增加,细胞壁组分和细胞质组分中Cd的分配比例呈明显上升趋势,而线粒体、叶绿体和细胞核组分中Cd的分配比例呈下降趋势.
3 讨论与结论
植物具有多种抗逆机制应对Cd的毒害,途径主要有2种:金属排斥和金属富集作用.当重金属进入植株后,起初富集在植物根部,随后逐渐被运送到叶片部分[10-11].对大蒜[10]、玉米[12]、向日葵[13]、杨树[14-15]中Cd分布的研究表明,Cd被植物根部吸收后,大部分保留在根系.本文对毛葱的研究结果也表明,当增加营养液中Cd2+浓度时,毛葱根系中Cd增加的幅度远远大于茎和叶,说明根部是Cd在毛葱植株内积累的主要部位,Cd向地上部分运输量很少.一方面是由于根系浸泡在营养液中,为Cd的直接接触部位,另一方面,重金属更多地积累在根部,降低了对地上部分的毒害作用,这也是植物对重金属胁迫的有效应对机制.
重金属对植物的毒害作用之一是干扰植物对养分的吸收,从而破坏植物体内养分平衡.多数学者认为,Cd2+作为一种重金属离子,或与植物必需营养元素竞争根部的吸收位点,进而影响植物对矿质元素的吸收;或通过影响细胞质膜透性来影响矿质元素的吸收,改变细胞内矿质元素的浓度和组成[16-19].本研究结果表明,毛葱Cd的吸收和积累改变了各器官中Fe、Mn、Cu、Zn等金属元素的含量,根中的变化最明显,可能是因为根部直接接触Cd2+,根部细胞质膜的选择透过性受到严重影响所致.
本研究中根和叶片各亚细胞组分中Cd含量的测定结果表明,根和叶片细胞吸收的Cd均主要分布在细胞壁组分和细胞质可溶性组分中,线粒体、细胞核及叶绿体组分中相对较少.植物细胞壁结构除了有机械保护作用外,还是重金属离子从细胞外进入到细胞内的第一道屏障,在植株对重金属离子的络合、螯合中起关键作用,从而可以防止更多的重金属离子通过细胞壁进入原生质体中[20-21].结合到细胞壁上的重金属由于已被螯合,因此对植物的生理生化活动没有毒性,这样便从源头上控制了超出植物耐受量的重金属的进入,使其毒害作用降到最小.当重金属离子在细胞壁上的含量达到所能承受的最大极限时,细胞质可溶性部分,尤其是细胞质中的金属硫蛋白、植物螯合肽等一些富含巯基的小分子,能够有效螯合进入细胞内的Cd,形成电子密度颗粒,然后以囊泡的方式对其进行包裹,小囊泡逐渐增多,将电子密度颗粒转移到液泡中,从而把金属离子进行液泡区室化而储存在液泡中.重金属经区隔化或与细胞内缓冲体系作用后,原生质中重金属的含量会大幅减少.本研究结果也表明,新陈代谢旺盛的细胞核、叶绿体和线粒体组分结合的Cd量较少,从而减少了Cd对细胞功能的影响.因此,细胞壁固持和液泡区室化可能在植物对重金属的解毒、耐性和超富集方面起着非常重要的作用[20-23].
本研究还发现,随着Cd2+处理浓度的增加,根和叶片细胞壁组分和细胞质组分中Cd的分配比例呈明显上升趋势,而线粒体、细胞核及叶绿体组分中Cd分配比例呈下降趋势.这表明,环境中Cd的含量越高,毛葱根和叶片中积累的Cd越多,其细胞壁组分和细胞质组分对Cd的固持和液泡区室化作用越强,降低了Cd对线粒体、细胞核、叶绿体等新陈代谢活跃部位的影响.低Cd2+浓度时,虽然细胞核和线粒体组分中Cd分配比例高,但由于Cd2+总浓度低,因此对细胞的代谢活动影响也较小,本实验室前期的研究结果[3-5]证明了这一点.
综上可知,毛葱吸收的Cd2+主要积累在根部,向地上部分转移很少,从而降低了Cd对地上部分的毒害作用,这是植物抵御Cd毒害的机理之一.从细胞水平来看,Cd主要分布在根、叶的细胞壁组分和细胞质可溶性组分中,而结合在细胞核、线粒体、叶绿体等新陈代谢活动旺盛的细胞器上的Cd相对较少,这样可以最大程度地减轻Cd对植物生理活动的影响.这些结果进一步证实细胞壁沉淀螯合和液泡区室化是植物抵抗重金属毒害的一种重要机制,对于提高植物的抗逆性尤其是抗重金属能力至关重要.
[1] 刘大林,胡楷崎,刘伟国,等.高粱属植物对土壤镉吸收及亚细胞的分配[J].生态学杂志,2011,30(6):1217-1221.
[2] 邵云,姜丽娜,李向力,等.五种重金属在小麦植株不同器官中的分布特征[J].生态环境,2005,14(2):204-207.
[3] 章爱秀,刘晓颖,彭永康,等.镉胁迫下萝卜根系蛋白质组的差异表达[J].天津师范大学学报:自然科学版,2013,33(1):67-73.
[4] ZOU J H,YUE J Y,ZHANG Z G,et al.Effects of cadmium stress on root tip cells and some physiological indexes in Allium cepa var.agrogarum L[J].Acta Biologica Cracoviensia Series Botanica,2012,54(1):129-141.
[5] 宇克莉,邹婧,邹金华.镉胁迫对玉米幼苗抗氧化酶系统及矿质元素吸收的影响[J].农业环境科学学报,2010,29(6):1050-1056.
[6] 张军,束文圣.植物对重金属镉的耐受机制[J].植物生理与分子生物学学报,2006,32(1):1-8.
[7] 王芳,丁杉,张春华.不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J].农业环境科学学报,2010,29(4):625-629.
[8] QIN R,JIANG W S,LIU D H.Aluminum can induce alterations in the cellular localization and expression of three major nucleolar proteins in root tip cells of Allium cepa var.agrogarum L[J].Chemosphere,2013,90(2):827-834.
[9] QIN R,JIANG W S,LIU D H.Cadmium can induce alterations in the cellular localization and expression of three major nucleolar proteins[J].Plant Soil,2013(368):365-373.
[10]LIU D H,ZOU J,MENG Q M,et al.Uptake and accumulation and oxidative stress in garlic(Allium sativum L.)under lead phytotoxicity[J].Ecotoxicology,2009(18):134-143.
[11]BAKER A J M.Metal tolerance[J].New Phytologist,1987,106(1):93-111.
[12]ZOU J H,YU K L,ZHANG Z G,et al.Antioxidant response system and chlorophyll fluorescence in chromium (VI)-treated Zea mays L.seedlings[J].Acta Biologica Cracoviensia Series Botanica,2009,51(1):23-33.
[13]ZOUJ,XU P,LU X,et al.Accumulation of cadmium in three sunflower(Helianthus annuus L.)cultivars[J].Pakistan Journal of Botany,2008,40(2):759-765.
[14]JIAO Y Q,GE W,QIN R,et al.Influence of cadmium stress on growth,ultrastructure and antioxidative enzymes in Populus 2025[J].Fresenius Environmental Bulletin,2012,21(6):1375-1384.
[15]JIAO Y Q,GE W,SUN B L,et al.Cadmium-mediated oxidative stress and ultrastructural changes in root cells of poplar cultivars[J].South African Journal of Botany,2012(83):98-108.
[16]郭智,黄苏珍,原海燕.Cd胁迫对马蔺和鸢尾幼苗生长、Cd积累及微量元素吸收的影响[J].生态环境,2008,17(2):651-656.
[17]郭智,原海燕,奥岩松.镉胁迫对龙葵幼苗光合特性和营养元素吸收的影响[J].生态环境学报,2009,18(3):824-829.
[18]李景梅,葛建镕,冯耀勇,等.不同镉水平对菠菜生长及营养元素含量的影响[J].长春理工大学学报:自然科学版,2007,30(4):72-75.
[19]王芳,杨勇,张燕,等.不同蔬菜对镉的吸收累积及亚细胞分布[J].农业环境科学学报,2009,28(1):44-48.
[20]蔡保松,张国平.大、小麦对镉的吸收运输及在籽粒中的积累[J].麦类作物学报,2002,22(3):82-86.
[21]LIU D H,KOTTKE I.Subcellular localization of cadmium in the root cellsofAlliumcepabyelectronenergylossspectroscopyandcytochemistry[J].Journal of Biosciences,2004,29(3):329-335.
[22]LIU D H,KOTTKE I,ADAM D.Localization of cadmium in the root cells of Allium cepa by energy dispersive X-ray analysis[J].Biologia Plantarum,2007,51(2):363-366.
[23]王宏镔,王焕校,文传浩,等.Cd处理下不同小麦品种几种解毒机制探讨[J].环境科学学报,2002,22(4):523-528.

