中国明对虾和中华绒螯蟹EST的Blast2GO注释及其在免疫基因分布研究中的应用
曾 铮,张亦陈,刘逸尘,郝 彤,孙金生,2
(1.天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387;2.天津市水生动物疫病预防控制中心,天津300221)
虾蟹是我国重要的水产养殖动物.近年来,随着市场需求的增加,虾蟹养殖规模持续扩大,产业化水平也逐年提高.长期以来,虾蟹养殖过程中由细菌、病毒等引起的病害十分严重,制约了虾蟹养殖业的进一步发展[1].目前,对虾蟹的免疫器官和免疫系统组分仍缺乏全面系统的了解,这也是虾蟹病害不能被有效预防和治疗的重要原因之一.
表达序列标签(EST)是从一个随机的cDNA克隆进行5’端和3’端单一测序获得的短cDNA部分序列,代表完整基因的一小部分,在数据库中其长度一般为20~7000bp,平均长度为400bp[2].1991年Adams等[3]首次应用EST技术研究人脑基因的表达状况,迄今为止,EST技术在了解生物的基因组成和环境胁迫特异性表达方面发挥了重要作用.近年来,虾蟹的EST序列测定工作取得很大进展,如凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeus mondon)、中国明对虾(Fenneropenaeus chinensis)、中华绒螯蟹(Eriocheir sinensis)、蓝蟹(Callinectes sapidus)等虾蟹的EST序列已被注册到NCBI的dbEST数据库中.这些已公布的虾蟹EST序列为我们进一步了解虾蟹基因在不同组织或细胞中的特异性表达和寻找免疫、繁殖、生长等基因提供了大量信息.
数据挖掘与系统分析是获得大量序列结果之后面临的主要问题.通过对海量数据的全面系统分析,找出目标序列,对开展深入研究至关重要.NCBI数据库通过综合不同实验室的实验检测结果,得到了大量中国明对虾和中华绒螯蟹的基因注释信息.本研究在此基础上,使用Blast2GO软件从已公布的中国明对虾和中华绒螯蟹EST序列中,筛选出尚未经实验证实的推测的免疫相关基因,并研究中华绒螯蟹免疫基因在不同细胞或组织中的分布情况.
1 材料和方法
1.1 EST序列的获得
中国明对虾和中华绒螯蟹的EST序列下载自GenBank的子库dbEST.其中,中国明对虾EST序列有10512条,中华绒螯蟹EST序列有17067条.
1.2 分析平台和相关软件
Blast2GO是一个基于java的集序列功能注释和注释数据分析为一体的工具,具有易操作、界面友好、高通量等特点[4].Perl程序Chimeric_Check.pl和PolyA_Check.pl来自文献[2],分别用来去除嵌合序列和检查polyA、polyT的序列条数.CAP3是序列拼接程序[5],由 http://seq.cs.iastate.edu/cap3.html下载得到.
1.3 对EST进行序列分析
下载得到的EST序列文件中包含在不同时间由不同实验室提交的同一物种的不同器官、组织或细胞的所有EST.本研究认为序列号连续并注释相同的EST为一批序列,使用程序提取出来供后续分析.在文库构建过程中可能会产生嵌合序列,中间有很长的polyA或载体序列[2],使用Chimeric_Check.pl将嵌合序列去除.此外,若EST序列两端存在poly A或者poly T,说明该序列表示的cDNA可能被完全测通,能够代表完整的mRNA信息[2].使用PolyA_Check.pl查找poly A和poly T的序列,并去除序列中的poly A和poly T.使用CAP3对序列进行聚类拼接,参数选择默认设置,得到的结果被视为Unigene.最后使用Blast2GO软件注释Unigene,Blasting步骤选用blastx默认设置.
1.4 筛选免疫基因
本研究通过筛选免疫相关GO注释和检索免疫关键词2种方法寻找免疫基因.Blast2GO软件在Annotation步骤中按照所设参数选取GO注释,并在Analysis步骤中返回GO注释饼图,选择GO注释可被追溯至第 2层 GO术语 GO:0002376(immune system process)的所有基因为免疫基因.另外,使用免疫基因的名称和注释信息作为检索关键词,分析Blasting过程中blastx的注释结果文件,提取出相关基因.关键词来源于免疫相关文献资料,包括虾、蟹、鲎等EST分析和综述性文章中出现的免疫基因注释信息[6-10].关键词有140个,涉及模式识别蛋白、蛋白酶和蛋白酶抑制剂、酚氧化酶原激活系统、细胞毒性活性氧等14大类.例如,一个关键词“phenoloxidase”可以完成“phenoloxidase(PO)”、“prophenoloxidase(proPO)”、“prophenoloxidase activating factor(PPAE)”和“prophenoloxidase activating enzyme(PPAE)”全检索到.为了提高检索的准确性,研究中对整个过程进行人工核查.
2 结果与分析
2.1 EST数据分析和注释结果
分析下载得到的EST数据显示,中国明对虾仅有头胸部(cephalothorax)的EST信息,中华绒螯蟹的EST序列包括血细胞、肝胰腺(hepatopancreas)、性腺(sex gland)、精巢(testis).其中,中华绒螯蟹血细胞的EST序列有2套,为不同时间不同实验室提交的序列,在注释上表现也不同,本研究分别使用血细胞Ⅰ(hemocyte)和血细胞Ⅱ(haemocyte)加以标识,采用同一种方法分别处理.EST序列经CAP3软件聚类拼接后获得相应的Unigene,结果如表1所示.
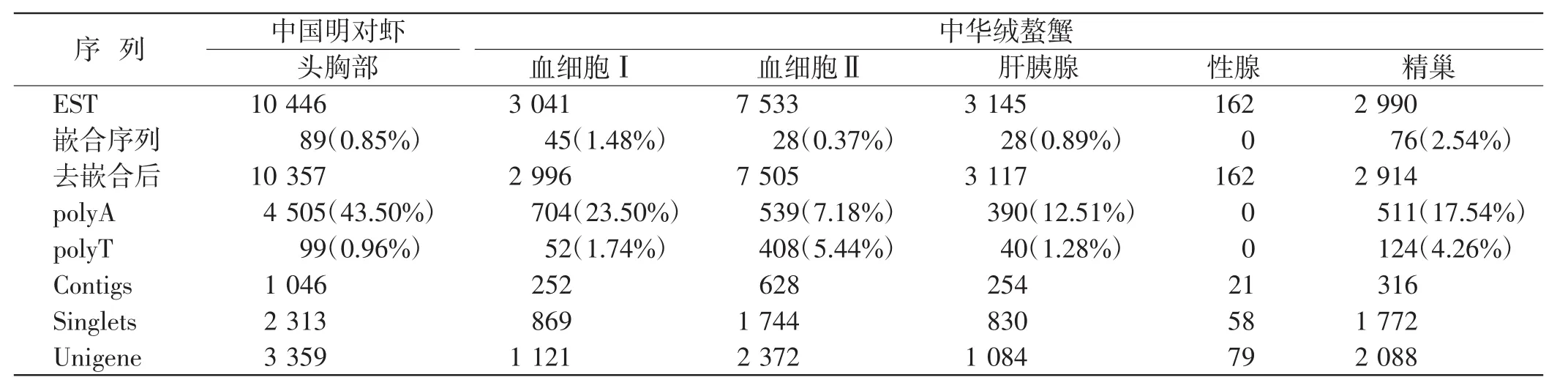
表1 EST序列分析数目统计Tab.1 Statistics number of EST sequences analysis 条
由表1可知,除性腺的EST外,其余细胞或组织的EST中都发现了嵌合序列.其中,中国明对虾头胸部EST的嵌和序列数量最多,中华绒螯蟹精巢EST中嵌和序列所占比例则最高.除性腺外,其余细胞或组织的EST中都有包含polyA和polyT的EST.中国明对虾头胸部含有polyA的EST数目最多,所占比例也最高.经CAP3软件将EST聚类拼接后形成的序列为Unigene,中国明对虾头胸部EST拼接后获得的Unigene最多,中华绒螯蟹中,血细胞ⅡEST拼接获得的Unigene最多,性腺中最少.
Blast2GO注释结果如表2所示.经blastx比对,中国明对虾头胸部被注释的Unigene数量最多,占Unigene总量的33.52%;中华绒螯蟹肝胰腺Unigene注释的比例最高,达到53.06%;中华绒螯蟹性腺中被注释的Unigene数量最少.
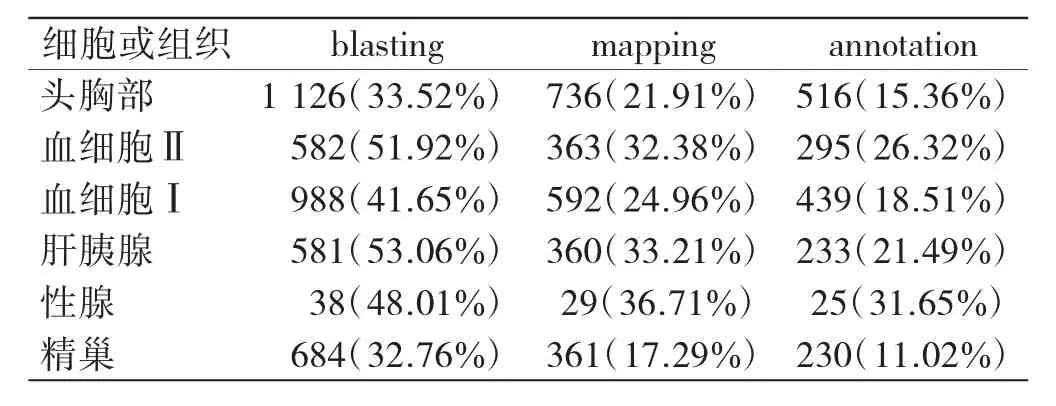
表2 Blast2Go注释过程中各步骤注释到的序列条数Tab.2 Number of Unigene statistic in each annotation step by Blast2Go 条
2.2 免疫基因筛选结果
通过Blast2GO统计第2层的生物过程GO分布,得到与第2层GO术语GO:0002376(immune system process)有关的基因,包括中国明对虾头胸部、中华绒螯蟹血细胞Ⅰ、肝胰腺、性腺、精巢的Unigene,结果如表3所示.

表3 免疫相关GO注释到的基因Tab.3 Genes annotated by immune-related GO term
由于通过GO分析确定的免疫基因数量过少,因此需要进一步通过免疫关键词检索blastx比对结果来寻找免疫基因.本研究参考甲壳动物免疫系统的文献和EST分析文献[6-9],确定了与免疫相关的关键词72条,在blastx的比对结果中进行搜索,共获得680条免疫基因.这些基因涉及模式识别蛋白、酚氧化酶原激活系统、蛋白酶和蛋白酶抑制剂等无脊椎动物免疫系统的重要组分.综合以上2种方法筛选的免疫基因,去除其中的重复结果,最终共获得免疫基因Unigene 680条,其中中华绒螯蟹血细胞Ⅰ发现的免疫基因最多.不同组织和细胞中的免疫基因在各免疫系统组分中的分布如表4所示,其中无法确定免疫系统组分的归入“其他”类.
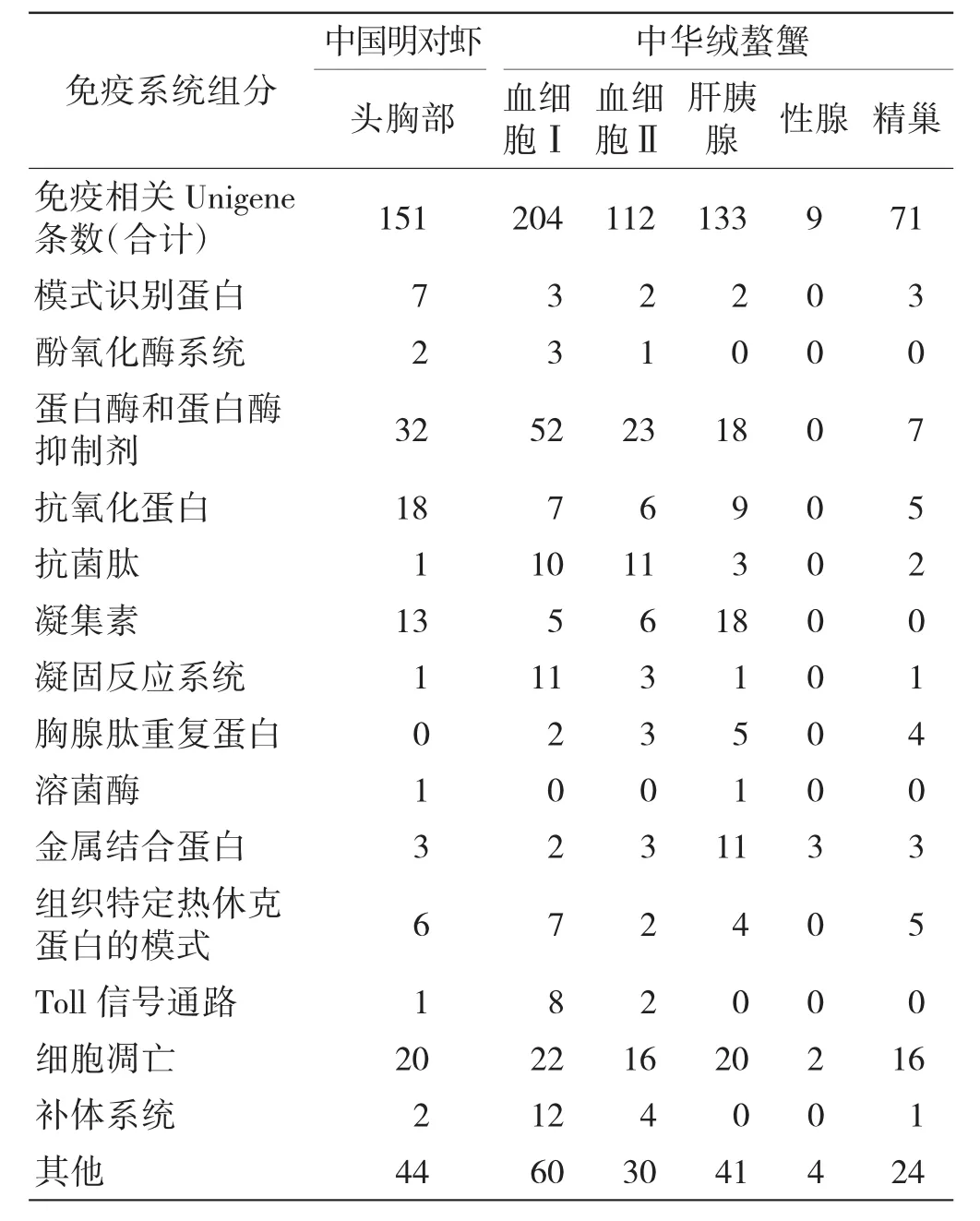
表4 不同细胞和组织免疫相关基因的功能分布Tab.4 Function distribution of immune-related genes from different cells and tissues 条
3 讨论与结论
本研究首先通过GO注释的提示筛选免疫基因,但数量较少.继而通过检索免疫关键词的方法筛选,获得了大量免疫相关基因.从另一角度来看,虽然GO注释方法获得的免疫基因数量不多,但得到的一些信息是关键词检索无法取代的.例如,gb|FL571594.1|是中华绒螯蟹血细胞Ⅰ的Unigene,GO注释表明该基因参与Toll信号通路过程,而检索免疫关键词的方法并未发现该基因;利用这2种方法都能预测中华绒螯蟹gb|GE340553.1|是免疫基因,关键词检索仅能提示该基因是凝结蛋白,而GO注释“hemolymph coagulation”(GO:0042381)则提供了更多的关于该基因的功能信息.除gb|GE340553.1|外,使用2种方法都能检索到的免疫基因还包括中国明对虾的Contig527、gb|BM297142.1|以及中华绒螯蟹血细胞Ⅰ的gb|FL571592.1|,分别为β-葡聚糖识别蛋白和toll-like受体.由此可见,GO提示信息和关键词检索方法具有互补性,二者相结合寻找免疫基因对于完善免疫基因信息和了解免疫系统组分很有必要.
在综合GO提示信息和关键词检索得到的免疫基因中,一部分与已报道的中国明对虾和中华绒螯蟹的免疫基因一致,这些免疫基因的功能注释来自NCBI数据库.例如,在中华绒螯蟹血细胞中发现多种抗菌肽,包括crustin i、crustin iii、抗脂多糖因子、抗脂多糖因子2、抗脂多糖因子3和osmotin.另外,本文还通过预测获得了一批在虾、蟹中尚未报道的潜在免疫基因.其中,中国明对虾头胸部中有60个,约占总预测基因数量的40%,中华绒螯蟹中共有250个,在各组织和细胞中的分布如表5所示.中华绒螯蟹血细胞Ⅱ中,GeneBank号为FG984061.1的EST与胡椒属(Piper colubrinum)的osmotin有79%的相似性.osmotin是一类植物抗病相关的蛋白,主要用来对抗真菌[11],因此,中华绒螯蟹体内的FG984061.1也可能有抗御真菌的作用.这些预测的基因与其他物种的免疫基因高度相似,因此也很可能参与了虾、蟹体内的免疫过程.
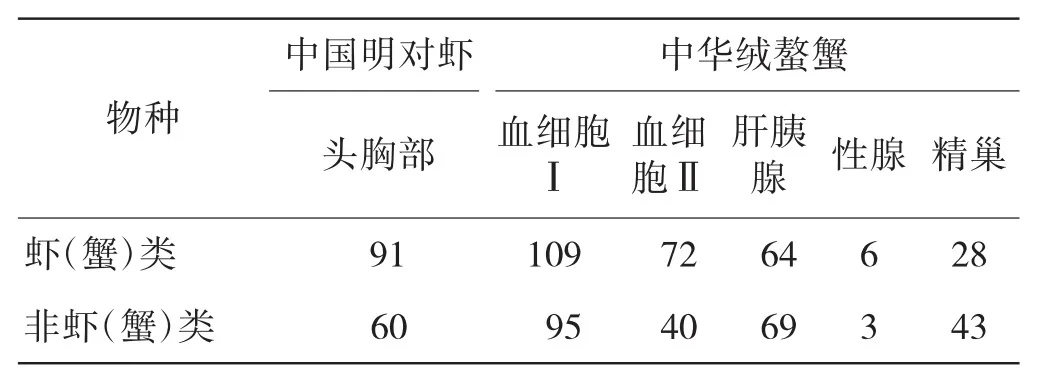
表5 免疫基因注释结果在不同物种中的分布Tab.5 Distribution of immune-related genes in different organisms 个
本研究发现中华绒螯蟹血细胞的免疫基因数量比其他组织多,其中含有参与酚氧化酶原激活系统的多种因子,抗菌肽类的免疫基因种类也更丰富.中华绒螯蟹血细胞和中国明对虾头胸部的EST中都发现了多种蛋白酶和蛋白酶抑制剂,如表6所示.

表6 蛋白酶和蛋白酶抑制剂在不同组织和细胞中分布的情况Tab.6 Distribution of protease and protease inhibitor from different tissues and cells
研究表明,血细胞作为先天免疫系统的重要参与者包含多种蛋白酶和蛋白酶抑制剂[12],蛋白酶及其抑制剂可以通过水解级联反应激活启动Toll受体、类补体反应、酚氧化酶原激活系统和凝集系统等免疫途径,在先天免疫系统中发挥重要作用.本研究发现虾、蟹具有很多先天免疫系统的重要组分,这进一步证实了甲壳动物可依靠先天免疫系统抗御病原侵染,其中,血细胞是多种免疫应答的发起者,在抗病过程中发挥了重要作用.
肝胰腺是甲壳动物重要的内分泌器官和消化器官,近年来已有一些研究提示肝胰腺可能参与免疫过程[13].Du等[14]研究螺原体MR-1008对肝胰腺中AKP、ACP、SOD、CAT等免疫基因的影响时,发现MR-1008能够启动或抑制这些基因的免疫应答,并且认为肝胰腺在先天免疫系统中发挥重要作用.Jin等[15]在中华绒螯蟹中克隆出了2种C型凝集素,并且发现能够在肝胰腺中表达.此外,有报道指出虾类肝胰腺中存在多种类型的凝集素,其表达量在细菌感染前后差异显著[16-18].本研究在中国明对虾的头胸部、中华绒螯蟹的血细胞和肝胰腺中都发现了凝集素,其中中华绒螯蟹肝胰腺EST的凝集素种类最多,包括凝集素a、凝集素b、C型凝集素1、C型凝集素2、C型凝集素3等.这有助于全面认识甲壳动物肝胰腺的功能以及正确评价其在免疫过程中的重要作用.
[1] 陈爱平,刘富林,吴凡修.2010年水产养殖病害发生情况与2011年流行趋势分析[J].中国水产,2011(3):56-59.
[2] 王俊,丛丽娟,郑洪坤.常用生物数据分析软件[M].北京:科学出版社,2008.
[3]ADAMS M D,KELLEY J M,GOCAYNE J D,et al.Complementary DNAsequencing:expressedsequencetagsandhumangenomeproject[J].Science,1991,252(5013):1651-1656.
[4]CONESA A,GOTZ S,GARCIA-GOMEZ J M,et al.Blast2GO:a universal tool for annotation,visualization and analysis in functional genomics research[J].Bioinformatics,2005,21(18):3674-3676.
[5]HUANG X,MADAN A.CAP3:a DNA sequence assembly program[J].Genome Res,1999,9(9):868-877.
[6] ZHAO D X,SONG S H.Discovery of immune-related genes in Chinese mitten crab(Eriocheir sinensis)by expressed sequence tag analysis of haemocytes[J].Aquaculture,2008,287(3/4):297-303.
[7] DONG B,XIANG J H.Discovery of genes involved in defense/immunity functions in a haemocytes cDNA library from Fenneropenaeus chinensis by ESTs annotation[J].Aquaculture,2007,272(1/2/3/4):208-215.
[8] 黄文树,王克坚,李少菁.甲壳动物抗菌肽研究进展[J].Marine Sciences,2005,29(2):64-68.
[9]王莹.凡纳滨对虾和中华绒螯蟹免疫相关因子功能及应用的初步研究[D].青岛:中国科学院海洋研究所,2010.
[10]JIRAVANICHPAISAL P,LEE S Y,KIM Y A,et al.Antibacterial peptides in hemocytes and hematopoietic tissue from freshwater crayfish Pacifastacus leniusculus:characterization and expression pattern[J].Dev Comp Immunol,2007,31(5):441-455.
[11]VIKTOROVA J,KRASNY L,KAMLAR M,et al.Osmotin,a pathogenesis-related protein[J].Curr Protein Pept Sci,2012,13(7):672-681.
[12]FRANSSENS V,SIMONET G,BREUGELMANS B,et al.The role of hemocytes,serine protease inhibitors and pathogen-associated patterns in prophenoloxidase activation in the desert locust,Schistocerca gregaria[J].Peptides,2008,29(2):235-241.
[13]刘凌云,郑光美.普通动物学[M].北京:高等教育出版社,1997.
[14]DU J,ZHU H,LIU P,et al.Immune responses and gene expression in hepatopancreas from Macrobrachium rosenbergii challenged by a novel pathogen spiroplasma MR-1008[J].Fish Shellfish Immunol,2013,34(1):315-323.
[15]JIN X K,LI W W,CHENG L,et al.Two novel short C-type lectin from Chinese mitten crab,Eriocheir sinensis,are induced in response to LPS challenged[J].Fish Shellfish Immunol,2012,33(5):1149-1158.
[16]SUN Y D,FU L D,JIA Y P,et al.A hepatopancreas-specific C-type lectin from the Chinese shrimp Fenneropenaeus chinensis exhibits antimicrobial activity[J].Mol Immunol,2008,45(2):348-361.
[17]WANG X W,ZHANG X W,XU W T,et al.A novel C-type lectin(FcLec4)fa-cilitates the clearance of Vibrio anguillarum in vivo in Chinese white shrimp[J].Dev Comp Immunol,2009,33(9):1039-1047.
[18]WEI X,LIU X,YANG J,et al.Two C-type lectins from shrimp Litopenaeus vannamei that might be involved in immune response against bacteria and virus[J].Fish Shellfish Immunol,2012,32(1):132-140.

