微波预处理-超声波提取山茱萸多糖及稳定性研究
史娟
(陕西理工学院化学与环境科学学院,陕西汉中723000)
近年来,随着分子生物学、生物化学等学科的发展,多糖所具有的增强免疫功能,抗辐射、抗肿瘤、抗炎、降血糖等生物活性,逐渐被人们发现和认识,成为当前新药发展的方向之一。山茱萸(Fructus corni)作为山茱萸科植物山茱萸的干燥果实,因其抗氧化作用[1]、抗癌、抗肿瘤作用[2-3]、抗衰老作用[4]及保护脑组织等作用[5]而成为生物医药研究、开发的一大热点。目前,山茱萸多糖的提取技术主要包括热水提取法[6]、碱提取法[7]、超声波提取法[8]、微波提取法[9]和酶提取法[10]。其中,超声波、微波提取法因其速度快、能耗小、溶剂用量小等特点受到青睐。目前,关于微波、超声波技术联合用于山茱萸多糖的提取及稳定性的研究报道尚未见到。本文将微波、超声波技术联合应用于山茱萸多糖的提取,并对提取多糖进行稳定性研究。以期获得山茱萸多糖的最佳提取条件及稳定性数据,为其产业化生产及深加工提供有效方法及技术参数。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 材料与试剂
山茱萸2011年10月下旬收于汉中佛坪县,洗净、烘干、粉碎后,经乙醚、乙醇回流脱脂脱色后密封备用。
1.1.2 试剂
葡萄糖、乙醚、无水乙醇、三氯甲烷、正丁醇、苯酚、浓硫酸、氯化钠、氯化钾、氯化铝、氯化钙、氯化铜、氯化铁、柠檬酸、苯甲酸钠、30%H2O2、亚硫酸钠、浓盐酸、氢氧化钠等试剂均为国产分析纯。水为二次去离子水。
1.1.3 仪器
101 型电热鼓风干燥箱:北京科伟永兴仪器有限公司;FW117 粉碎机:天津市泰斯特仪器有限公司;AL204-IC 型电子分析天平:梅特勒-托利多仪器上海有限公司;WP700 型微波炉:佛山市格兰仕微波炉电器有限公司;SB-5200DT 超声波清洗器:宁波新芝生物科技股份有限公司;HH 系列恒温水浴锅:河北省黄骅市渤海电器厂;TDL-5 台式离心机:上海安亭科学仪器厂;721 型可见分光光度计:山海光谱仪器有限公司制造;RE-52B 型旋转蒸发仪:上海亚荣生化仪器厂;PHS-3S 型pH 酸度计:上海精密科学仪器有限公司。
1.2 方法
1.2.1 山茱萸多糖提取方法
山茱萸果实→烘干→粉碎→乙醚、乙醇回流脱脂脱色→微波预处理→超声波提取→蒸发浓缩→乙醇沉淀过夜→Savage 法除蛋白→二次醇沉→静置过夜→无水乙醇洗涤→低温干燥→山茱萸多糖。
1.2.2 标准曲线的绘制
准确吸取1 mg/mL 的标准葡萄糖溶液2.0、4.0、8.0、12.0、16.0、20.0、24.0、28.0 mL 于100 mL 容量瓶中,蒸馏水定容;再分别吸取上述各溶液1.0 mL 于25 mL比色管中,加入1.0 mL 2%苯酚和5.0 mL 浓硫酸;摇匀,沸水浴加热15 min 后,冰水浴中冷至室温,以蒸馏水为空白,在波长490 nm 处测吸光度,绘制标准曲线如图1 所示。

图1 标准曲线Fig.1 The standard curve of polysaccharide
1.2.3 山茱萸中多糖含量的测定方法
苯酚-硫酸比色法测定山茱萸多糖含量[11],多糖提取率计算采用:多糖提取率=(C×V)/W×100%,式中C 为按标准曲线得出的多糖溶液浓度;V 为多糖溶液体积;W 为原料质量。
1.2.4 提取实验
采用不同超声时间、温度、料液比及醇沉浓度4个因素对山茱萸多糖提取率的影响进行单因素考查。并结合单因素实验结果设计L9(34)的正交试验(见表1),寻求最佳提取工艺条件。

表1 四因素三水平正交试验表Table 1 Factors and levels of orthogonal experiments
1.2.5 山茱萸多糖的稳定性试验
取山茱萸多糖溶液,通过改变酸碱度、加入不同金属离子、食品添加剂、氧化还原剂等的水溶液,在一定条件下放置一段时间,在波长为490 nm 处测定不同溶液的吸光度,考察山茱萸多糖在上述条件下的稳定性。
2 结果与讨论
2.1 最佳单因素的确定
2.1.1 超声提取时间对多糖提取率的影响
准确称取5 g 脱脂脱色后的山茱萸粉末,微波预处理60 s,在料液比1 ∶14(g ∶mL)、提取温度60 ℃的条件下,改变超声处理时间,研究多糖提取率。超声提取时间对多糖提取率的影响如图2 所示。

图2 提取时间对多糖提取率的影响Fig.2 Effect of time on polysaccharide yield
结果表明,随着超声提取时间的增加,山茱萸多糖得率逐渐提高。在80 min 时,多糖得率达到最高。此后随着处理时间的延长,多糖得率开始下降。故最佳超声提取时间为80 min。
2.1.2 超声提取温度对多糖提取率的影响
准确称取5 g 脱脂脱色后的山茱萸粉末,微波预处理60 s 后,在料液比1 ∶14(g ∶mL)、超声提取时间80 min 的条件下,改变超声处理温度,研究多糖提取率。温度对提取率的影响见图3,随着提取温度升高,多糖得率随之增加,在60 ℃多糖得率最高。

图3 提取温度对多糖提取率的影响Fig.3 Effect of temperature on polysaccharide yield
2.1.3 料液比对多糖提取率的影响
准确称取5 g 脱脂脱色后的山茱萸粉末,微波预处理60 s 后,在超声处理时间80 min,温度60 ℃的条件下,研究料液比对山茱萸多糖提取效果的影响见图4。
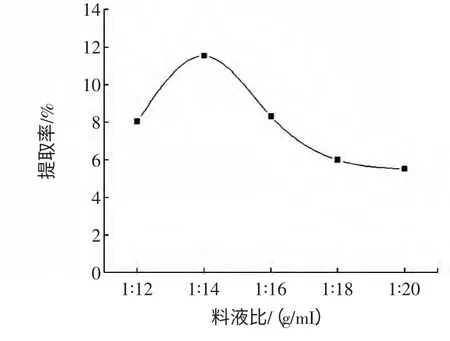
图4 料液比对多糖提取率的影响Fig.4 Effect of material/liquid ratio on polysaccharide yield
图4 反映出了料液比对多糖提取率的影响,料液比低于1∶14(g/mL)时,增大料液比,多糖提取率随之增加;料液比大于1∶14(g/mL)后,提取率减小。这是因为溶剂用量少,原料细胞组织浸润不完全,提取效果差;而过多溶剂则会消耗大量超声波辐射能量,因而影响多糖的析出。因此,选择料液比1∶14(g/mL)为宜。
2.1.4 醇沉浓度对多糖提取率的影响
准确称取5 g 脱脂脱色后的山茱萸粉末,微波预处理60 s 后,在超声处理时间80 min,提取温度60 ℃,料液比为1∶14(g/mL)条件下,改变醇沉浓度,研究多糖提取率。醇沉浓度对提取率的影响见图5。结果表明,随着乙醇浓度升高,多糖得率随之增加,在乙醇浓度75%时,多糖得率最高。

图5 醇沉浓度对多糖提取率的影响Fig.5 Effect of alcohol concentration on polysaccharide yield
2.2 正交试验得出各因素交互作用对山茱萸多糖提取含量的影响
2.2.1 正交试验结果与分析
正交试验结果与分析见表2、表3。
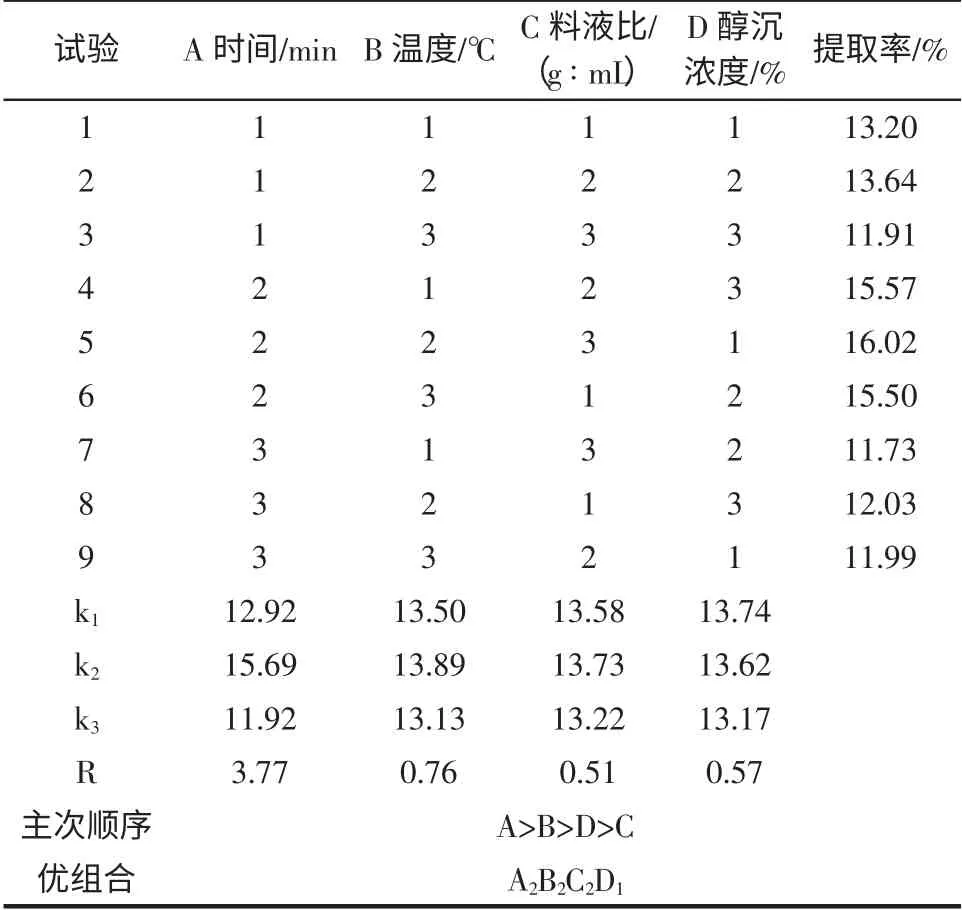
表2 正交试验结果Table 2 Orthogonal test design and results
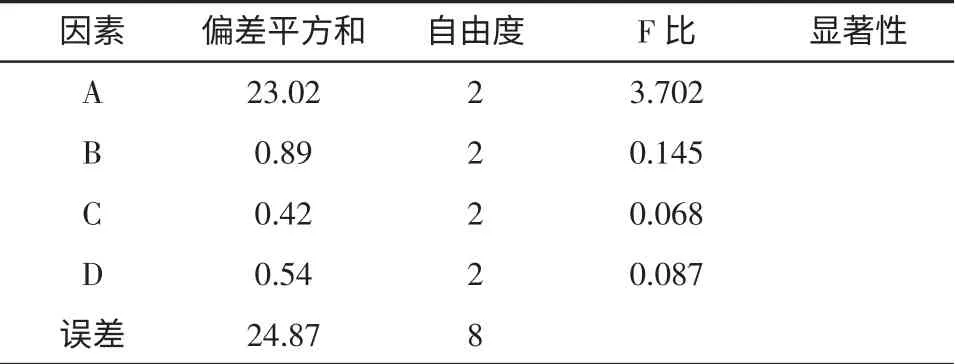
表3 方差分析表Table 3 Analysis of variance
正交试验分析由表2 可知,在山茱萸多糖超声提取的因素中:时间A>温度B>醇沉浓度D>料液比C,优方案为A2B2C2D1,故最佳提取条件为:提取时间80 min,提取温度60 ℃,料液比1 ∶14(g/mL),乙醇浓度为65 %。方差分析各因素与极差分析结果是一致,说明本实验设计方法合理,操作符合规范。
2.2.2 验证性试验结果
为进一步确定山茱萸多糖微波预处理-超声波提取的最佳工艺条件,在正交试验基础上选择最优水平组合:A2B2C2D1,并在此条件下提取山茱萸多糖,平行3 次,多糖提取率平均值为16.83%。
2.3 山茱萸多糖的稳定性研究
2.3.1 金属离子对山茱萸多糖的影响
取4 mL 的多糖溶液6 份,分别加入0.05 mol/L 的KCl、NaCl、CaCl2、AlCl3、FeCl3、CuCl2溶液2 mL,摇匀避光静置2h,用苯酚-硫酸比色法测其吸光度结果见图6。

图6 金属离子对多糖稳定性的影响Fig.6 Influence of metal ions on polysaccharide stability
由图6 可以看出,几种金属离子对多糖稳定性的影响。K+、Ca2+、Na+离子使多糖吸光度明显下降,Fe3+、Cu2+使吸光度大幅上升,仅有Al3+对吸光度影响不大。说明山茱萸多糖在此条件下可能与K+、Ca2+、Na+、Fe3+、Cu2+发生了化学反应。
2.3.2 pH 对山茱萸多糖的影响
取4mL 的多糖溶液6 份,用0.1mol/LHCl和0.1mol/L NaOH 调节pH 为2.0、4.0、6.0、8.0、10.0、12.0,避光处理2 h,用苯酚-硫酸比色法测其吸光度。由图7 可知pH 对山茱萸多糖稳定性的影响,在酸性条件下,多糖的吸光度变化较小;而碱性条件下,多糖的吸光度随着pH 先增后减。由此表明,山茱萸多糖在酸性介质中比较稳定,在碱性介质稳定性较差。

图7 pH 对多糖稳定性的影响Fig.7 Influence of pH value on polysaccharide stability
2.3.3 食品添加剂对山茱萸多糖的影响
取4 mL 的多糖溶液3 份,分别加入0.05 mol/L 的VC、柠檬酸、苯甲酸钠2.0 mL,保温2 h,用苯酚-硫酸比色法测其吸光度。食品添加剂对山茱萸多糖稳定性的影响见表4。

表4 食品添加剂对多糖稳定性的影响Table 4 Influence of food additives on polysaccharide stability
实验结果表明,苯甲酸钠的加入对多糖的影响不大,柠檬酸、VC的加入导致吸光度明显增加,说明这两种物质对山茱萸多糖的影响较大。
2.3.4 氧化还原剂对西洋参叶多糖的影响
取4 mL 的多糖溶液10 份,分别加入浓度为0.02、0.03、0.04、0.05、0.06 mol/L 的H2O2和Na2SO3溶液 各2.0 mL,振荡避光保存2 h,用苯酚-硫酸比色法测定吸光度。氧化还原剂对山茱萸多糖稳定性的影响见图8。
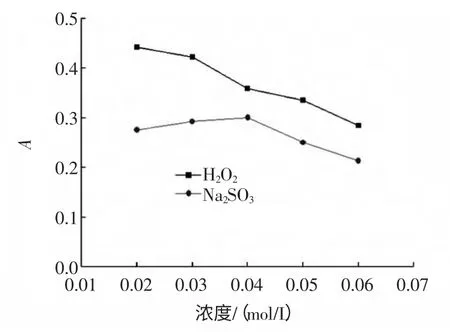
图8 氧化还原剂对多糖稳定性的影响Fig.8 Influence of oxidant and reductant on polysaccharide stability
由图8 可知,多糖吸光度值随着氧化还原剂浓度的增大,逐渐降低,说明山茱萸多糖在氧化还原剂中的稳定性较差。
3 结论
本实验用微波预处理-超声波法从山茱萸中提取多糖,其最优化工艺条件:超声时间80 min、温度60 ℃、料液比1∶14(g/mL),乙醇浓度65%,此工艺下得到的山茱萸多糖提取率为16.83%。与常见的热水提取法[6]、微波提取法和酶提取法[10-11]相比,该法产率高、方法简便、节能环保。山茱萸多糖在Al3+、苯甲酸钠及弱酸性溶液中稳定性较好;而在K+、Ca2+、Na+、Fe3+、Cu2+、柠檬酸钠、VC、氧化还原剂中稳定性较差。因此在综合开发利用山茱萸多糖产品时应注意避免与影响其稳定性的物质直接接触。
[1] 张艳萍,尤玉如,戴志远.山茱萸多糖体外清除自由基和抗氧化作用研究[J].中国食品学报,2008,8(6):18-22
[2] 王恩军,靳祎,季文琦,等.山茱萸多糖对肺癌细胞的凋亡作用及Bcl-2、Bax 表达的影响[J].中成药,2012,34(5):808-811
[3] 邹品文,赵春景,李攀,等.山茱萸多糖的抗肿瘤作用及其免疫机制[J].中国医院药学杂志,2012(1):20-22
[4] 欧芹,葛堂栋,王迪迪,等.山茱萸多糖抗HDF 衰老与cyclinD1表达的关系[J].黑龙江医药科学,2008,31(1):1-3
[5] 张丽娟,孔军伶.山茱萸多糖的提取工艺优化及对大鼠局灶性脑缺血再灌注损伤的保护作用[J].中药材,2007,30(11):1466-1468
[6] 张良,张彩莹,李云,等.山茱萸多糖提取条件的优化[J].安徽农业科学,2006,34(22):5893-5894
[7] 李平,王艳辉,马润宇.碱提山茱萸多糖的理化性质及抗氧化活性研究[J].中草药,2003,34(11):973-976
[8] Zhou L L , Zhao X L, Wang S M. Studies on Chemical Components of Fructus Corni in the Ultrasonic Extraction Process[J]. Research and practice of chinese medicines,2005,19(3):47
[9] 胡园园,方淑玲,杨虎清,等.微波辅助提取山茱萸多糖工艺优化[J].食品与机械,2011,27(5):93-95
[10] 程俊文,贺亮,吴学谦,等.复合酶法提取山茱萸多糖的工艺条件优化[J].中国林副特产,2010(3):1-4
[11] 王玮.苯酚-硫酸法测定猕猴桃根中多糖含量[J].药学进展,2010,34(5):225-226

