MyHC基因在C2C12成肌细胞分化过程中的时序表达
林亚秋, 张明, 邬杨楠, 李瑞文, 郑玉才
(1.西南民族大学生命科学与技术学院, 成都 610041; 2. 成都市妇女儿童中心医院生殖与不孕研究所, 成都 610051)
MyHC基因在C2C12成肌细胞分化过程中的时序表达
林亚秋1, 张明1, 邬杨楠1, 李瑞文2, 郑玉才1
(1.西南民族大学生命科学与技术学院, 成都 610041; 2. 成都市妇女儿童中心医院生殖与不孕研究所, 成都 610051)
以体外培养的C2C12成肌细胞为研究对象, 然后利用荧光定量PCR检测肌球蛋白重链(myosin heavy chains, MyHC)的3种亚型MyHC1、MyHC2x和MyHC2b在成肌诱导分化中(0-8 d)中的时序表达规律. 结果表明,MyHC1基因在诱导分化的0-4 d表达呈上升趋势, 4-8 d又呈下降趋势, 在第4 d和第6 d的表达水平显著高于其他天数(p<0.05).MyHC2x基因在诱导分化的0-6 d 表达呈上升趋势, 但在第8 d又开始下降.MyHC2b在诱导分化的0-8 d 中表达一直呈上升趋势, 第6 d和第8 d表达水平显著高于其他天数(p<0.05).
肌球蛋白重链基因; C2C12成肌细胞; 时序表达
骨骼肌是机体的重要组成部分, 肌纤维是组成骨骼肌的基本单位, 由成肌细胞分化而来, 其特性直接决定肉的品质, 是动物养殖的重要经济性状. 肌纤维特性主要包括肌纤维的类型、直径、密度及肌纤维生长发育规律等. 其中肌纤维类型的多样性以及复杂的时空分布模式是肌肉功能差异的分子基础, 不同类型的肌纤维在收缩功能、线粒体成分和代谢特性等方面有很大差异[1], 进而导致肌肉之间品质的差别[2]. 研究表明, 肌肉中红肌纤维所占的比例越大, 白肌纤维所占比例越小, 肌肉的品质就越好[3-5]. 1994年, Scohiaffin和Reggiani确定了哺乳动物中与肌纤维类型相对应的肌球蛋白重链MyHC的类型, 即肌球蛋白重链的亚型MyHCI(MyHCslow)、MyHCIIa、MyHCIIx和MyHCIIb分别对应I型、IIa型、IIx型和IIb型肌纤维[6]. 目前肌球蛋白重链(myosin heavy chain, MyHC)同功型被认为是决定肌纤维快、慢类型的主要决定因素[7], 是区分肌纤维类型和研究肌肉适应性的分子标志. 因此阐明MyHC1、MyHC2x和MyHC2b在C2C12成肌细胞分化过程中的时序表达规律具有重要的意义. 本实验以C2C12成肌细胞为研究对象, 利用荧光定量PCR检测MyHC1、MyHC2x和MyHC2b基因在诱导分化的0-8 d成肌细胞中的表达规律, 研究结果为阐明动物肌肉生长及肉品质形成的分子机制提供重要的基本资料.
1 材料与方法
1.1 实验材料和主要试剂
实验所用C2C12成肌细胞系由本实验室保存.
细胞培养基DMEM/F12、马血清购自Gibco公司; 胰蛋白酶(购自sigma公司), Trizol试剂、SYBR® Premix Ex Taq TM (2×)和pMD-19T载体购自大连TaKaRa公司; 反转录试剂盒和Taq DNA聚合酶购自Fermentas公司;其他均为国产分析纯.
1.2 方法
1.2.1 C2C12成肌细胞的培养
从液氮罐中快速取出装有冻存细胞的冻存管, 快速放于37 ℃水浴中, 轻摇1 min使其溶解, 然后加入10倍
冻存液体积的培养基, 1050 rpm离心4 min, 弃上清, 将细胞接种于含10 %FBS的高糖DMEM培养基中, 在37 ℃, 5 %CO2的培养箱中静臵培养. 待细胞将长至90 %以上的时候进行传代, 在37 ℃、5 %的CO2培养箱中培养24 h, 第2天换为含2 %马血清高糖DMEM培养基诱导分化, 继续培养用于后续研究.
1.2.2 细胞总RNA提取与反转录
分别收集诱导0、2、4、6、8 d的C2C12成肌细胞, 吸出培养皿中的培养液. 按照Trizol试剂盒说明书提供的方法提取细胞总RNA, 紫外分光光度计和琼脂糖凝胶电泳鉴定总RNA的质量, 然后-80 ℃保存备用.
取1 μg总RNA按照反转录试剂盒说明书以Oligo (dT) 为引物合成cDNA第一链.
1.2.3 荧光定量PCR
根据小鼠MyHC1、2b、2x的mRNA基因序列(登录号分别为BC158018、AJ278733、DQ021871), 应用Primer Premier5.0软件, 设计MyHC1、MyHC2x和MyHC2b基因特异引物(表1), 送交上海生物工程股份有限公司合成.
利用荧光定量PCR检测MyHC1、MyHC2x和MyHC2b在不同分化时期的C2C12细胞中的表达规律. 反应体系为20 μL: SYBR® Premix Ex Taq TM (2×)PCR 10 μL , 10 μmol/L的上下游引物各0.5 μL, cDNA 1μL, 灭菌水8 μL. 反应条件为95 °C预变性1 min, 95 °C 30 s, 61 ℃/58 ℃ 30 s, 45个循环, 72 °C 延伸30 s. 荧光定量结果采用2-ΔΔCt方法进行分析[8].
1.3 数据分析
数据采用SPSS 13.0 软件进行分析, 所得数据用平均值±标准误( mean ± SE) 表示, 采用ANOVA进行显著性检验分析, 当P<0.05 时, 认为差异显著, 当P<0.01 时, 认为差异极显著.
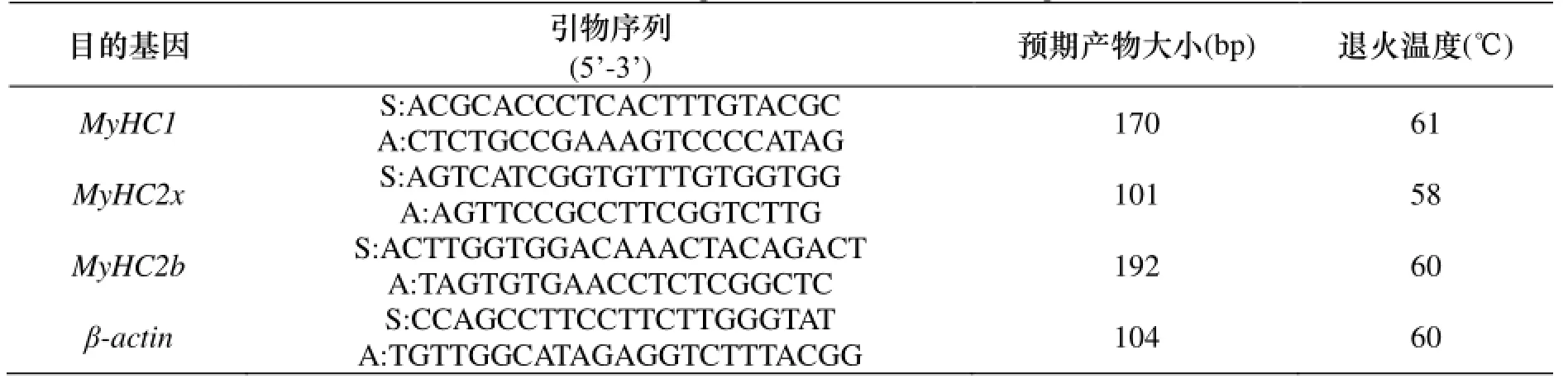
表1 扩增MyHC1, MyHC2x, MyHC2b基因的引物参数Table 1 Primers for quantitative real-time PCR(qPCR)
2 结果
2.1 细胞总RNA的鉴定
提取的细胞总RNA样品经紫外分光光度计测定, 其OD260/OD280值均在1.8-2.0之间, 表明细胞RNA无蛋白及酚污染. 且总RNA经1 %琼脂糖凝胶电泳显示RNA有28 S, 18 S, 5 S 3条主要区带, 说明样品中的RNA基本没有降解, 可用于后续分析.
2.2 MyHC1、MyHC2x和MyHC2b在C2C12细胞分化过程中的表达变化
荧光定量PCR结果显示: MyHC1基因在0-4 d表达呈上升趋势, 在4-8 d又呈下降趋势, 但在第4 d和第6 d的表达水平显著高于其他天数(p<0.05)(图1).
MyHC2x基因在诱导分化的0-6 d表达是呈上升趋势, 但在第8 d又开始下降(图2).MyHC2b在诱导分化的0-8 d中表达一直呈上升趋势, 第6 d和第8 d表达水平显著高于其他天数(p<0.05)(图3).
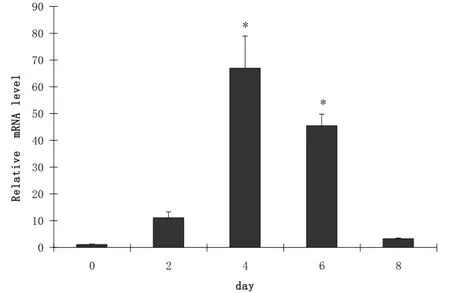
图1 MyHC1在C2C12细胞分化过程中的表达变化Fig.1 Expression of MyHC1 during C2C12 myoblast differentiation
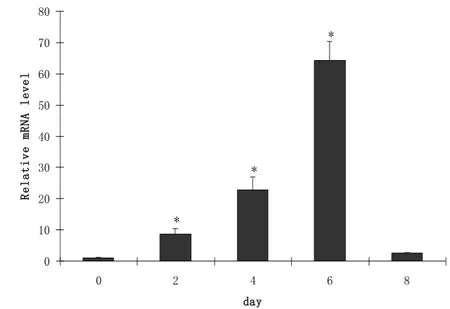
图2 MyHC2x在C2C12细胞分化过程中的表达变化Fig.2 Expression of MyHC2x during C2C12 myoblast differentiation

图3 MyHC2b在C2C12细胞分化过程中的表达变化Fig.3 Expression of MyHC2b during C2C12 myoblast differentiation
3 讨论
肌纤维类型及其组成是肌肉生长和肉品质形成的生物学基础, 可直接影响肌肉色泽、嫩度和肌内脂肪含量, 因此备受动物育种工作者的广泛关注. 骨骼肌根据肌纤维的形态、功能和生理生化特性分为两类, 即Ⅰ型(红肌, 慢肌)和Ⅱ型(白肌, 快肌)肌纤维. Ⅰ型含有更多的线粒体和细胞色素, Ⅱ型细胞色素和肌红蛋白含量较少. 后来学者指出MyHC的亚型可决定肌纤维的类型, 是分子水平上的主要检测指标[9]. 本实验以2 %的马血清诱导C2C12细胞分化, 分别收集诱导0-8 d的细胞, 利用荧光定量PCR检测MyHC1、MyHC2x和MyHC2b的表达规律, 结果指出这些基因在分化过程中具有一定的表达规律, MyHC1基因在分化的前期表达呈上升趋势, 在分化后期表达水平开始下降, 在第4 d表达最高(p<0.05); MyHC2x基因在诱导分化的0-6 d表达是呈上升趋势, 但在第8 d又开始下降,在第6 d表达水平最高. MyHC2b在诱导分化的0-8 d中表达一直呈上升趋势, 在分化后期表达水平高. 这一实验结
果与肌肉本身的生长发育特性、生理变化规律是基本相符的[10,11]. 这与杨晓静等[12]的研究结果相似, 3日龄猪MyHC1和MyHC2x的表达水平显著高于20日龄及以后猪的表达水平,MyHC2b在20日龄猪的表达水平显著高于3日龄猪的表达水平. 总之肌纤维类型的组成在动物生长发育的整个时期受各种外界因素的影响会发生肌纤维类型转化的现象[13-15], 对动物肉品质的形成具有很大的影响, 因此研究肌纤维类型的转化及其调控机制将是一个十分有价值的课题.
[1] BERCHTOLD M W, BRINKMEIER H, MUNTENER M. Calcium ion in skeletal muscle: its crucial role for muscle function, plasticity, and disease[J].Physiol Rev, 2000, 80:1215-1265.
[2] PICARD B, JURIE C, DURIS M P, et al. Consequences of selection for higher growth rate on muscle fibre development in cattle[J]. Livest Sci, 2006, 102: 107-120.
[3] LEFAUCHEUR L, MILAN D, ECOLAN P, et al. Myosin heavy chain composition of different skeletal muscles in Large White and Meishan pigs[J]. J Anim Sci, 2004, 82(7): 1931-1941.
[4] MALTIN C A,SINCLAIR K D,WARRISS P D,et al. The effects of age at slaughter,genotype and finishing system on the biochemical properties,muscle fibre type characterist-ics and eating quality of bull beef from suckled calves[J]. Anim Sci,1998,66:341-348.
[5] LARZUL C,LEFAUCHEUR L,ECOLAN P,et al.Phenotypic and genetic parameters for longiss im usmuscle fiber characteristics in relation to growth,carcass,and meatquality traits in Large White pigs[J]. Journal of Animal Science,1997,75:3126-3137.
[6] SCHIAFFINO S, REGGIANI C. Myosin isoforms in mammalian skeletal muscle[J]. J Appl Physiol, 1994, 77(2):493-501.
[7] TONIOLO L, MACCATROZZO L, PATRUNO M, et al. Fiber types in canine muscles: myosin isoform expression and functional characterization[J]. Am J Physiol Cell Physiol, 2007, 292(5):C1915-26
[8] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−△△Ctmethod[J]. Methods, 2001, 25: 402-408.
[9] ZHAO R Q, YANG X J, XU Q F, et al.Expression of GHR and PGC-alpha in association with changes of MyHC isoform types in longissimus muscle of Erhualian and Large White pigs (SUS scrofa) during posmatal growth [J].Animal Science,2004, 79: 203-211.
[10] ANDERS H K, RONALD E K, XAVIER F.Skeletal muscle fibres as factors forpork quality [J].Livestock Production Science, 1999, 60(l): 255-269.
[11] IMMONEN K, RUUSUNEN M, HISSA K, et al. Bovine muscle glycogen concentration in relation to finishing diet, slaughter and ultimate pH [J]. Meat Sci, 2000, 55: 25-31.
[12] 杨晓静, 赵茹茜, 陈杰, 等. 猪背最长肌肌纤维类型的发育性变化及其品种和性别特点[J].中国兽医学报, 2005, 25(1): 89-94.
[13] MALTIN C A, WARKUP C C, MATTEWA等 K: R川, 西et 獐al牙. P菜ig 多m糖usc的le提 fi取bre及 c含ha量rac测ter定istics as source of variation in eating quality[J]. Meat Sci,1997,47:237-248.
[14] YUAN Y, SHI X E, LIU Y G, et al. FoxO1 regulates muscle fiber-type specification and inhibits calcineurin signaling during C2C12
[15] VENHOFF N, LEBRECHT D, PFEIFER D, et al. Muscle-fiber transdifferentiation in an experimental model of respiratory chain myopathy[J]. Arthritis Res Ther, 2012, 29, 14(5): R233. myoblast differentiation[J]. Mol Cell Biochem, 2011, 34 8(1-2) :77-87.
Temporal expression of MyHC gene during C2C12 myoblast differentiation
LIN Ya-qiu1, ZHANG Ming1, WU Yang-nan1, LI Rui-wen2, ZHENG Yu-cai1
(1.School of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.; 2 Reproductive and Endocrine Laboratory, Chengdu Woman-Child Central Hospital, Chengdu610051, P.R.C.)
In this experiment, C2C12 myoblasts were used as the research object, which were cultured in vitro with 2 % horse serum to induce differentiation 0-8 d, and then real-time PCR was carried out to detect the expression of three subtypes of MyHC (myosin heavy chains) includingMyHC1,MyHC2xandMyHC2b. The results showed thatMyHC1gene expression increases during day 0 to 4 after differentiation, while decreases during day 4 to 8. Moreover, the expression level on the 4th and 6th days is significantly higher than that of other days (p<0.05).MyHC2xgene expression is on the rise when it was induced differentiation from 0 to 6 days, but began to decline on the 8th day. The expression ofMyHC2bwas increasing when it was induced from 0 to 8 d and the expression of MyHC2b on the 6th and 8th days were significantly higher than the others(p<0.05)
MyHCgene; C2C12 Myoblasts; temporal expression
Q593+.3
: A
: 1003-4271(2014)03-0350-04
10.3969/j.issn.1003-4271.2014.03.05
2014-04-03
林亚秋(1976-), 女, 内蒙古阿荣旗人, 副教授, 博士.
国家自然科学基金(No.31201990)
- 西南民族大学学报(自然科学版)的其它文章
- Polymorphisms of growth hormone (GH) and insulin-like growth factor I (IGF-I) genes in prolific Lezhi Black Goat: possible association with litter size
- 遗产型景区应如何应对危机事件浅析
——以九寨沟“10.2”事件为例 - 乐至黑山羊GH和IGF-I基因多态性及其与产羔性状的关联性分析
- 解决不同类型指派问题的EXCEL模型
- 基于mtDNA COⅠ基因的西藏牦牛遗传多样性及系统进化研究
- Polymorphisms of growth hormone (GH) and insulin-like growth factor I (IGF-I) genes in prolific Lezhi Black Goat: possible association with litter size

