不同潮气量、通气时间对家兔呼吸机相关肺损伤模型的影响
张群英,丰浩荣,葛 伟,许鹏程
呼吸机所致肺损伤(ventilator-induced lung injury,VILI)是机械通气引起或者加重的急性肺损伤(acute lung injury,ALI),常导致患者肺部原有病情加重甚至引发肺外多系统器官功能衰竭(MSOF)而死亡。目前,VILI的发病机理不清,早期诊断困难,治疗缺少针对性,确诊时常丧失救治时机,病死率居高不下[1]。动物实验是研究VILI的重要方法,本研究采用不同的潮气量(VT)和通气时间,来制作家兔VILI模型,为进一步研究VILI发病机制及其防治措施奠定基础。
1 材料与方法
1.1 实验动物 体重2.2~2.9 kg成年雄性清洁级家兔54只,徐州医学院实验动物中心提供,动物许可证号:SYXK(苏)2003-0003。
1.2 实验设备与主要试剂 小动物呼吸机(浙江医科大学仪器实验厂,DH-150型),生物机能实验系统(成都泰盟科技公司,BL-420型),血气分析仪(瑞氏AVL公司,compact 3型),电热恒温干燥箱(上海精宏设备有限公司,DHG-9037型),戊巴比妥钠(上海拜力生物科技公司),哌库溴胺(成都诺迪康生物制药公司),考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所)。
1.3 方法
1.3.1 动物准备:耳缘静脉注射戊巴比妥钠全身麻醉,备皮行气管切开置入气管插管,连接呼吸机行机械通气,间断给予哌库溴胺维持肌松。分离左侧颈总动脉,插入动脉导管连接生理监护仪,持续监测血压、心率并进行动脉血采集。分离右侧颈静脉置入静脉套管针用作静脉通道,以10 ml/(kg·h)速度持续输注生理盐水,补充丢失的液体并维持血压稳定。通气参数设置为容量控制(CMV):VT 10 ml/kg,吸入氧浓度(FiO2)21%,吸呼比(I∶E)1∶2,呼气末正压(PEEP)2 cmH2O(1 cmH2O=0.098 kPa),呼吸频率30~40/min,维持二氧化碳分压(PaCO2)40 mmHg(1 mmHg=0.133 kPa)。
1.3.2 动物分组:机械通气稳定30 min后记录各项生理参数,为基础值(时间点记为0 h),将动物随机分为各实验组,予以不同VT和通气时间,每亚组均为6只家兔。①小潮气量组(VT10组):继续初始通气条件机械通气,调节VT为10 ml/kg,呼吸频率32/min,通气时间分别为2 h,4 h,6 h(分别记为VT10-2亚组,VT10-4亚组,VT10-6亚组)。②中潮气量组(VT20组):调节VT为20 ml/kg,呼吸频率14/min,通气时间分别为 2 h,4 h,6 h(分别记为VT20-2亚组,VT20-4亚组,VT20-6亚组)。③大潮气量组(VT40组):调节VT为40 ml/kg,呼吸频率8/min,通气时间分别为 2 h,4 h,6 h(分别记为VT40-2亚组,VT40-4亚组,VT40-6亚组)。通气过程中根据血气情况调整呼吸频率以维持PaCO240 mmHg左右,除PEEP设为0 cmH2O外,余通气参数与准备阶段相同。
1.4 检测指标 ①血流动力学:连续监测平均动脉血压(MAP)、心率(HR)。②血气分析:每间隔2 h测定氧分压(PaO2)、PaCO2、pH值等气体交换和代谢指标。③呼吸力学:连续监测气道峰压(Ppeak)、平台压(Pplat)。实验终点放血处死动物(未到终点时间即死亡的出组)。④BALF蛋白定量、有核细胞及中性粒细胞计数:开胸后以动脉夹夹闭右主支气管,以8 ml 4℃生理盐水反复肺灌洗3次回收,再用8 ml生理盐水灌洗一次回收,将两次回收得到的BALF用双层无菌纱布过滤,4000 r/min离心15 min。细胞沉渣重新悬浮于1 ml生理盐水,计数有核细胞总数,并涂片瑞氏染色计数中性粒细胞。上清液以考马斯亮蓝法测定蛋白浓度。⑤肺组织湿干比:选取左肺上叶称湿重,置于80℃烤箱烘烤24 h称干重,计算湿干比。⑥病理形态学观察:留取左肺下叶组织适量,置入4%多聚甲醛溶液固定,常规包埋石蜡切片,HE染色光镜下观察肺损伤情况。
1.5 统计学处理 采用SPSS 11.5软件进行统计分析,计量资料用均数±标准差(±s)表示,Bartlett检验进行方差齐性检验,方差分析中Dunnett方法进行组间均数比较,α=0.05为检验水准。
2 结果
2.1 临床表现及死亡率 各组动物在麻醉后,均能保持麻醉状态,具体临床表现及死亡数见表1。
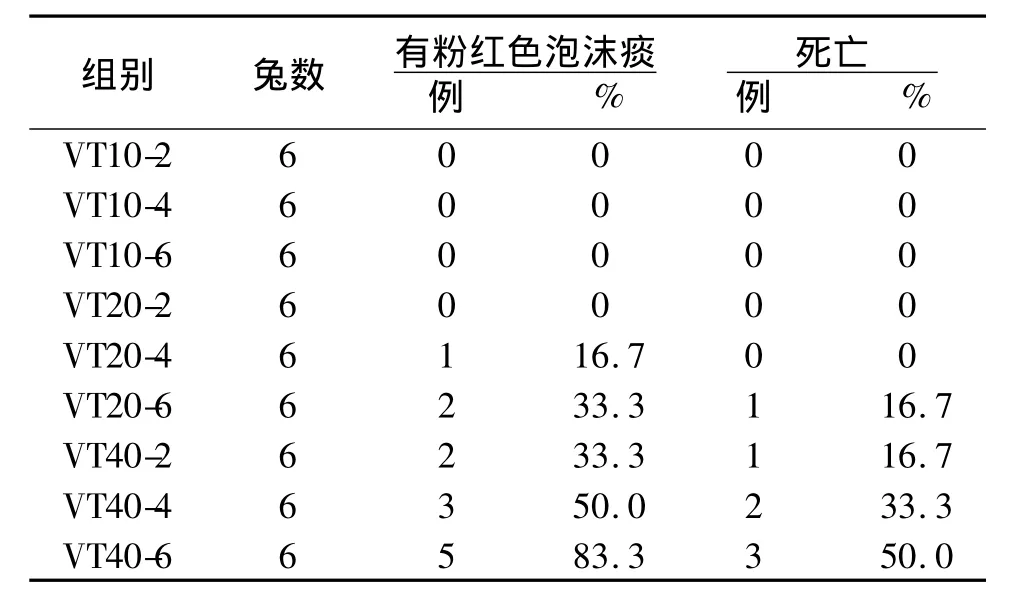
表1 9组呼吸机所致肺损伤家兔模型临床表现及死亡率
2.2 血流动力学及呼吸力学参数 各组动物在通气开始时,MAP 为(103.2±7.3)mmHg,HR 为(204.9 ±17.4)/min,Ppeak 为(12.3 ±1.1)cmH2O,Pplat为(8.6 ±1.2)cmH2O,氧合指数(PaO2/FiO2)为(465.5 ±24.2)mmHg。VT20、VT40 组内随着通气时间的延长,MAP及 HR呈不同程度下降,且VT40组较VT20组下降更明显,甚至出现不同程度的缺氧、休克表现及死亡,见表2。
VT10组通气过程中Ppeak相对稳定,VT20组和VT40组在通气过程中Ppeak呈基本上升趋势,VT40组升高最为显著,与VT10组和VT20组同时间点比较差异均具有显著性(P<0.05)。见表2。
VT10组在各时间点PaO2/FiO2保持稳定,与0 h比较均无显著差异(P>0.05)。VT20和 VT40两组PaO2/FiO2随通气时间延长有下降趋势,其中VT20组的2 h后与0 h比较差异均有显著性但PaO2/FiO2均 >300 mmHg,而4 h、6 h 点 PaO2/FiO2均<300 mmHg,VT40组通气中不同时间点与0 h比较都有明显下降(P<0.05),其中 2、4、6 h的PaO2/FiO2值均 <300 mmHg,见表2。
2.3 肺组织病理改变 VT10组肺组织肉眼及光镜下未见明显的改变。VT20组随着通气时间延长,可见一定程度的肺损伤,至通气6 h时,大体标本肉眼可见散在出血点,镜下表现为肺间隔增宽,炎性细胞浸润,肺泡腔少量渗出。而VT40组通气2 h后肺组织就出现了显著的损伤改变,大体标本可见点、片状出血,镜下见肺泡结构变形、间隔增宽及肺泡腔融汇,大量渗出,炎性细胞大量积聚,部分肺组织实变。肺病理改变随通气时间的延长而加剧。见图1。
表2 9组呼吸机所致肺损伤家兔模型血流动力学及呼吸力学参数比较(±s)

表2 9组呼吸机所致肺损伤家兔模型血流动力学及呼吸力学参数比较(±s)
注:VT10-2、4、6:潮气量为 10 ml/kg,通气时间为 2、4、6 h;VT20-2、4、6:潮气量为 20 ml/kg,通气时间为 2、4、6 h;VT40-2、4、6:潮气量为40 ml/kg,通气时间为2、4、6 h;与VT10组相同通气时间的亚组比较,a P<0.05;与VT20组相同通气时间的亚组比较,c P <0.05
组别 兔数 平均动脉压(mmHg)心率(/min)气道峰压(cmH2 O)气道平台压(cmH2 O)氧合指数(mmHg)VT10-2 6 105.4 ±6.9 202.9 ±15.8 12.4 ±1.3 9.5 ±1.1 459.3 ±25.8 VT10-4 6 100.2 ±8.8 200.2 ±16.4 13.3 ±1.2 9.6 ±1.2 425.1 ±33.2 VT10-6 6 95.4 ±9.1 194.5 ±18.2 14.6 ±1.1 11.3 ±1.5 418.6 ±26.6 VT20-2 6 100.4 ±6.5 193.4 ±16.8 20.1 ±1.8a 16.3 ±2.1a 339.7 ±28.8a VT20-4 6 96.1 ±8.3 190.2 ±17.1 22.3 ±2.2a 18.4 ±1.9a 295.2 ±23.4a VT20-6 5 91.4 ±7.1 174.5 ±18.3 27.6 ±2.5a 19.7 ±2.3a 228.2 ±22.7a VT40-2 5 97.5 ±6.6 188.2 ±17.3 29.1 ±2.8ac 18.2 ±2.0a 279.3 ±25.1ac VT40-4 4 85.2 ±7.1a 167.5 ±16.3a 32.4 ±2.6ac 22.6 ±2.6ac 220.1 ±24.2ac VT40-6 3 78.4 ±7.4ac 154.8 ±17.6a 39.5 ±3.2ac 26.7 ±3.9ac 188.7 ±20.5 ac

图1 呼吸机所致肺损伤家兔模型肺组织大体及肺组织病理学观察(HE×100)
2.4 肺湿干比、BALF蛋白含量、有核细胞总数及中性粒细胞计数 各组家兔的肺湿干比、BALF蛋白含量、有核细胞总数及中性粒细胞计数均随通气时间延长而升高,差异有统计学意义的组具体见表3。虽部分结果无统计学意义(P>0.05),但VT10-6、VT20-6、VT40-6亚组均显著高于同组内2 h亚组(P<0.05),VT40-6亚组显著高于 VT40-4亚组(P<0.05)。VT40-4亚组BALF蛋白含量、有核细胞总数及中性粒细胞计数显著高于VT10-4亚组及VT20-4亚组(P<0.05)。随潮气量加大,部分相同通气时间组间比较差异有统计学意义的组具体见表3。
表3 9组呼吸机所致肺损伤家兔模型检测指标比较(±s)

表3 9组呼吸机所致肺损伤家兔模型检测指标比较(±s)
组别 例数 肺湿干比值BALF蛋白含量(g/L)有核细胞总数(×109/L)中性粒细胞计数(×109/L)VT10-2 6 2.21±0.35 0.39±0.04 23.2±1.7 1.13±0.21 VT10-4 6 2.78±0.55 0.47±0.06a 25.2±2.2 1.44±0.19a VT10-6 6 3.77±0.75a 0.53±0.06a 27.2±2.7a 1.77±0.25a VT20-2 6 2.73±0.51 0.57±0.05c 34.6±3.7c 1.89±0.21c VT20-4 6 3.60±0.62ac 1.21±0.10ac 41.2±4.3ac 2.46±0.33ac VT20-6 5 4.00±0.67a 1.53±0.14ac 47.9±4.7ac 3.21±0.45ac VT40-2 5 3.54±0.76c 0.79±0.07ce 38.8±3.4ce 2.16±0.24ce VT40-4 4 4.32±0.78c 1.62±0.15ace 52.7±9.1ace 4.44±0.50ace VT40-6 3 4.94±0.78aceg 1.90±0.17aceg 61.2±9.6aceg 8.67±0.95 aceg
注:VT10-2、4、6:潮气量为10 ml/kg,通气时间为2、4、6 h;VT20-2、4、6:潮气量为 20 ml/kg,通气时间为 2、4、6 h;VT40-2、4、6:潮气量为 40 ml/kg,通气时间为 2、4、6 h;与同一潮气量组内2 h比较,aP<0.05;与 VT10组相同通气时间比较,cP <0.05;与 VT20 组相同通气时间比较,eP <0.05;与VT40-4组比较,gP <0.05
3 讨论
在临床上机械通气是危重患者救治过程中不可缺少的呼吸支持技术,ALI/ARDS是呼吸机使用的主要适应证。然而,机械通气如果使用不当也可诱发或加重肺损伤,即引发VILI,其发生率高达15%,甚至引发肺外多系统器官功能衰竭(MSOF)[2-3]。目前研究发现,过度通气的机械牵张可导致肺组织生物伤,加重肺损伤。有学者证明,机械通气相关性肺损伤是因高气道压和(或)高容量导致吸气末肺组织过度扩张和因呼气末肺容积过低使不张的终末小气道和肺泡随机械通气周期性地开放和关闭所致的肺机械性损伤[4]。此外,在肺机械性损伤的基础上肺内炎性细胞聚集和炎症递质释放进一步促进了机械通气相关性肺损伤的发生和发展[5]。因此,VILI表现形式多样,不仅表现为肺泡外气体,还包括肺泡上皮和血管内皮的广泛性破坏、肺水肿和肺不张等弥漫性肺损伤,在临床上VILI的防治已受到人们越来越多的关注。在临床疾病的研究中,由于临床病例资料(尤其是病理资料)收集存在一定的困难,故动物模型在研究ALI中发挥着不可替代的重要作用,但同时动物模型的复制也是ALI的研究的难点[6]。模型动物的可选择种类相当广泛,包括大鼠、小鼠、家兔、犬、猪、绵羊、山羊及灵长类动物等。家兔机体抵抗力较弱,性格温顺易操作,能够满足一定的采血量,且成本适中[7]。
目前认为大潮气量合并无呼吸末正压的通气是复制VILI最简单和有效的方法[8],致伤性通气造成肺损伤的严重程度取决于机械应力的强度和时间[8-10]。因此,本实验选择不同VT机械通气(VT10 ml/kg、20 ml/kg、40 ml/kg)、分别予不同通气时间(2 h、4 h、6 h),以期寻找一最佳的建立家兔VILI模型的通气条件。研究表明[11-12],正常家兔以 45 cmH2O的吸气峰压分别通气5、10、20 min,动物即可出现紧急致命的肺损伤。而相比之下,使用增加不大的VT通气,造成的肺部损伤是隐匿而缓慢的,动物能存活数小时至数天。由此可见,选择适度的致伤性通气方式是建立VILI模型的关键,致伤因素既不能引起动物的急进性死亡,又要在实验时间内足以造成典型的肺损伤。
本研究以肺组织病理学作为评价肺损伤程度的客观指标,以PaO2/FiO2<300 mmHg作为呼吸功能失代偿判断标准[13],在实验中由于吸入氧浓度保持不变,故动脉血PaO2的变化能间接反映肺功能的变化,结合其他相关肺损伤测定参数可综合评价VILI模型建立的成功与否。目前认为ALI/ARDS及VILI等均是由于损伤肺泡毛细血管膜导致的病理生理改变。故评价肺损伤的指标集中于以上的机制及病理改变,包括肺水肿液的重量测量、肺顺应性、影像学、组织学评价、肺泡及血管的渗透性改变及BALF中蛋白、促炎因子及炎症因子等,这些指标均与肺损伤后病情的严重程度呈一定的正相关关系[14-16]。本实验结果显示:VT10组在各时间点PaO2/FiO2保持稳定,与0 h比较均无显著差异。VT20和VT40组PaO2/FiO2随通气时间延长有下降趋势,其中VT20组通气4 h、6 h后PaO2/FiO2均<300 mmHg,VT40 组通气后2 h、4 h、6h 的 PaO2/FiO2值均<300 mmHg。VT10组肺组织肉眼及光镜下未见明显的改变。VT20组随着通气时间延长,可见一定程度的肺损伤,至通气6 h时,大体标本肉眼可见散在出血点,镜下主要表现为肺间隔增宽,炎性细胞浸润,肺泡腔少量渗出。而VT40组通气2 h后肺组织就出现轻度损伤改变,通气4 h损伤显著,大体标本可见点、片状出血,镜下见肺泡结构变形、间隔增宽及肺泡腔融汇,大量渗出,炎性细胞大量积聚,部分肺组织实变。这两项指标均充分说明在VT为20 ml/kg下通气6 h及40 ml/kg下通气4 h、6 h均可造模成功,相应的肺湿干比,BALF蛋白含量及BALF有核细胞总数和中性粒细胞计数这几个指标结果均可验证。
总之,综合动物死亡率、造模成本、病理切片效果等考虑,应该认为以VT40 ml/kg通气4 h为成功复制病变典型的呼吸机所致肺损伤家兔模型的最佳条件。
[1] Uhlig U,Uhlig S.Ventilation-induced lung injury[J].Compr Physiol,2011,1(2):635-661.
[2] Plataki M,Hubmayr R D.The physical basis of ventilator-induced lung injury[J].Expert Rev Respir Med,2010,4(3):373-385.
[3] Meade M O,Cook D J,Guyatt G H,et al.Ventilation strategy using low tidal volumes,recruitment maneuvers,and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome:a randomized controlled trial[J].JAMA,2008,299(6):637-645.
[4] Haitsma J J.Physiology of mechanical ventilation[J].Crit Care Clin,2007,23(2):117-134.
[5] De Prost N,Dreyfuss D.How to prevent ventilator-induced lung injury?[J].Minerva Anestesiol,2012,78(9):1054-1066.
[6] Michael A M,Guy A Z,Charles E,et al.Future research directions in acute lung injury:summary of a National Heart,Lung and Blood Institute Working Group[J].Am J Respir Crit Care Med,2003,167(7):1027-1035.
[7] 李新甫,汪建新.急性肺损伤动物模型研究进展[J].国外医学呼吸系统分册,2005,25(7):507-508.
[8] 安莉,周美玲,秦雪冰,等.呼吸机所致肺损伤家兔模型的建立与评价[J].中国呼吸与危重监护杂志,2010,3(9):161-167.
[9] Copland I B,Post M.Stretch-activated signaling pathways responsible for early response gene expression in fetal lung epithelial cells[J].J Cell Physiol,2007,210(1):133-143.
[10] Torsten S,Christian N,Barbara S,et al.A novel model of selective lung ventilation to investigate the long-term effects of ventilation-induced lung injury[J].Shock,2006,26(1):50-54.
[11]Dreyfuss D,Ricard J D,Saumon G.On the physiologic and clinical relevance of lung-bome cytokines during ventilator-induced lung injury[J].Am J Respir Crit Care Med,2003,167(11):1467-1471.
[12] De Prost N,Ricard JD,Saumon G,et al.Ventilator-induced lung injury:historical perspectives and clinical implications[J].Ann Intensive Care,2011(1):28.
[13] Bernard GR,Artigas A,Brigham K L,et al.The American-European Consensus Conference on ARDS.Definitions,mechanisms,relevant outcomes,and clinical trial coordination[J].Am J Respir Crit Care Med,1994,149(3pt1):818-824.
[14] Walker M G,Yao L J,Patterson E K,et al.The effect of tidal volume on systemic inflammation in Acid-induced lung injury[J].Respiration,2011,81(4):333-342.
[15] Drummond G B.What is an adequate measure of lung function?[J].Br JAnaesth,2012,109(6):1006-1007.
[16] Akashita A,Nishimura Y,Nishiuma T,et al.Neutrophil elastase inhibitor(sivelestat)attenuates subsequent ventilator-induced lung injury in mice[J].Eur J Pharmacol,2007,571(1):62-71.

