细胞周期素G1与三阴乳腺癌不良预后关系的研究
韩 涛,刘兆喆,郭 放,韩雅玲,谢晓冬
乳腺癌在我国发病率位居女性恶性肿瘤之首,病死率仅次于肺癌,其发生发展是多因素参与并相互作用的复杂过程[1]。涉及癌细胞本身、癌细胞与癌周微环境及宿主免疫状态的多因素异常参与了乳腺癌的不良预后。国内外研究发现不少的癌基因、生长因子等与乳腺癌细胞复发转移密切相关,可能成为乳腺癌的预后判断指标[2]。但因传统的临床预后指标有其自身的局限性,尚不能完全反映乳腺癌的生物学特性。随分子生物学技术的发展,乳腺癌发生发展的分子机制被逐步阐明,寻找相关标志物和干预靶点一直以来都是乳腺癌研究的热点。细胞周期素 G1(cyclin G1)基因是1993年 Tamura等[3]在鼠成纤维细胞中寻找新的Src家族成员过程中发现的,定位于染色体5q32-q34区域。有6个外显子,其cDNA 长约3.17 kb[4]。作为一种新的细胞周期素,cyclin G1 通过与 MDM2[5]、PP2A[6]等分子相互作用,参与了细胞多种生物学过程,如细胞周期和增殖[7-9]、DNA 损伤修复[10]、细胞凋亡[9,11-12]等。更重要的是,cyclin G1与抑癌基因p53关系密切,cyclin G1与p53结合,形成交互负反馈调节,提示该分子的异常表达可能在肿瘤发生发展中起到了重要作用。近年来研究证实,cyclin G1高表达对成骨肉瘤细胞、结肠癌细胞、伯基特淋巴瘤等肿瘤细胞的生长有促进作用,并且与急性淋巴细胞白血病、慢性粒细胞白血病等恶性血液病密切相关[13-15]。本研究主要分析乳腺癌中cyclin G1的表达及其临床意义,同时我们在此基础上也初步评价了cyclin G1作为乳腺癌预后指标和干预靶点的价值,现报告如下。
1 材料与方法
1.1 临床资料和标本收集 收集2003年1月—2008年10月,沈阳军区总医院的78例女性乳腺癌手术切除冰冻组织、石蜡标本及患者的相关临床病理资料。患者29~83岁,中位年龄49岁,术前均未进行任何放化疗及生物治疗,术后病理诊断均为浸润性乳腺癌,随访120个月,中位生存时间101个月。在这78例乳腺癌组织中随机选取22例乳腺癌及其癌旁组织抽提RNA,反转录成cDNA,进行转录水平的分析实验。
1.2 主要抗体及试剂 兔抗人cyclin G1多克隆抗体(Santa Cruz公司);甲醇(上海试剂一厂,AR);无水乙醇(上海试剂一厂,AR);Syrb green(QIAGEN公司)。
1.3 仪器设备 荧光实时定量PCR仪(Applied Biosystems公司),免疫组化石蜡包埋机和免疫组化制片仪(Leica公司)。
1.4 实时荧光定量PCR(Realtime RT-PCR)检测Realtime RT-PCR检测乳腺癌及癌旁组织中cyclin G1 mRNA的表达,将上述组织碾碎分装在1.5 ml Ep管中,用TRIzolⓇreagent收集组织,据试剂说明的步骤抽提RNA并做反转录,得到cDNA用于荧光定量PCR检测。目的基因的相对表达量经内参标化后分析。最终获得其相对定量值,用癌减去癌旁的相对定量值取对数。使用的引物由上海生工生物技术有限公司合成。cyclin G1上游引物序列:5'-AAGCAGCTCAGTCCAACACA-3';cyclin G1下游引物序列:5'-TGGCTTTGACACAGAGACATTT-3',以人β-actin作为内参,引物的上游序列:5'-GGCATCGTGATGGACTCCG-3',下游序列:5'-GCTGGAAGGTGGACAGCGA-3。PCR扩增条件:94℃预变性10 min,94℃变性30 s,60℃退火30 s,72℃延伸60 s,72℃延伸30 s,40个循环,72℃终末延伸10 min。
1.5 免疫组织化学染色及结果判定 所有标本均行4 mm连续切片,石蜡包埋,应用cyclin G1多抗进行免疫组化SP法染色。具体操作步骤:石蜡切片脱蜡至水,3%过氧化氢室温孵育10 min,以清除内源性过氧化物酶的活性;抗原微波热修复3 min,抗原修复液为pH 6.0柠檬酸缓冲液;3.5% ~10%正常山羊血清封闭非特异性位点,室温孵育10 min;倾去血清,滴加cyclin G1一抗工作液,37℃孵育过夜;滴加生物素标记的二抗工作液,湿盒中孵育20 min;滴加辣根过氧化物酶标记的链霉卵白素工作液,湿盒中孵育20 min。上述步骤之间均用0.01 M PBS(pH=7.4)冲洗。进行DAB染色,自来水冲洗、苏木素复染细胞核、封片。结果判定:细胞胞浆或细胞膜呈清晰黄褐色颗粒为阳性表达。高倍镜(×400)下随机观察5个视野,根据阳性细胞百分率和染色强度进行半定量分析,染色强度:无染色0分,染色弱但强于阴性对照记1分,染色清晰记2分;阳性细胞数 <10%记0分,10% ~25%记1分,25% ~50%记2分,>50%记3分。两项指标积分之和0~1分为阴性病例(-),1~2分为弱阳性病例(+),2~3分为阳性病例(++),≥3分为强阳性病例(+++)。由两位病理科医师双盲法计数,差异超过10%需重新计数[16]。
1.6 统计分析方法 应用SPSS 18.0软件进行数据分析。计量资料的均数比较采用t检验,计数资料的生存分析采用Kaplan-Meier法,生存率的比较采用Log rank检验。将单因素分析中有意义的各变量用向后逐步回归法进行Cox比例风险模型分析。α=0.05为检验水准。
2 结果
2.1 cyclin G1在乳腺癌组织及其癌旁组织中的表达情况 组织学水平上检测了78例乳腺癌及其癌旁组织中cyclin G1的表达情况,见图1,cyclin G1在乳腺癌中的表达评分为(1.93±0.77)分,显著高于癌旁组织中的表达评分(1.31±0.67)分,差异有统计学意义(P <0.01)。
2.2 Realtime-PCR实验 cyclin G1在18例乳腺癌中的表达(81.8%)高于癌旁组织中的表达,见图2,其中癌组织中cyclin G1表达为3.62±1.64,癌旁组织中cyclin G1表达为2.96±1.93,两组比较差异有统计学意义(P <0.01)。
2.3 cyclin G1的表达与临床病理特征 以本组乳腺癌组织中cyclin G1表达评分的中位数为界值(中位数为2),高于此界值定义为cyclin G1高表达组,低于此界值定义为cyclin G1低表达组。cyclin G1高、低表达组的临床特征如下表1,三阴乳腺癌患者主要集中在cyclin G1高表达组(93.3%),其中高表达组中cyclin G1表达量为2.52±0.44,低表达组中cyclin G1 表达量为1.32±0.54,cyclin G1 高低两组间具有统计学差异(P<0.05)。

图1 细胞周期素G1在乳腺癌组织及其癌旁组织中的表达(DAB×200) A.乳腺癌;B.癌旁组织
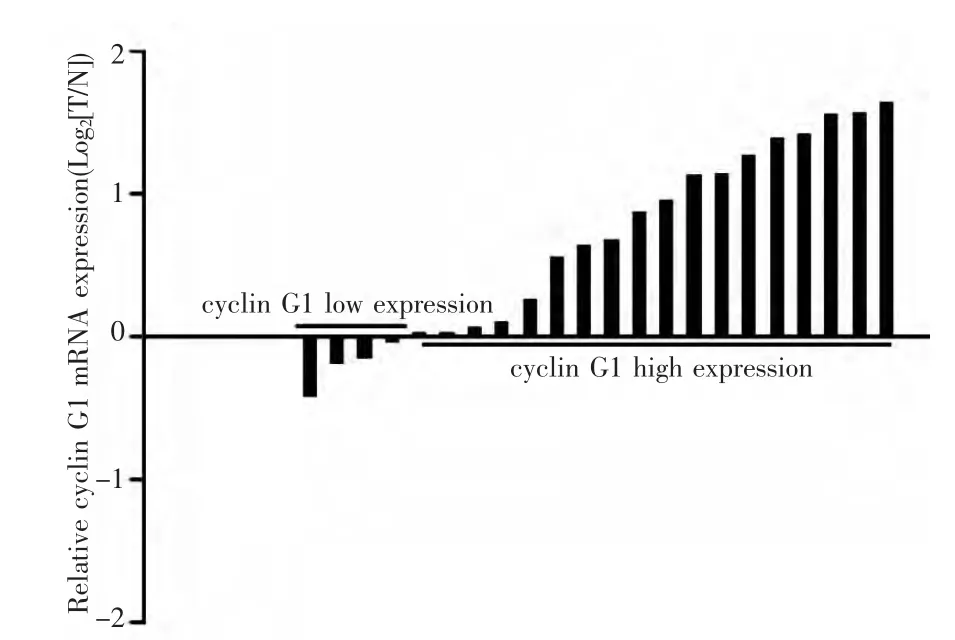
图2 细胞周期素G1在22例乳腺癌组织中的表达
2.4 cyclin G1表达和预后生存时间 乳腺癌组织中cyclin G1低表达者与高表达者相比,其5年总体生存率有显著统计学差异(P<0.05),见图3。cyclin G1高表达组生存期为(81.282±38.782)个月,低表达组生存期为(95.538±30.783)个月,乳腺癌组织中cyclin G1表达越高,预后越差。
2.5 cyclin G1表达与三阴乳腺癌的生存分析 将cyclin G1的表达与乳腺癌是否三阴进行联合分析发现cyclin G1高表达的三阴乳腺癌患者预后最差(中位生存期49个月),cyclin G1低表达的三阴乳腺癌患者和cyclin G1高表达的非三阴乳腺癌患者预后也较差,cyclin G1低表达的非三阴乳腺癌预后最好(中位生存期117个月)。总之,cyclin G1高表达的三阴乳腺癌患者、cyclin G1低表达的三阴乳腺癌患者、cyclin G1高表达的非三阴乳腺癌患者、cyclin G1低表达的非三阴乳腺癌患者预后之间进行多重比较均具有统计学差异(P<0.05),见图4。
2.6 cyclin G1表达与预后 通过Chi-square检验对影响乳腺癌患者总体生存期的临床各种指标行单因素分析,结果如表2所示;通过单因素分析筛选出对乳腺癌总体生存期有意义的变量纳入多因素分析,通过建立Cox比例风险模型进行统计,提示乳腺癌中cyclin G1表达对于总体生存率为独立的预后因子,乳腺癌组织中cyclin G1高表达者相对cyclin G1低表达者对于总体生存率的相对危险度HR=2.837,95%可信区间为1.196 ~6.728,P=0.02。

表1 细胞周期素G1高、低表达组乳腺癌的临床特征[例(%)]
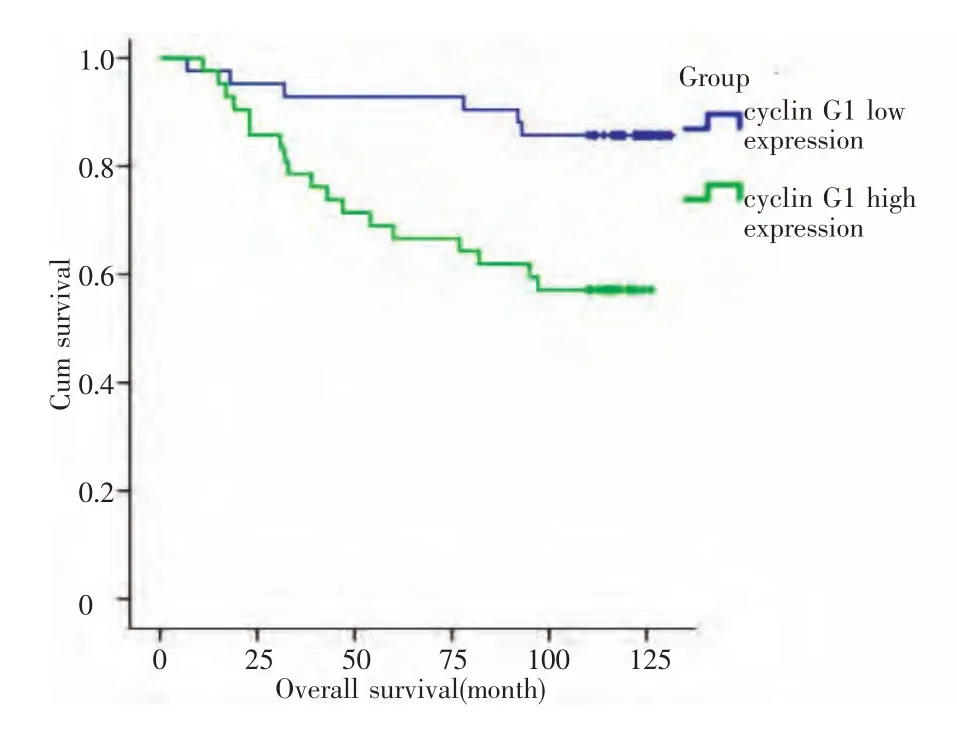
图3 细胞周期素G1的表达与乳腺癌预后的相关性分析

图4 细胞周期素G1的高低表达与是否为三阴乳腺癌联合分析对预后的影响

表2 变量的单因素分析和多因素分析
3 讨论
乳腺癌在发达国家居女性肿瘤第一位[17],新研究提示某些癌基因及受体的表达不仅能够判定乳腺癌的预后,而且对指导乳腺癌治疗具有重要意义。cyclin G1是发现较晚的一类细胞周期蛋白,被报道可以和 MDM2[5],PP2A[6]等分子相互作用,广泛参与了细胞多种病理生理过程,在细胞凋亡、周期调控和DNA损伤修复等过程发挥重要作用。一系列研究发现,cyclin G1在多种肿瘤的发生发展过程中发挥了重要的作用,cyclin G1的高表达对成骨肉瘤细胞、结肠癌细胞、淋巴瘤细胞的生长有促进作用,另外其与急性淋巴细胞白血病、慢性粒细胞白血病等血液系统恶性肿瘤有关。最新的研究表明,cyclin G1还参与调控肝癌细胞的上皮间质转化和复发转移的过程[18],并对肝癌起始细胞起到了促进和维持作用[19]。尽管cyclin G1已被证明是重要的肿瘤调节蛋白,但是其在乳腺癌中的表达及和乳腺癌患者预后的关系国内外尚无任何报道。本研究首先在78例乳腺癌和癌旁组织中进行组织学检测并在22例乳腺癌和癌旁组织中进行cyclin G1的转录水平检测,结果均支持cyclin G1在乳腺癌中表达显著高于癌旁组织中的表达,这提示我们cyclin G1有可能在乳腺癌发生发展中发挥重要癌基因的作用。
在前期实验的基础上我们又进一步分析了cyclin G1的表达和乳腺癌患者预后的关系,通过生存分析发现,乳腺癌组织中cyclin G1表达和预后呈负相关,cyclin G1高表达者与低表达者相比,其5年总体生存率明显降低,结果具有显著统计学差异(P<0.05)。据研究显示,按照激素受体分子分型,乳腺癌中还存在一种特殊的亚型,三阴乳腺癌[20],即ER、PR、HER-2表达均为阴性的乳腺癌,约占乳腺癌的15%,因其浸润性较强、缺乏内分泌及分子靶向治疗常常与复发转移率高、生存时间短等不良预后相关[21-22]。我们在研究中着重分析了cyclin G1分子在三阴乳腺癌和非三阴乳腺癌中的表达变化,结果显示cyclin G1在三阴乳腺癌中表达明显高于非三阴乳腺癌,这提示cyclin G1有可能参与了三阴乳腺癌细胞的恶性生物学行为。而当我们将cyclin G1与三阴乳腺癌联合起来对乳腺癌预后进行分析判断时发现cyclin G1高表达的三阴乳腺癌患者预后最差,cyclin G1低表达的三阴乳腺癌患者和cyclin G1高表达的三阴乳腺癌患者预后也较差,cyclin G1低表达的非三阴乳腺癌预后最好;这提示cyclin G1的表达与乳腺癌是否三阴相结合判断可以显著提高乳腺癌的预后判断效果。
综上所述,本研究探讨了cyclin G1与乳腺癌表达及预后的关系,从基因水平和组织学水平检测了乳腺癌样品中cyclin G1的表达情况,并结合乳腺癌患者的预后随访资料分析临床样本中cyclin G1的表达情况与预后的关系,并进一步分析cyclin G1与三阴乳腺癌的预后联合判断效果。为cyclin G1作为临床上乳腺癌预后判断指标和治疗靶点奠定理论基础,并为乳腺癌患者的个体化治疗和预后判断提供重要的理论意义和潜在临床应用价值。
[1] 郑莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-569.
[2] 冯继锋,马唐,吴曹王.乳腺癌复发转移与基因表达的相关性研究[J].中华肿瘤防治杂志,2010,17(24):2001-2003.
[3] Tamura K,Kanaoka Y,Jinno S,et al.Cyclin G1:a new mammalian cyclin with homology to fission yeast Cig1[J].Oncogene,1993,8(8):2113-2118.
[4] Okamoto K,Beach D.Cyclin G is a transcriptional target of the p53 tumor suppressor protein[J].EMBO J,1994,13(5):4816-4822.
[5] Kimura SH,Nojima H.Cyclin G1 associates with MDM2 and regulates accumulation and degradation of p53 protein[J].Genes Cells,2002,7(8):869-880.
[6] Okamoto K,Li H,Jensen M R,et al.Cyclin G recruits PP2A to dephosphorylate Mdm2[J].Mol Cell,2002,9(7):761-771.
[7] Jia S,Zhao L,Tang W,et al.The gain of function of p53 mutant p53S in promoting tumorigenesis by crosstalking with H-RasV12[J].Int J Biol Sci,2012,8(5):596-605.
[8] Smith M L,Kontny H U,Bortnick R,et al.The p53-regulated cyclin G gene promotes cell growth:p53 downstream effectors cyclin G and Gadd45 exert different effects on cisplatin chemosensitivity[J].Exp Cell Res,1997,230(1):61-68.
[9] Zhao L,Samuels T,Winckler S,et al.Cyclin G1 has growth inhibitory activity linked to the ARF-Mdm2-p53 and pRb tumor suppressor pathways[J].Mol Cancer Res,2003,1(3):195-206.
[10] Bates S,Rowan S,Vousden K H.Characterisation of human cyclin G1 and G2:DNA damage inducible genes[J].Oncogene,1996,13(5):1103-1109.
[11] Okamoto K,Prives C.A role of cyclin Gin the process of apoptosis[J].Oncogene,1999,18(32):4606-4615.
[12]Kato M V,Sato H,Anzai H,et al.Up-regulation of cell cycle-associated genes by p53 in apoptosis of an erythroleukemic cell line[J].Leukemia,1997,11(3):389-392.
[13]Hosokawa Y,Arnold A.Mechanism of cyclin D1(CCND1,PRAD1)overexpression in human cancer cells:analysis of allele-specific expression[J].Genes Chromosomes Cancer,1998,22(1):66-71.
[14] Arber N,Hibshoosh H,Yasui W,et al.Abnormalities in the expression of cell cycle-related proteins in tumors of the small bowel[J].Cancer Epidemiol Biomarkers Prev,1999,8(12):1101-1105.
[15] Endo Y,Fujita T,Tamura K,et al.Structure and chromosomal assignment of the human cyclin G gene[J].Genomics,1996,38(1):92-95.
[16]谢晓冬,屈淑贤,郑振东.人乳腺癌组织中D2-40标记的微淋巴管密度与血管内皮生长因子C表达的关系[J].中华肿瘤杂志,2008,30(2):356-360.
[17]陈万青,郑荣寿,曾红梅,等.1989-2008年中国恶性肿瘤发病趋势分析[J].中华肿瘤杂志,2012,34(7):256-264.
[18] Wen W,Ding J,Sun W,et al.Cyclin G1-mediated epithelial-mesenchymal transition via phosphoinositide 3-kinase/Akt signaling facilitates liver cancer progression[J].Hepatology,2012,55(6):1787-1798.
[19] Wen W,Tao H,Cheng C,et al.Cyclin G1 Expands Liver Tumor-Initiating Cells by Sox2 Induction via Akt/mTOR Signaling[J].Mol Cancer Ther,2013,12(9):1796-1804.
[20]Rakha E A,Ellis I O.Triple-negative/basal-like breast cancer:review[J].Pathology,2009,41(1):40-47.
[21]Yagata H,Kajiura Y,Yamauchi H.Current strategy for triple-negative breast cancer:appropriate combination of surgery,radiation,and chemotherapy[J].Breast Cancer,2011,18(3):165-173.
[22]De Laurentiis M,Cianniello D,Caputo R,et al.Treatment of triple negative breast cancer(TNBC):current options and future perspectives[J].Cancer Treat Rev,2010,36(3):80-86.

