对比三阴和HER-2阳性乳腺癌新辅助化疗中病理完全缓解率的荟萃分析
章国晶,刘兆喆,徐 龙,郭 放,张冠中,韩雅玲,谢晓冬
三阴乳腺癌(triple-negative breast cancer,TNBC)[1]和人表皮生长因子受体 2(human epidermal growth factor receptor-2,HER-2)阳性乳腺癌是乳腺癌中生物学行为极其特殊的两个亚型,前者以雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER-2表达均阴性为特征,约占所有乳腺癌的15%[2-3],后者以ER、PR阴性以及HER-2过度表达为特征,占所有乳腺癌的20%[4-5]。TNBC因浸润性较强易发生远处器官转移,HER-2阳性乳腺癌则易发生淋巴结转移并可降低ER的表达,增加对激素治疗的耐受性,故这两类乳腺癌均与不良预后相关[6-8]。新辅助化疗(neoadjuvant chemotherapy,NAC)在乳腺癌的系统治疗中得到越来越广泛的应用,研究者发现TNBC对NAC具有高化疗敏感性,通常情况下较其他类型乳腺癌更易获得病理完全缓解(pathological complete response,pCR)率,是乳腺癌中pCR率最高的亚型[9]。然而,近年发表的一些文献显示TNBC在NAC中获得的pCR率波动幅度极大[10-11]。同时,在部分研究中,HER-2阳性患者获得的pCR率高于包括TNBC在内的其他乳腺癌[12]。乳腺癌分子分型对NAC疗效的预测作用可直接提示患者的预后并指导临床治疗策略制定。此荟萃分析通过比较TNBC组和HER-2阳性组乳腺癌患者在NAC中获得的pCR情况,评估这两种乳腺癌亚型在NAC中的化疗敏感性,为循证医学提供更为确切的数据。
1 材料与方法
1.1 文献检索 应用计算机检索PubMed和Cochrane Collaboration数据库。TNBC的概念于2006年正式为学界所接受[13],故PubMed上的检索时间限定为2006年1月—2011年12月。在PubMed中的检索词如下:(breast cancer)AND(neoadjuvant)AND(pathological complete response),上述检索词的同义词 breast carcinoma、preoperative、pathologic response、pathological complete remission 与之并列检索。所有纳入文献均为已出版的英文文献。同时,我们检索Cochrane Collaboration数据库中对比TNBC与HER-2阳性乳腺癌新辅助化疗pCR率的随机对照临床试验。
1.2 纳入标准 ①文献报道的病例经病理证实为乳腺癌;②患者在接受NAC治疗前未接受手术、放疗、内分泌治疗及其他任何抗肿瘤的化学药物治疗;③患者病理分期为T1~4、N0~4、M0或Ⅰ-Ⅲ期;④患者激素受体类型以及HER-2状态经免疫组化(immunohistochemical,IHC)、荧光原位杂交(fluorescent in situ hybridization,FISH)或原位杂交(in situ hybridization,ISH)技术得到确认;⑤文献中提供TNBC和HER-2阳性乳腺癌组的总人数、获得pCR人数。
目前TNBC尚缺乏系统的分子靶向治疗手段,对于在TNBC组NAC方案中加入分子靶向药物的文献,我们将其纳入,但只提取接受化学药物治疗组的病例信息以避免不同种类治疗造成的异质性。
1.3 质量评价和数据提取 对随机对照临床试验的质量评价参照Jadad等[14]提出的方法。对预后研究的质量评价,目前尚无统一的标准,本研究根据Hayden等[15]于2006年制定的预后研究质量评价标准,从以下6个方面评价研究质量:研究对象、减员偏倚、预后因素测量、结果测量、混杂因素测量和统计学分析,其中0~1、2~3、4~6个方面叙述不详的文献质量评价分别为高、中、低。在纳入文献中提取以下数据:第一作者姓名、出版年月、NAC方案、病例的TNM分期以及TNBC和HER-2阳性组的pCR情况。
1.4 统计学方法 应用相对危险度(RR)和95%置信区间(CI)评估NAC中TNBC组和HER-2阳性组患者获得pCR率。在异质性较小的情况下,对各个研究数据应用固定效应模型进行合并和评估,否则应用随机效应模型合并数据。所有纳入文献根据样本量的大小进行加权,异质性由q检验和卡方检验完成,q检验P<0.05或卡方检验Ⅰ2>50%时认为异质性明显。潜在的发表偏倚用倒漏斗图和失安全系数来检测,纳入文献数量>5篇的分析中同时应用倒漏斗图和失安全系数显示RR与pCR率之间的关系,纳入文献数量<5篇的分析则只应用失安全系数检测。
森林图和倒漏斗图均由Review Manager(version 4.2.2 for Windows;Cochrane Collaboration,Oxford)软件制作所得。失安全系数通过MIX(version 1.7 for Windows;BMW Medical Research Methodology 2006)软件计算。
2 结果
2.1 纳入文献 PubMed和Cochrane Collaboration中检索结果分别为591和42篇文献,排除29篇重复文献,计算机检索结果为604篇文献。通过阅读文献的标题和摘要,我们分别排除了232和217篇与本研究相关性较小的文献,并进一步分析其余155篇文献的全文,最终纳入11篇文献[16-26]。Bauer等[27]报道一项TNBC应用NAC的回顾性研究,由于在治疗方案中合并应用了放疗,为降低Meta分析的异质性,未将此研究纳入。在纳入文献的参考文献中没有找到符合纳入标准的新文献。
2.2 纳入文献的主要特点 11篇纳入文献同时提供了TNBC组与HER-2阳性组患者获得pCR的情况,发表时间从2007—2012年,其中随机性临床试验2项,预后性研究9项,总数量为1076例,包括TNBC 577例及HER-2阳性499例,二组平均pCR率分别为28.2%与20.0%。在纳入本研究的文献报道中,除了个别样本量较小的研究,TNBC患者在不含分子靶向药物的NAC方案中获得pCR比率波动于17.0% ~48.3%(保留小数点后一位)之间,HER-2阳性乳腺癌患者获得pCR比率则波动于5.3% ~22.6%。纳入文献的主要特点见表1。
2.3 TNBC与HER-2阳性患者pCR率的比较 应用RR对比TNBC组与HER-2阳性组的pCR率,由各文献数据所得的个体RR值为0.87~11.40(图1),总体合并RR值为1.62,95%置信区间(confi-dence interval,CI):1.30 ~2.03。文献之间未发现明显异质性(Ⅰ2=15.9%,χ2=11.88,P=0.29),故使用固定效应模型。漏斗图见图2,各点大致均匀分布于垂直线两侧,左下角出现空缺,提示可能存在潜在的发表偏倚,但发表偏倚并不明显。失安全系数计算结果为63,数值较大,提示无确切证据证实发表偏倚的存在。综合漏斗图与失安全系数的结果,说明所纳入文献无明显发表偏倚。其中5篇文献提供了未接受曲妥珠单抗治疗的HER-2阳性患者的pCR率,应用RR将TNBC组pCR率与其对比,个体RR值波动于1.55~11.40(图3),总体合并RR为2.40,95%CI为1.55~3.70。根据异质性检验结果:Ⅰ2=21.1%、χ2=5.07、P=0.28,文献间无明显异质性,故应用固定效应模型。失安全系数38,提示文献无明显发表偏倚。

表1 三阴和人表皮生长因子受体2阳性乳腺癌新辅助化疗中病理完全缓解率的Meta分析纳入文献的主要特点
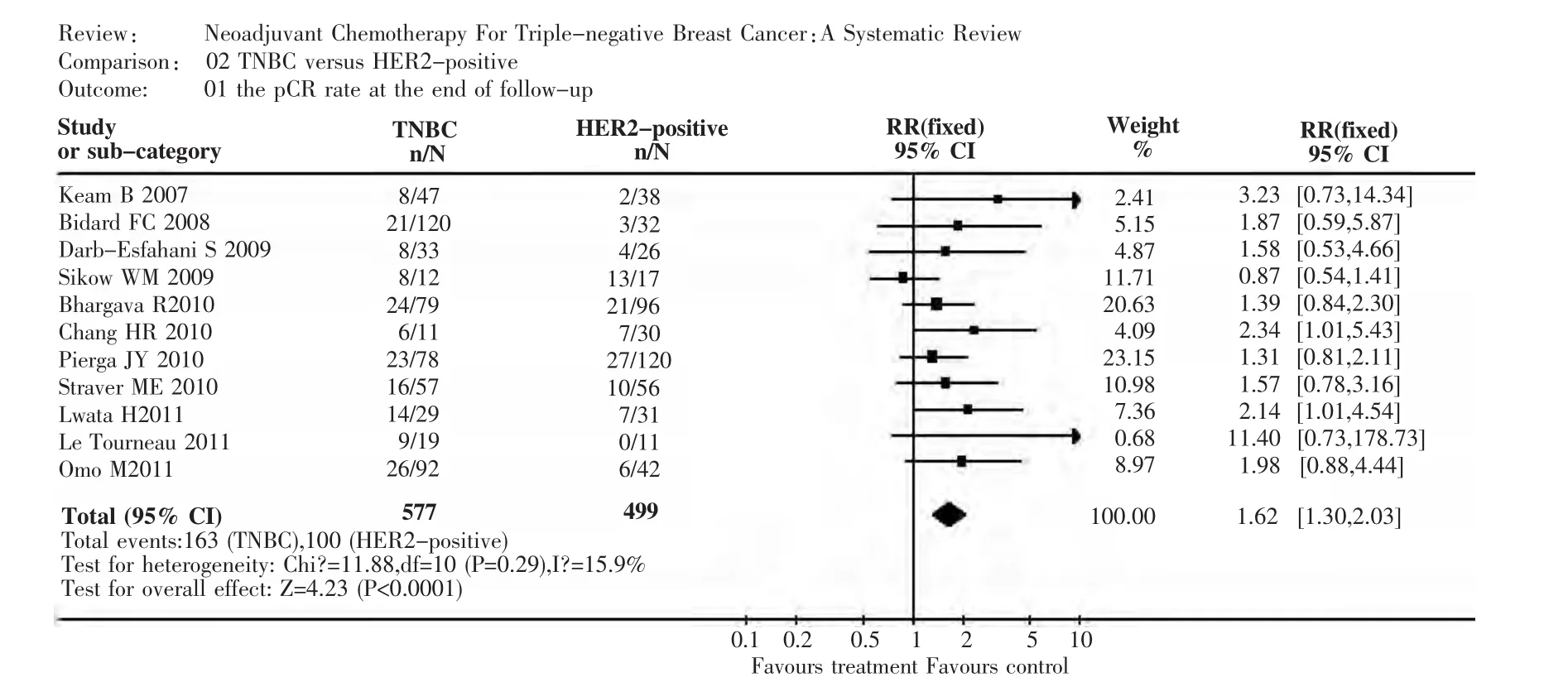
图1 三阴乳腺癌与人表皮生长因子受体2阳性两组病理完全缓解率对比分析森林图
3 讨论
NAC近年来广泛地应用于乳腺癌的系统治疗,不仅可降低肿瘤分期,使部分需要全乳腺切除的病例有机会接受保乳手术治疗,同时在增强肿瘤组织化疗反应率方面具有显著的治疗效力,提示不同组织分型和病理状态的乳腺癌个体对化疗药物的敏感性和反应率,指导了术后治疗方案的选择[28-30]。
目前TNBC尚缺乏行之有效的分子靶向治疗药物,而HER-2阳性乳腺癌则对曲妥珠单抗、lapatinib及其他相关分子靶向药物具有潜在的敏感性。在部分有关NAC的报道中,HER-2阳性组患者获得最高的pCR率,高于包括TNBC在内的其他类型乳腺癌。在本研究中,11篇文献将HER-2阳性组与TNBC组患者的pCR率进行了对比,发现TNBC组获得pCR的病例数量较HER-2阳性组高62%。临床试验证实相比单纯细胞毒性药物组成的NAC方案,联合应用曲妥珠单抗可明显提高HER-2阳性患者的pCR率[31-33]。本研究纳入的TNBC患者均只接受细胞毒性药物治疗,为避免分子靶向药物造成的异质性,我们提取了5篇不加入曲妥珠单抗治疗HER-2阳性患者的文献,这项分析结果显示TNBC组获得的pCR率明显高于HER-2阳性组,提示TNBC具有更高的化疗敏感性,同时也证实在HER-2阳性乳腺癌的NAC中加入曲妥珠单抗可提高治疗效力。
相比其他类型的乳腺癌,TNBC虽可在NAC中获得更高的pCR率,但往往复发转移率高、生存期短,故NAC对TNBC的综合治疗效力仍存在争议。有研究者推测TNBC本身恶性程度较高,增殖相关基因高表达、核分级更高、易侵犯脉管是导致此亚型乳腺癌具有高化疗敏感性但预后较差的原因[34],同时这类乳腺癌缺乏内分泌治疗手段,故大量研究认为TNBC尽管可在NAC中获得较高的pCR率,但总体预后较差,这也是NAC在临床应用中受限的重要原因。一项Meta分析证实在NAC中获得pCR是延长总生存期、无病生存期及无复发生存期的独立预后因素[35]。如果疗效达到pCR,TNBC患者可获得与非TNBC患者类似的生存情况,而若未能在NAC中获得pCR的TNBC患者,其预后往往不佳,比较同样未获得pCR的非TNBC患者,其复发和转移概率明显增高,生存期明显缩短[7,36]。故在 TNBC 中寻找适合NAC治疗的人群才是提高预后的重点。

图3 三阴乳腺癌与未接受曲妥珠单抗治疗的人表皮生长因子受体2阳性两组病理完全缓解率对比森林图
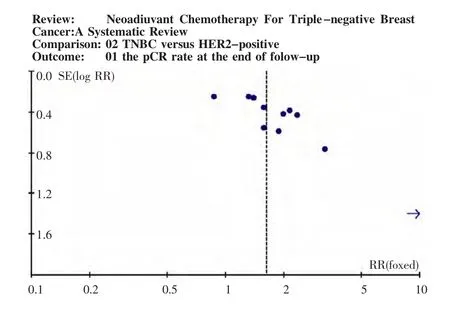
图2 三阴乳腺癌与人表皮生长因子受体2阳性两组病理完全缓解率对比分析漏斗图
Laurentiis 等[37]研 究 者 认 为 根 据 BRCA1、BRCA2等生物标志物不同的表达情况,可将TNBC分为两个亚组:高化疗敏感性组(highly chemosensitive group)和化疗抗拒组(chemoresistant group),前者对紫杉类、铂类等标准细胞毒性药物治疗显示较高的反应率,较化疗抗拒组TNBC更易在NAC中获得pCR。目前,学术界正在应用其他一些生物标志物来提示和判断TNBC的化疗敏感性和预后,如YB-1、bcl-2、COX-2、CK5/6、Ki-67 和 p53 等。由于上述生物标志物在区分TNBC化疗敏感性方面的作用可直接指导TNBC化疗方案的制定、延长TNBC患者的生存,故该方面的深入研究值得学术界广泛关注。
[1] 三阴与非三阴乳腺癌相比瘤体内VEGF水平越高患者生存期越短[J].中国医药科学,2011,1(10):8.
[2] Conte P,Guarneri V.Triple-negative breast cancer:current management and future options[J].EJC,2009,7(S1):14-18.
[3] 蓝莉,欧传活,闭永浩.三阴性乳腺癌的临床病理特征及治疗进展[J].中国医药科学,2011,1(13):47-48.
[4] Jelovac D,Emens L A.HER2-directed therapy for metastatic breast cancer[J].Oncology(Williston Park),2013,27(3):166-175.
[5] 崔树德.Her-2在新辅助化疗乳腺癌中的表达及预后意义[J].中国煤炭工业医学杂志,2003,6(11):1088-1089.
[6] Bauer K R,Brown M,Cress R D,et al.Descriptive analysis of estrogen receptor(ER)-negative,progesterone receptor(PR)-negative,and HER2-negative invasive breast cancer,the so-called triple-negative phenotype.A population-based study from the California Cancer Regis-try[J].Cancer,2007,109(9):1721-1728.
[7] Heitz F,Harter P,Traut A,et al.Cerebral metastases(CM)in breast cancer(BC)with focus on triple-negative tumors[J].J Clin Oncol,2008,26(15S):1010.
[8] Vaz-Luis I,Winer E P,Lin N U.Human epidermal growth factor receptor-2-positive breast cancer:does estrogen receptor status define two distinct subtypes?[J].Ann Oncol,2013,24(2):283-291.
[9] Liedtke C,Mazouni C,Hess K R,et al.Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer[J].J Clin Oncol,2008,26(8):1275-1281.
[10] Bernsdorf M,Ingvar C,Jörgensen L,et al.Effect of adding gefitinib to neoadjuvant chemotherapy in estrogen receptor negative early breast cancer in a randomized phase II trial[J].Breast Cancer Res Treat,2011,126(2):463-470.
[11] Medioni J,Huchon C,Le Frere-Belda M A,et al.Neoadjuvant dose-dense gemcitabine plus docetaxel and vinorelbine plus epirubicin for operable breast cancer:improved prognosis in triple-negative tumors[J].Drugs R D,2011,11(2):147-157.
[12]Chen X S,Nie X Q,Chen CM,et al.Weekly paclitaxel plus carboplatin is an effective nonanthracycline-containing regimen as neoadjuvant chemotherapy for breast cancer[J].Ann Oncol,2010,21(5):961-967.
[13] Bryan B B,Schnitt SJ,Collins L C.Ductal carcinoma in situ with basal-like phenotype:a possible precursor to invasive basal-like breast cancer[J].Mod Pathol,2006,19(5):617.
[14]Jadad A R,Moore R A,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary?[J].Control Clin Trials,1996,17(1):1-12.
[15] Hayden JA,CôtéP,Bombardier C,et al.Evaluation of the quality of prognosis studies in systematic reviews[J].Ann Intern Med,2006,144(6):427-437.
[16] Keam B,Im SA,Kim H J,et al.Prognostic impact of clinicopathologic parameters in stage Ⅲ/Ⅲ breast cancer treated with neoadjuvant docetaxel and doxorubicin chemotherapy:paradoxical features of the triple negative breast cancer[J].BMCCancer,2007,7:203.
[17]Bidard F C,Matthieu M C,Chollet P,et al.p53 status and efficacy of primary anthracyclines/alkylating agentbased regimen according to breast cancer molecular classes[J].Ann Oncol,2008,19(7):1261-1265.
[18] Darb-Esfahani S,Loibl S,Müller B M,et al.Identification of biology-based breast cancer types with distinct predictive and prognostic features:role of steroid hormone and HER2 receptor expression in patients treated with neoadjuvant anthracycline/taxane-based chemotherapy[J].Breast Cancer Res,2009,11(5):69.
[19] Sikov W M,Dizon D S,Strenger R,et al.Frequent pathologic complete responses in aggressive stages II to III breast cancers with every-4-week carboplatin and weekly paclitaxel with or without trastuzumab:a Brown University Oncology Group Study[J].J Clin Oncol,2009,27(28):4693-4700.
[20] Pierga J Y,Delaloge S,EspiéM,et al.A multicenter randomized phase II study of sequential epirubicin/cyclophosphamide followed by docetaxel with or without celecoxib or trastuzumab according to HER2 status,as primary chemotherapy for localized invasive breast cancer patients[J].Breast Cancer Res Treat,2010,122(2):429-437.
[21] Chang H R,Glaspy J,Allison M A,et al.Differential response of triple-negative breast cancer to a docetaxel and carboplatin-based neoadjuvant treatment[J].Cancer,2010,116(18):4227-4337.
[22] Straver M E,Rutgers E J,Rodenhuis S,et al.The relevance of breast cancer subtypes in the outcome of neoadjuvant chemotherapy[J].Ann Surg Oncol,2010,17(9):2411-2418.
[23] Bhargava R,Beriwal S,Dabbs D J,et al.Immunohistochemical surrogate markers of breast cancer molecular classes predicts response to neoadjuvant chemotherapy:a single institutional experience with 359 cases[J].Cancer,2010,116(6):1431-1439.
[24]Iwata H,Sato N,Masuda N,et al.Docetaxel followed by fluorouracil/epirubicin/cyclophosphamide as neoadjuvant chemotherapy for patients with primary breast cancer[J].Clin Oncol,2011,41(7):867-875.
[25]Le Tourneau C,Dettwiler S,Beuzeboc P,et al.Pathologic response to short intensified taxane-free neoadjuvant chemotherapy in patients with highly proliferative operable breast cancer[J].Am J Clin Oncol,2012,35(3):242-246.
[26]Ono M,Tsuda H,Shimizu C,et al.Tumor-infiltrating lymphocytes are correlated with response to neoadjuvant chemotherapy in triple-negative breast cancer[J].Breast Cancer Res Treat,2012,132(3):793-805.
[27]Bauer J A,Chakravarthy A B,Rosenbluth J M,et al.Identification of markers of taxane sensitivity using proteomic and genomic analyses of breast tumors from patients receiving neoadjuvant paclitaxel and radiation[J].Clin Cancer Res,2010,16(2):681-690.
[28] Ena G.Neoadjuvant therapy in breast cancer[J].Rev Med Brux,2011,32(4):243-246.
[29]胡国志,刘睿,王海波,等.赫赛汀联合多西紫杉醇用于局部晚期乳腺癌新辅助化疗近期疗效探讨[J].中国综合临床,2008,24(8):810-812.
[30]魏少琳.三阴性乳腺癌的新辅助化疗的疗效及预后对比分析[J].中国煤炭工业医学杂志,2010,13(11):1621-1622.
[31] Burstein H J,Harris L N,Gelman R,et al.Preoperative therapy with trastuzumab and paclitaxel followed by sequential adjuvant doxorubicin/cyclophosphamide for HER2 overexpressing stageⅡorⅢbreast cancer:a pilot study[J].J Clin Oncol,2003,21(1):46-53.
[32] Limentani SA,Brufsky A M,Erban J K,et al.PhaseⅡ study of neoadjuvant docetaxel,vinorelbine,and trastuzumab followed by surgery and adjuvant doxorubicin plus cyclophosphamide in women with human epidermal growth factor receptor 2-overexpressing locally advanced breast cancer[J].J Clin Oncol,2007,25(10):1232-1238.
[33]Buzdar A U,Valero V,Ibrahim N K,et al.Neoadjuvant therapy with paclitaxel followed by 5-fluorouracil,epirubicin,and cyclophosphamide chemotherapy and concurrent trastuzumab in human epidermal growth factor receptor 2-positive operable breast cancer:an update of the initial randomized study population and data of additional patients treated with the same regimen[J].Clin Cancer Res,2007,13(1):228-233.
[34] Chen X S,Wu J Y,Huang O,et al.Molecular subtype can predict the response and outcome of Chinese locally advanced breast cancer patients treated with preoperative therapy[J].Oncol Rep,2010,23(5):1213-1220.
[35] Kong X,Moran M S,Zhang N,et al.Meta-analysis confirms achieving pathological complete response after neoadjuvant chemotherapy predicts favourable prognosis for breast cancer patients[J].Eur J Cancer,2011,47(14):2084-2090.
[36]Esserman L J,Perou C,Cheang M,et al.Breast cancer molecular profiles and tumour response of neoadjuvant doxorubicin and paclitaxel:the I-SPY TRIAL(CALGB 150007/150012,ACRIN 6657)[J].JClin Oncol,2009,27:515.
[37]De Laurentiis M,Cianniello D,Caputo R,et al.Treatment of triple negative breast cancer(TNBC):current options and future perspectives[J].Cancer Treat Rev,2010,36(3):S80-S86.

