Fractalkine/CX3CR1参与骨髓间充质干细胞向缺血脑组织定向迁移的实验研究
朱 洁,周华东
骨髓间充质干细胞(bone marrow stromal cells,BMSCs)具有很强的自我更新能力和多向分化潜能,在一定条件下能够诱导分化为神经细胞,发挥神经细胞替代和组织修复功能[1-7]。越来越多的研究发现移植BMSCs具有向脑损伤病灶定向迁移的趋势[8-12],但其确切机制仍不明确,阐明其机制有助于采取积极手段促进移植BMSCs向病灶迁移,提高移植治疗效果。趋化因子fractalkine,是为数不多组成性的表达于中枢神经系统中的趋化因子之一[13-14]。fractalkine和其唯一的受体CX3CR1相互作用,可通过提高细胞黏附和促进CX3CR1阳性细胞的跨膜转移在组织损伤中发挥作用[15-17]。
本课题组前期试验中发现,大鼠脑缺血再灌注损伤后脑组织中fractalkine表达增高,可能参与介导静脉移植人骨髓间充质干细胞(human bone marrow stromal cells,hMSCs)向脑损伤区的定向迁移[18]。本研究利用Transwell小室建立体外迁移模型进一步观察fractalkine和其受体CX3CR1是否参与介导BMSCs向脑缺血组织的定向迁移,以此进一步解释移植BMSCs向脑损伤局部迁移的可能机制。
1 材料与方法
1.1 实验材料 健康雄性SPF级SD大鼠,3~4月龄,体重270~300 g,以及2周龄SD大鼠幼鼠,由第三军医大学实验动物中心提供。胎牛血清(FBS)购自天津灏洋生物制品有限公司;胰蛋白酶购自Amresco公司;DMEM高糖培养基购自Hyclone公司;FITC标记的小鼠抗大鼠 CD44、CD90、CD71、CD11b抗体、同型对照购自Serotec公司;重组大鼠fractalkine购自R&D公司;CX3CR1抗体购自Abcam公司;SYBR Prime Script RT-PCR Kit购自TaKaRa公司;SP-9001免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司;Transwell小室聚碳酸酯膜(孔径为8μm)购自BD Biosciences公司。
1.2 BMSCs的分离纯化、培养及鉴定 2周龄大鼠幼鼠10只脱颈处死,无菌条件下分离双侧股骨,剪开干骺端,用注射器抽取0.01 mol/L PBS反复冲洗骨髓腔,制成单细胞悬液,将细胞悬液于 4℃、1000 r/min离心5 min共2次;弃上清后用含10%FBS的DMEM高糖培养基重新悬浮细胞接种到50 ml培养瓶中,置于37℃、5%CO2、饱和湿度的孵育箱内培养。24 h后更换新鲜培养液,去除未贴壁细胞,以后每3 d换液1次,10~14 d后传代培养。贴壁细胞约80% ~90%爬满培养瓶底时用0.25%胰酶消化,按104/ml密度传代接种。
用倒置相差显微镜逐日观察细胞的生长情况和形态特征。取生长良好的第3~5代细胞,充分悬浮后制成单细胞悬液,以FITC标记的小鼠抗大鼠CD44、CD90、CD71、CD11b 抗体室温避光染色30 min,设立不加抗体的阴性对照;使用 Becton-Dickinson FAC Scan检测,Apple公司随机软件分析,每个样本分析10 000个细胞。
1.3 体外培养BMSCs表达CX3CR1的情况
1.3.1 RT-PCR检测CX3CR1 mRNA表达:取生长良好的第3~5代细胞,采用Tripure RNA抽提试剂提取细胞总RNA。紫外分光光度计(Beckman Du 800)测定 RNA 纯度及浓度,A260/280为1.8~2.0可用以实验。RNA统一定量为1.0μg后进行反转录反应。CX3CR1(140 bp)引物为:上游5'-AGCTGCTCAGGACCTCACCAT-3',下游 5'-GTTGTGGAGGCCCTCATGGCTGAT-3';条件如下:42℃,30 min;95℃,5 min;5℃,5 min。待 RNA反转录为 cDNA后,以20 g/L琼脂糖凝胶电泳,电泳结果在GENEGENUS数码成像及分析系统中观察、拍照。
1.3.2 免疫细胞化学方法检测CX3CR1表达:取生长旺盛的第3~5代细胞,以兔抗CX3CR1多克隆抗体(1∶200),按照SP 9001试剂盒操作说明进行SP 3步法免疫组化染色,以苏木素染液复染核;阴性对照以0.1 mol/L PBS代替一抗,其余步骤不变。
1.4 大鼠大脑中动脉缺血/再灌注模型的制备 参照Nagasawa线栓法制备大鼠局灶性脑缺血再灌注模型[19](栓塞右侧大脑中动脉)。术后2 h,拔出线栓,实现再灌注。动物苏醒后参照Longa等方法进行5分制评分[20],2~3分者为实验对象。经解剖发现蛛网膜下腔出血者不计入实验组。
1.5 脑组织匀浆上清液制备 正常对照组(正常对照组大鼠不做处理6只)及大鼠大脑中动脉缺血/再灌注模型大鼠(以再灌注不同时间24 h、72 h、7 d)各6只分别于规定时间点断颈处死,无菌条件下迅速摘取前脑(耳间线2~12 mm),置冰上,迅速称重,加入 DMEM培养基,匀浆,4℃以12 000 r/min,离心15 min,收集上清。
1.6 Transwell实验检测细胞迁移能力
1.6.1 不同浓度重组大鼠FKN对BMSCs迁移的影响:将PBS(正常对照组)及浓度分别为50、100、200、500 ng/ml重组大鼠fractalkine置于chamber下层,将2×105/ml BMSCs细胞悬液50μl(总细胞数104)于chamber上层,加入等量DMEM高糖培养基于37℃培养箱中,孵育18 h。取出Transwell小室用PBS洗2遍,于4℃体积分数90%乙醇固定;加入结晶紫(0.1%)染色(5 ~10 min),室温 0.5 h,PBS 洗2遍,用棉球擦去上表面细胞,40倍显微镜下观察。每孔取中间和四周5个随机视野,计算染色细胞总数。
1.6.2 不同再灌注时间缺血大鼠脑组织萃取液对BMSCs迁移的影响:将正常大鼠脑组织(对照)及再灌注24 h、72 h、7 d MCAO大鼠脑组织萃取液置于chamber下层,将2×105/ml BMSCs细胞悬液50μl(总细胞数 104)置于 chamber上层,加入等量DMEM高糖培养基孵育18 h后计数迁移至滤膜下方的细胞数,每孔取中间和四周5个随机视野。取最大黏附效应的时间点行阻断实验。
1.6.3 阻断CX3CR1对BMSCs向缺血脑组织萃取液迁移的影响:阻断组BMSCs于迁移诱导培养前预先以5μg/ml CX3CR1抗体于室温下孵育30 min,将脑缺血大鼠脑组织萃取液置于chamber下层,将正常组及CX3CR1阻断组2×105/ml BMSCs细胞悬液50μl(总细胞数104)置于chamber上层,加入等量DMEM高糖培养基孵育18 h后计数迁移至滤膜下方的细胞数,每孔取中间和四周5个随机视野。1.7 统计学处理 所得数据均采用均数±标准差(±s)表示,两组均数比较,应用SPSS 18.0统计软件包行t检验,α=0.05为检验水准。
2 结果
2.1 BMSCs的分离纯化及鉴定 第3~5代的BMSCs细胞形态呈成纤维细胞样,细胞呈极性排列,集落呈漩涡状(图1)。经流式细胞仪检测,BMSCs均一地表达 CD44、CD90和 CD71,阳性率分别为98.4%、99.7%和99.6%;而CD11b 阳性率仅0.6%(图2)。

图1 相差显微镜观察第4代骨髓间充质干细胞(×100)
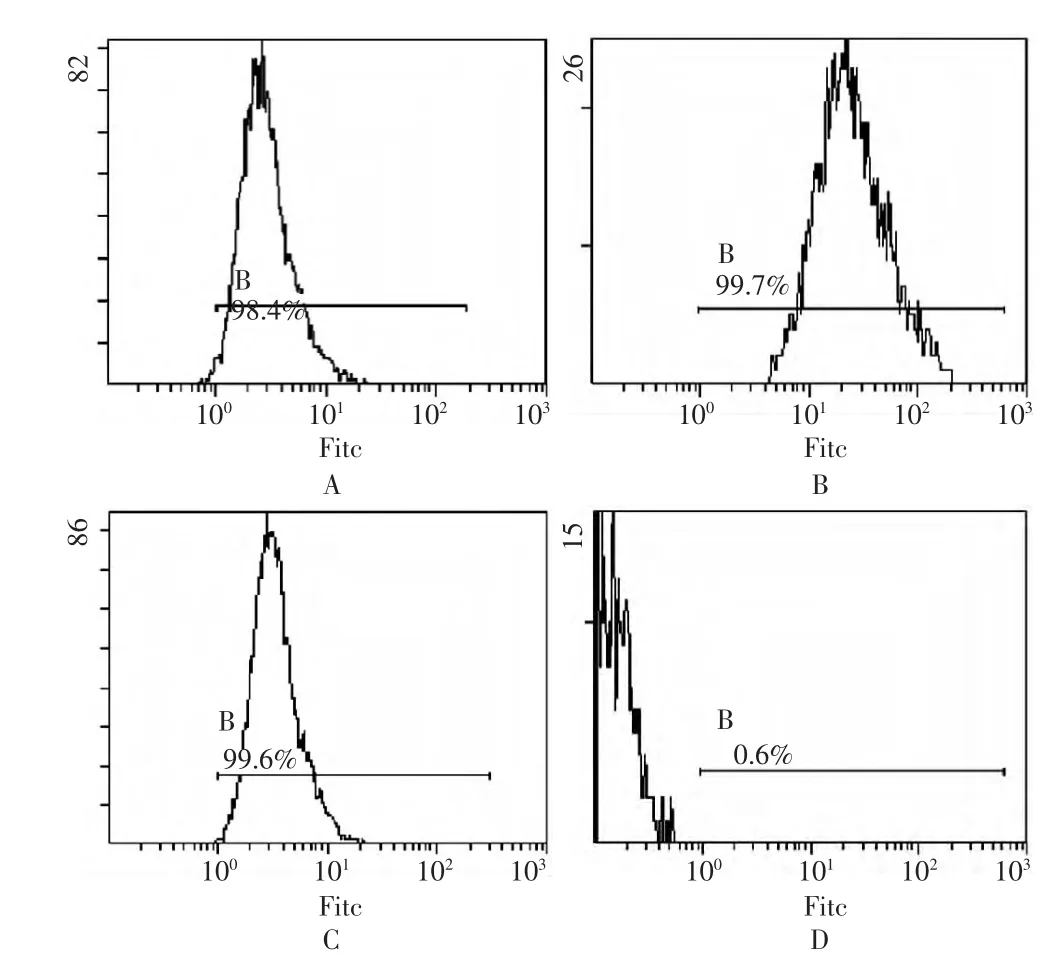
图2 骨髓间充质干细胞表面标记物流式细胞仪分析图
2.2 BMSCs CX3CR1 mRNA和蛋白的表达 RTPCR琼脂糖凝胶电泳结果显示:320 bp特异性扩增条带,与预期趋化因子受体CX3CR1扩增片段一致(图3A)。免疫组化结果发现CX3CR1主要表达于BMSCs的胞膜和胞浆(图3B),空白对照未见阳性着色。

图3 CX3CR1在骨髓间充质干细胞的表达
2.3 fractalkine和缺血脑组织萃取液对BMSCs的定向趋化作用
2.3.1 不同浓度重组大鼠fractalkine对BMSCs迁移的影响:在重组 fractalkine浓度为50、100 ng/ml的作用下,迁移至下层chamber的BMSCs分别为(1.02 ±0.39)×103与(1.53 ±0.14)×103,和 PBS对照组(0.85±0.22)×103相比无明显差异。而在200、500 ng/ml作用下,有较多量的BMSCs实现迁移,分别为(2.27 ±0.66)×103和(2.92 ±0.83)×103,与对照组相比有显著差异(P<0.05)。
2.3.2 不同再灌注时间缺血大鼠脑组织萃取液对BMSCs迁移的影响:与正常对照组相比,大鼠大脑中动脉缺血/再灌注模型组术后24 h大鼠脑组织萃取液所诱导的 BMSCs迁移(0.73±0.28)×103与正常对照组(0.52±0.08)×103相比未见显著性差异(P>0.05)。术后72 h和7 d大鼠脑组织萃取液所诱导的迁移 BMSCs分别为(1.39±0.33)×103和(1.74 ±0.31)×103,与正常对照组相比有显著差异(P <0.05)。
2.3.3 阻断CX3CR1对BMSCs向缺血脑组织萃取液迁移的影响:以CX3CR1抗体阻断BMSCs向缺血脑组织迁移组迁移的细胞数为(1.13±0.37)×103,与正常对照组(2.38±0.62)×103比较有显著差异(P <0.05)。
3 讨论
已有大量动物实验研究发现,BMSCs移植对于多种原因造成的中枢神经损伤具有促进损伤修复和改善神经功能的作用。在多种渠道的移植(损伤局部移植、静脉内注射移植和脑室内移植等)研究[8-12],均发现移植细胞有向损伤病灶聚集的趋势,认为与损伤局部微环境促进移植细胞趋向迁移并有利于细胞在局部存活有关,但确切机制仍不明确。阐明其机制有助于采取积极手段促进移植BMSCs向损伤病灶的聚集,提高移植治疗效果。趋化因子是一类由70~100个氨基酸组成小分子分泌蛋白,其基本功能就是对表达有相应趋化因子受体的细胞的定向趋化作用[21]。脑组织损伤后,神经元、神经胶质细胞、血管内皮细胞和免疫细胞在受到生长因子、干扰素等刺激诱导时可分泌出大量不同的趋化因子,BMSCs存在特定的趋化因子受体表达谱也已被大量的研究证实[22-23]。因此,趋化因子及其受体在BMSCs定向迁移中发挥的作用受到广泛关注。
fractalkine是趋化因子CX3C亚家族的唯一成员,和其特异性受体CX3CR1相互作用,通过提高细胞粘附和促进CX3CR1阳性细胞的跨膜转移在组织损伤中发挥作用[15-17]。fractalkine是为数不多的表达于脑组织中的趋化因子之一,主要表达于神经元,广泛分布在中枢神经系统中。我们在前期研究中发现大鼠脑缺血再灌注损伤后,病变侧脑皮质的中fractalkine mRNA表达增高,在缺血半球,可见大量fractalkine阳性细胞聚集在病灶周围。静脉移植的hMSCs能定向迁移到缺血再灌注损伤的大鼠脑组织中。定向迁移的hMSCs主要分布在fractalkine高表达的区域,干扰BMSCs上CX3CR1的表达,其向损伤脑组织的迁移能力明显下降。以上结果说明fractalkine/CX3CR1在移植hMSCs向缺血损伤脑组织的定向迁移中发挥了重要作用。尽管上述研究发现fractalkine/CX3CR1系统与BMSCs向脑缺血病灶的定向迁移有关,但仍需要进一步的离体研究加以证实。
已有大量研究结果显示体外培养的BMSCs存在特定的趋化因子受体表达谱[22-23]。本研究采用密度梯度离心贴壁筛选法分离纯化BMSCs,运用realtime PCR和免疫组化技术分别从mRNA和蛋白水平观察到fractalkine特异性受体CX3CR1在BMSCs的表达。本研究向Transwell小室内的无血清培养基加入fractalkine后迁移到聚碳酸酯膜底面BMSCs数量明显增加,并且迁移细胞的数量与fractalkine浓度呈浓度依赖效应,这一结果表明fractalkine是一种可以趋化BMSCs定向迁移的细胞因子。利用Transwell体外趋化迁移模型也证实BMSCs具有向缺血再灌注损伤脑组织定向迁移的能力,再灌注3和7 d组脑组织萃取液诱导迁移的BMSCs显著高于正常大鼠脑组织萃取液,结合我们前期研究所发现的再灌注损伤后3和7 d缺血区周围脑组织fractalkine表达显著增高,提示缺血前后fractalkine的表达变化可能与BMSCs迁移数目变化相关。进一步实验中我们以CX3CR1抗体孵育BMSCs,实验结果显示封闭CX3CR1后,缺血脑组织萃取液诱导的BMSCs定向迁移受到影响(为正常对照组的47.5%),这表明fractalkine/CX3CR1配体-受体作用促进BMSCs向缺血脑组织的定向迁移,但由于CX3CR1抗体不能完全阻断缺血脑组织萃取液诱导的BMSCs定向迁移,所以可以推测还应有其他因子参与诱导BMSCs向脑缺血损伤区的定向迁移。
采用BMSCs进行移植治疗,其资源丰富,可来源于自体,无组织异源性,无伦理限制,能穿过血脑屏障并向大脑组织迁移与脑组织整合,易于临床广泛应用,发展潜力巨大。本研究为 fractalkine/CX3CR1参与了BMSCs向损伤处迁移提供了充分的实验数据,这为临床应用静脉注射BMSCs治疗神经损伤性疾病提供了可能的治疗方向。
[1] Prockop D J.Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276(5309):71-74.
[2] Eckert M A,Vu Q,Xie K,et al.Evidence for high translational potential of mesenchymal stromal cell therapy to improve recovery from ischemic stroke[J].J Cereb Blood Flow Metab,2013,33(9):1322-1334.
[3] Heo JS,Choi SM,Kim H O,et al.Neural transdifferentiation of human bone marrow mesenchymal stem cells on hydrophobic polymer-modified surface and therapeutic effects in an animal model of ischemic stroke[J].Neuroscience,2013,238:305-318.
[4] Bilen S,Pinarli F,Ak F,et al.Treatment efficacy with bone marrow derived mesenchymal stem cells and minocycline in rats after cerebral ischemic injury[J].Stem Cell Rev,2013,9(2):219-225.
[5] 李明辉,田丁,刘聪燕,等.人骨髓间充质干细胞的培养及研究[J].首都医科大学学报,2005,26(2):183-186.
[6] 朱淑霞,宋治远.骨髓间充质干细胞和心肌组织工程[J].武警医学院学报,2009,18(4):366-370.
[7] Ishizaka S,Horie N,Satoh K,et al.Intra-arterial cell transplantation provides timing-dependent cell distribution and functional recovery after stroke[J].Stroke,2013,44(3):720-726.
[8] Lee R H,Hsu SC,Munoz J,et al.A subset of human rapidly self-renewing marrow stromal cells preferentially engraft in mice[J].Blood,2006,107(5):2153-2161.
[9] Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J].Stroke,2001,32(4):1005-1011.
[10] Li Y,Chen J,Wang L,et al.Treatment of stroke in rat with intracarotid administration of marrow stromal cells[J].Neurology,2001,56(12):1666-1672.
[11] Hess D C,Hill W D,Martin-Studdard A,et al.Bone marrow as a source of endothelial cells and NeuN-expressing cells After stroke[J].Stroke,2002,33(5):1362-1368.
[12] Shichinohe H,Kuroda S,Yano S,et al.Improved expression of gamma-aminobutyric acid receptor in mice with cerebral infarct and transplanted bone marrow stromal cells:an autoradiographic and histologic analysis[J].J Nucl Med,2006,47(3):486-491.
[13] Harrison JK,Jiang Y,Chen S,et al.Role for neuronally derived fractalkine in mediating interactions between neurons and CX3CR1-expressing microglia[J].Proc Natl Acad Sci U SA,1998,95(18):10896-10901.
[14] Cardona A E,Pioro E P,Sasse M E,et al.Control of microglial neurotoxicity by the fractalkine receptor[J].Nat Neurosci,2006,9(7):917-924.
[15] Bazan J F,Bacon K B,Hardiman G,et al.A new class of membrane-bound chemokine with a CX3C motif[J].Nature,1997,385(6617):640-644.
[16]Haskell CA,Cleary M D,Charo I F.Unique role of the chemokine domain of fractalkine in cell capture.Kinetics of receptor dissociation correlate with cell adhesion[J].J Biol Chem,2000,275(44):34183-34189.
[17]Verge G M,Milligan E D,Maier SF,et al.Fractalkine(CX3CL1)and fractalkine receptor(CX3CR1)distribution in spinal cord and dorsal root ganglia under basal and neuropathic pain conditions[J].Eur JNeurosci,2004,20(5):1150-1160.
[18] Zhu J,Zhou Z,Liu Y,et al.Fractalkine and CX3CR1 are involved in the migration of intravenously grafted human bone marrow stromal cells toward ischemic brain lesion in rats[J].Brain Res,2009,1287:173-183.
[19] Nagasawa H,Kogure K.Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion[J].Stroke,1989,20(8):1037-1043.
[20] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[21]Murdoch C,Finn A.Chemokine receptors and their role in vascular biology[J].J Vasc Res,2000,37(1):1-7.
[22] Ji J F,He B P,Dheen ST,et al.Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury[J].Stem Cells,2004,22(3):415-427.
[23] Sordi V,Malosio M L,Marchesi F,et al.Bone marrow mesenchymal stem cells express a restricted set of functionally active chemokine receptors capable of promoting migration to pancreatic islets[J].Blood,2005,106(2):419-427.

