EGFR在150例子宫内膜病变中表达的研究
罗 红
中国医科大学四平医院病理科,吉林 四平 136000
EGFR在150例子宫内膜病变中表达的研究
罗 红
中国医科大学四平医院病理科,吉林 四平 136000
目的本研究检测表皮生长因子受体家族中EGFR在子宫内膜腺癌、不典型增生子宫内膜及复杂增生子宫内膜及正常增生期子宫内膜等病变中的表达意义,并分析了EGFR与子宫内膜腺癌之间的关联性。
表皮生长因子受体;子宫内膜病理学;免疫组织化学
研究显示在多种肿瘤组织和相关血清表达中EGFR均显示异常[1]。同时其和与肿瘤的转移存在一定的相关性[2]。目前我国对于EGFR与子宫内膜癌之间的联系尚无从良性子宫内膜病变进行等级相关研究的报道。本文针对EGFR与子宫内膜腺癌之间的发生发展进行了如下研究。
1 资料与方法
1.1 一般资料
收集2010年~2014年我院就诊的妇科患者,所有患者均通过病理诊断确诊为子宫内膜癌。150例患者,CH(子宫内膜复杂型增生)、NE(正常增生期的子宫内膜组织)各30例,AH(子宫内膜非典型增生)患者30例,EC(子宫内膜癌)患者60例。150例患者的治疗方法主要为手术方式,排除激素治疗患者、放疗患者以及化疗患者。根据妇产科FIGO临床分级标准,可将150例患者分为Ⅰ期的患者17例、Ⅱ期的患者19例、Ⅲ期的患者14例、Ⅳ期的患者10例;组织学分级,G1(高分化)、G2(中分化)、G3(低分化)分别为25 例、18 例、17例;所有患者均存在子宫内膜病变情况。
1.2 检测方法
标本采集后,应保持相同的保存环境,免疫组化试剂盒为PV9000试剂盒,准备工作完成后即可进行染色。对患者进行免疫组化学检测时,可采用以下方法进行,具体步骤为:先对切片进行包埋处理,一般可选择石蜡进行包埋,将包埋厚度控制在3 μm范围内;然后采用梯度乙醇及二甲苯对切片进行水化处理和脱蜡处理,采用过氧化氢3%净化室内空气,保持10 min的相同室温,以此降低内源性过氧化物酶活性;采用PH值为9.0的缓冲液EDTA进行抗原修复,保持高压高温状态,滴加鼠抗人EGFR单克隆抗体(1∶50),室温保湿盒中孵育60 min;先后滴加放大系统试剂1和试剂2,分别在室温保湿孵育20 min和30 min,上述步骤均采用PBS进行漂洗。当DAB出现明显的显色反应后,复染苏木素,然后进行脱水处理,待呈透明状后,进行封片处理。设置分组,分别设为阴性组及阳性组,阴性组为PBS患者,阳性组为阳性患者。
1.3 评分方法
经检测发现,EGFR染色主要呈棕黄色,阳性定位主要包括细胞浆及细胞膜两种。选择双盲法进行检测时,如随机选择高倍镜视野10个,肿瘤细胞及腺上皮阳性细胞数不少于1000个,那可分为以下几种评分方法[3]:第一种,按照显色反应进行评分,根据是否出现显色现象、显色深浅等情况评价染色的强度。无显色反应为0分,浅黄色、棕黄色、棕褐色分别为1分、2分、3分;第二种,按照阳性细胞数量算出比例,然后进行评分。阴性为0分,阳性细胞小于或等于10%为1分,阳性细胞为11%至50%为2分,阳性细胞为51%至75%为3分,阳性细胞大于75%为4分。两种评分之间相乘多得结果为每例患者的染色积分,若患者则积分大于或等于3分,则可评价为免疫反应阳性。
1.4 统计处理
本研究采用统计软件SPSS14.0进行数据分析,采用Spearman等级相关分析方法,检验水准α=0.01。
2 结果
2.1 EGFR 在不同子宫内膜组织中的表达情况
EGFR 在NE组、CH组、AH组及EC组的表达呈现递增趋势,具有显著的等级相关性,spearman等级相关系数为0.579,差异有统计学意义(P<0.01),见表1。
2.2 EGFR对于各类型子宫内膜病变的表达意义
在本组60例患者中,经统计发现,当患者病理分期出现增高现象时,EGFR阳性率也会随之增高,当患者的肿瘤分化出现降低现象时,EGFR阳性率会随之降低,分化程度可分为G1、G2、G3以及病理分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期的阳性表达spearman等级相关系数分别为0.460和0.336,其表达增加有统计学意义(P<0.01),见表2。
2.3 EGFR 在CH及NE中的表达
见图A与图B,在AH及CH中的表达见图C与图D。

A.正常增生;B.复杂增生;C.非典型增生;D.子宫内膜腺癌
3 讨论
EGFR属于原癌基因c-erbB1中的一种表达产物,可以说是表皮生长因子受体中的一份子。对于细胞来说,在细胞生理过程中ER家族可以说是占据了极为重要的角色。EGFR的分布较为广泛,尤其是在哺乳动物身上,无论是其广上皮细胞和成纤维细胞,还是胶质细胞和角质细胞等,在细胞表面都存在EGFR,因为对于细胞来说,EGFR信号通路有着极为重要的作用,其低于细胞的生长、增殖及分化等有一定的影响[3]。本文研究显示,当正常子宫内膜出现转化倾向时,EGFR会出现逐渐上升现象。且比EC、AH、CH、NE之间的EGFR对比有统计学差异,并有等级相关性(P<0.01)。有研究表明EGFR的异常表达可能与子宫内膜癌的发生发展有关[4]。可作为判断子宫内膜癌浸润和转移的重要指标。EGFR 在低分化腺癌组的表达明显高于高分化腺癌组(P<0.01)。
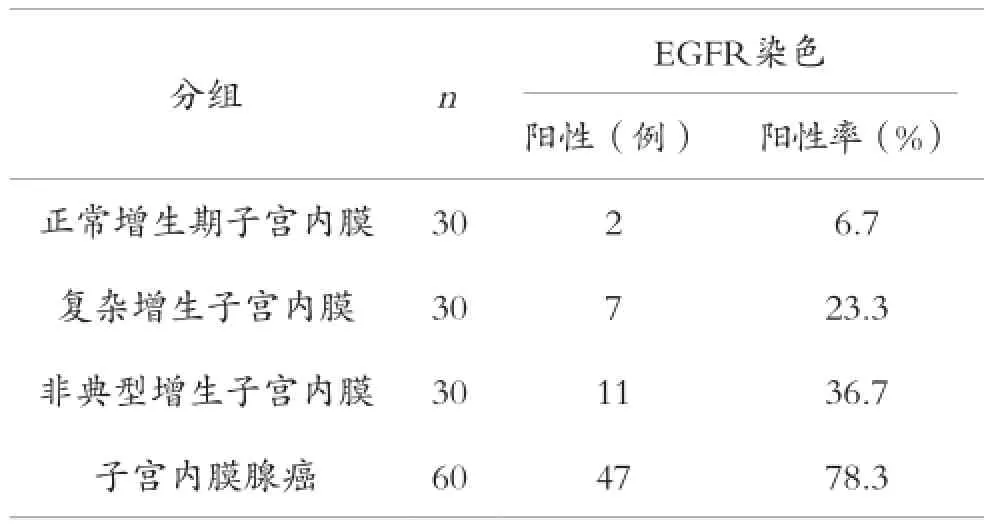
表1 EGFR在NE、CH、AH、EC各组中的表达
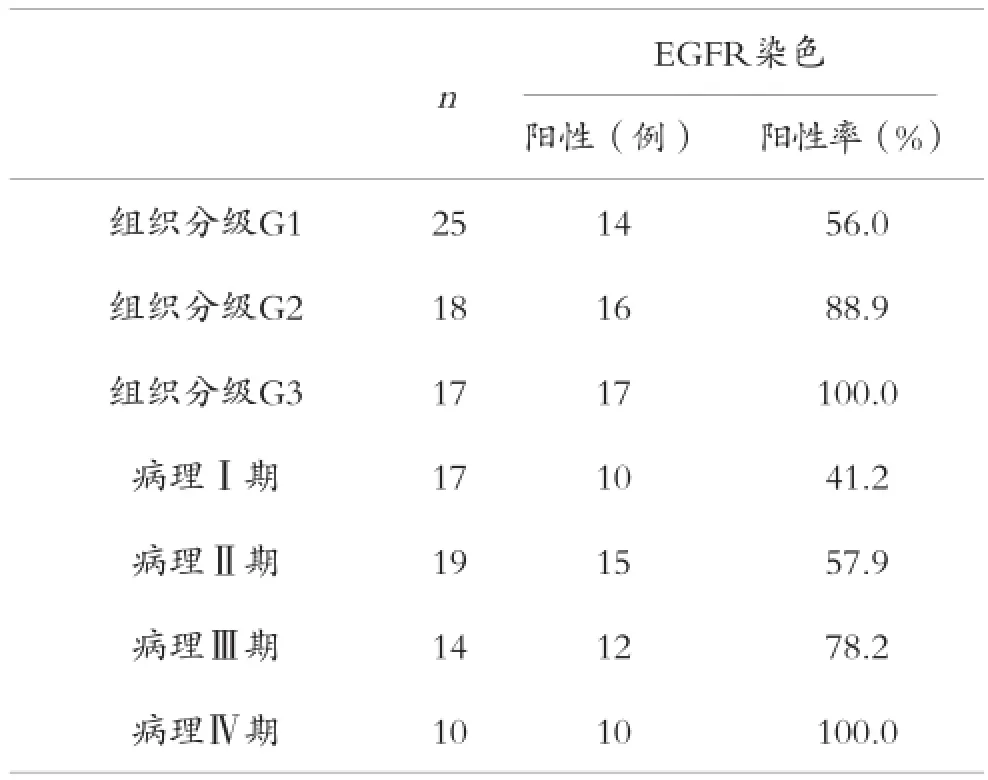
表2 EGFR阳性率与肿瘤分化程度
综上所述,在子宫内膜腺癌病变过程中,该蛋白具有明显的促癌作用,是肿瘤恶化的原因之一。相关研究显示抑制EGFR基因表达可部分逆转子宫内膜癌细胞子宫内膜癌细胞上皮间质转化(EMT)相关基因的表达。临床使用EGFR抑制剂可有效地抑制子宫内膜癌细胞增殖。
[1]孟丽荣,李田,李小毛. PTEN和EGFR与子宫内膜癌发生和发展研究的最新进展[J].肿瘤,2010,10(5):162-163.
[2]杨唯宁,艾志宏,滕银成. EGFR过表达对子宫内膜癌细胞上皮间质转化的影响[J].现代妇产科进展,2011,04(10):208-209.
[3]王卓然,宋巍,孙壮状. TGF-β1与EGFR在子宫内膜癌患者内膜组织中的表达及意义[J].中国优生与遗传杂志,2010,14(7):68-69.
[4]陈晶晶,陈柯,王晓秋. 子宫内膜癌组织中Id-1、VEGF-C和EGFR的表达及临床意义[J].临床与实验病理学杂志,2010,04(2):102-103.
R737.33
B
1674-9316(2014)09-0061-03
10.3969/J.ISSN.1674-9316.2014.09.035
方法采用免疫组化染色法,对正常EC(子宫内膜癌组织)、AH(子宫内膜非典型增生组织)、CH(子宫内膜复杂性增生组织)及NE(正常增生期子宫内膜组织)共150例中的EGFR 表达进行检测。
结果EGFR在EC、AH、CH、NE这几种子宫内膜病变中具有阳性表达率逐渐升高且存在等级相关性,spearman等级相关系数为0.579,差异具有统计学意义(P<0.01)。EGFR 的表达与肿瘤的组织分化程度、病理分期等级相关,spearman等级相关系数分别为0.460和0.336,差异有统计学意义(P<0.01)。
结论EGFR 与子宫内膜腺癌的发生及肿瘤的病理学行为相关,过度表达提示预后不良。

