超声萃取-高效液相色谱法同时测定奶粉中4 种雌激素类残留
谭 芳,黄 璐,郑 琦
(江汉大学 光电化学材料与器件省部共建教育部重点实验室,湖北 武汉 430056)
现代牛奶中的雌激素包括内源性雌激素,即奶牛本身产生的雌激素,和外源性雌激素,即应用于奶牛的雌激素,主要与孕激素等一起诱导奶牛发情和泌乳。牛奶中所含雌激素如果过高,可能导致儿童性早熟,成年人发生乳腺或者妇科肿瘤以及前列腺癌[1-2]。因此,快速准确检测牛奶制品中雌激素对于估计食品安全的潜在因素是很必须的。目前,国家出台的标准中[3-4],仅对牛奶中的雌激素建立了检测方法,而奶粉的检测方法尚无现行的国家标准。由于奶粉配方基质复杂,激素残留量低,建立快速、准确的方法来解决奶粉中的雌激素检测问题很有必要。目前国内外测定牛奶制品中激素的文献较多[5-12],但测定其中壬基酚及苯甲酸雌二醇等雌激素残留的报道却较少[13-15]。本研究建立了一种超声萃取-高效液相法可以快速、灵敏、准确同时测定奶粉中炔雌醇、己烯雌酚、壬基酚和苯甲酸雌二醇的雌激素残留。
1 材料与方法
1.1 材料与试剂
孕妇奶粉、婴幼儿1、2阶段配方奶粉、中老年营养奶粉 市购;对照品己烯雌酚(批号F1219049)、苯甲酸雌二醇(批号45131) 阿拉丁试剂(上海)有限公司;炔雌醇(批号10408)、壬基酚(批号70924) 德国Dr.Ehrenstorfer公司;甲醇、乙腈(色谱纯) 天津市科密欧化学试剂有限公司;磷酸二氢钠(分析纯) 天津博迪化工股份有限公司。
1.2 仪器与设备
DIONEX高效液相色谱仪(GP50型梯度泵、TCC-100柱温箱、UVD170U型紫外检测器) 美国戴安公司;kQ-250超声波提取仪 昆山市超声仪器有限公司;微孔滤膜(孔径0.45 μm) 天津市津腾实验设备有限公司;800型低速离心沉淀机 中国深圳国华仪器;DENVER电子天平 美国丹佛仪器公司;离心管(10 mL,具塞带刻度) 湖南长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 样品处理
称取2.0 g奶粉试样于10 mL具塞刻度离心管中,加4 mL乙腈混匀,超声提取20 min,4 000 r/min离心10 min,取上清液静置,重复3 次,合并上清液,40 ℃条件下氮气吹至近干,残余物用乙腈溶解并定容至1 mL,经0.45 μm滤膜过滤后,以高效液相色谱(high performance liquid chromatography,HPLC)法检测。
1.3.2 标准溶液配制
精密称取炔雌醇、己烯雌酚、苯甲酸雌二醇、壬基酚对照品各50 mg,用乙腈定容至50 mL,得到质量浓度1 mg/mL的贮备液,存放于冰箱备用。准确吸取上述标准贮备液适量,用乙腈稀释,配制成一系列质量浓度的混合标准溶液。
1.3.3 色谱条件
色谱柱:Thermo C18柱(250 mm×0.46 mm,5 μm);流速1 mL/min;柱温30 ℃;流动相:乙腈∶(0.043 mol/L)磷酸二氢钠缓冲液(用磷酸调至pH值到5);梯度洗脱:1~5 min,V(乙腈)∶V(磷酸二氢钠缓冲液)=55∶45,5~15 min,V(乙腈)∶V(磷酸二氢钠缓冲液)=85∶15,15 min后V(乙腈)∶V(磷酸二氢钠缓冲液)=55∶45;检测波长224 nm;进样量20 μL。
2 结果与分析
2.1 流动相的选择
[16-19],本实验选择甲醇、乙腈、水、磷酸二氢钠等不同溶剂及不同配比的多种溶剂体系进行了一系列实验,甲醇作为流动相有机相时基线不稳定,干扰较大,选用乙腈后基线较稳定。水作为流动相,苯甲酸雌二醇易出现肩峰或双头峰,选择磷酸二氢钠缓冲液作为流动相,可改善此现象,峰形较好,且分离效果更好。本实验还进行了等度洗脱和梯度洗脱的研究。结果表明,流动相为乙腈-(0.043 mol/L)磷酸二氢钠缓冲液(用磷酸调至pH值到5);梯度洗脱:1~5min,V(乙腈)∶V(磷酸二氢钠缓冲液)=55∶45,5~15 min,V(乙腈)∶V(磷酸二氢钠缓冲液)=85∶15,15 min后,V(乙腈)∶V(磷酸二氢钠缓冲液)=55∶45时,分析时间适宜且各组分分离度较好。
2.2 波长的选择
对己烯雌酚、苯甲酸雌二醇、壬基酚和炔雌醇进行紫外扫描,发现虽然各组分的最大吸收波长有所不同,但在224 nm波长检测时各组分的检测信号都相对较高且响应值较为接近,见图1,因此本实验确定224 nm为检测波长。
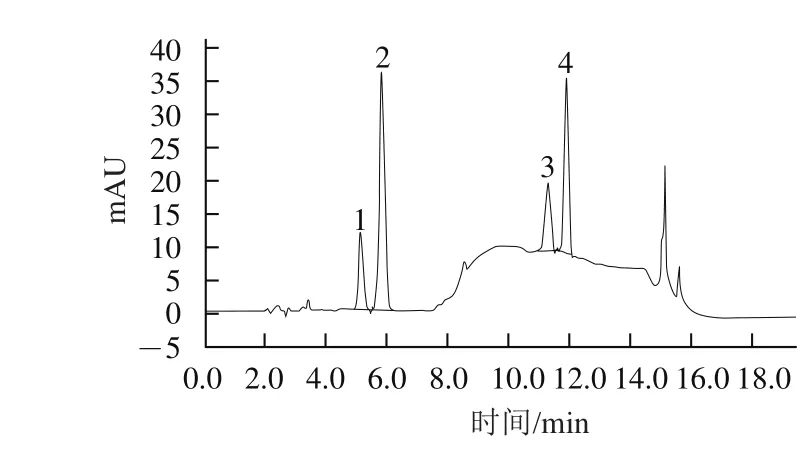
图1 对照品标准溶液(每种激素质量浓度为10 µg/mL)色谱图Fig.1 Chromatogram of a mixed standard solution (10 µg/mL )
2.3 萃取剂选择
奶粉样品中蛋白质和脂肪是主要成分,同时也是干扰物的主要来源,因此奶粉中蛋白质和脂肪的去除以及待测组分的提取是样品前处理过程的关键。参照相关文献[20-25],萃取剂一般在乙醇、乙酸乙酯、氯仿和乙腈中选择。通过实验发现,乙醇萃取离心后溶液仍然比较混浊,过滤膜阻力特别大;乙酸乙酯萃取后溶液呈深土黄色,杂质干扰较大;炔雌醇在氯仿中溶解度不大,氯仿提取回收率较低;乙腈提取后溶液澄清,干扰少,回收率较高,因此本实验最终选择乙腈作为萃取剂,同时也是蛋白质沉淀剂。
2.4 超声萃取与离心时间的选择
奶粉中残留的激素类成分直接经乙腈萃取,回收率偏低。采用超声萃取离心后,回收率明显提高。本实验分别考察了超声萃取时间为10、20、30 min与离心5、10、15 min对萃取效率的影响,实验数据显示超声萃取时间为20 min、离心时间为10 min时,萃取效率高,而且实验时间较为相宜。故本实验选择此条件作为超声萃取与离心时间。
2.5 方法的线性范围、检出限、定量限
将各组分一系列不同质量浓度的标准溶液,在优化的色谱条件下分别进行分析。采用外标法,根据峰面积与质量浓度的关系绘制标准工作曲线,以3倍信噪比(RSN)计算检出限,以10 倍信噪比(RSN)计算定量限。结果见表1。4 种激素类组分的线性关系良好,相关系数在0.992 4~0.999 7之间,检出限在3~20 μg/kg,定量限为10~100 μg/kg。
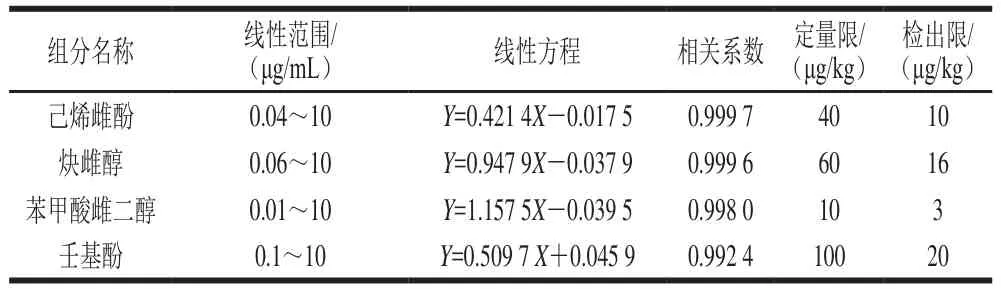
表1 线性方程、检出限及定量限Table 1 Regression equations, limits of detection (LOD) and limits of quantification (LOQ)
2.6 方法的回收率与精密度
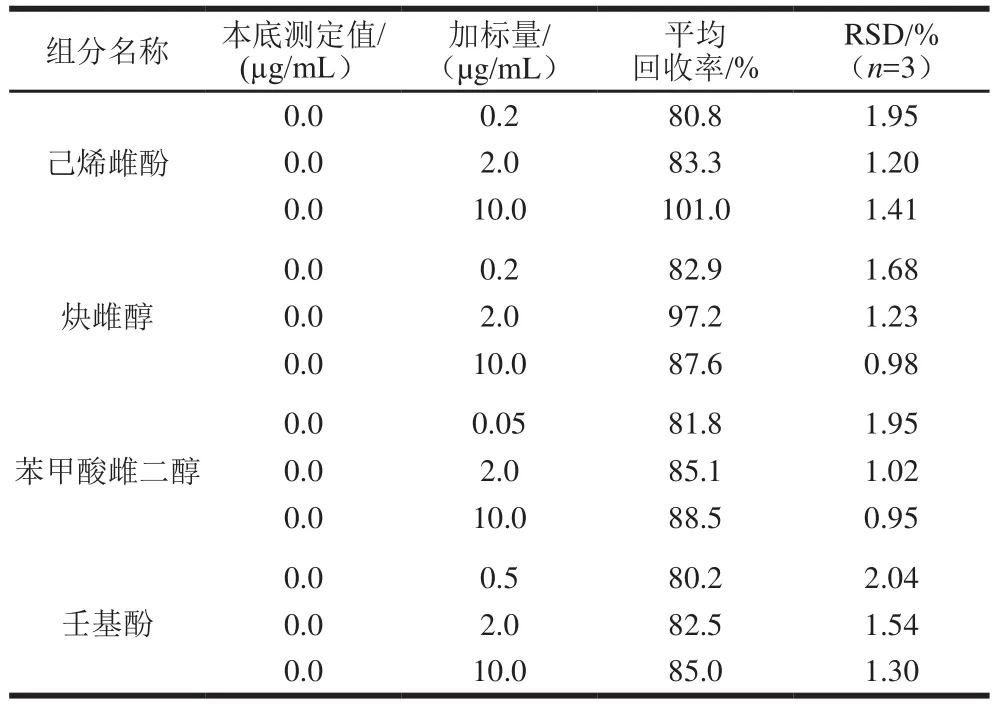
表2 加标回收率与精密度Table 2 Recoveries and precision expressed as relative standard deviations (RSD)

图2 样品加标溶液(每种激素质量浓度为2 µg/mL)色谱图Fig.2 Chromatogram of blank sample spiked with mixed standard solution (2 µg/mL)
用空白奶粉试样进行添加回收率和精密度实验。精密称取样品2.0 g,分别添加各激素组分低、中、高质量浓度的标准溶液1 mL,摇匀,按1.3节方法操作,测定,每个添加水平平行测定3 次,计算平均加标回收率和相对标准偏差(relative standard deviation,RSD),结果如表2所示。从表2可以看出,各组分的回收率均在80.2%~101.0%之间,相对标准偏差在0.95%~2.04%之间(n=3),可见本实验的准确度与精密度良好。样品加标色谱图见图2。
2.7 样品分析
采用本法对市售3 个品牌的孕妇奶粉、婴幼儿1、2阶段配方奶粉、中老年营养奶粉进行测定,所有样品均低于本方法检出限,均未检出待测的4 种激素类组分,同时在检测过程中,未发现有其他明显的干扰。样品色谱图见图3。

图3 样品色谱图Fig.3 Chromatogram of real samples
3 结 论
应用建立的超声波萃取-高效液相色谱法法测定奶粉中炔雌醇、己烯雌酚、苯甲酸雌二醇、壬基酚4 种激素类药物残留,各组分的加标回收率为80.2%~101.0%,相对标准偏差为0.95%~2.04%,实验结果表明,该方法试剂用量少,而且无较多的干扰物产生,操作简单、快速、准确、成本低,应用于奶粉中激素类成分残留量的检测,可以得到满意的结果。
参考文献:
[1]沈臻, 徐莹.浅论牛乳中的雌激素[J].黑龙江科技信息, 2011(27): 184.
[2]袁丽君, 徐庄剑, 许祥生.牛奶中的雌激素及其安全性[J].国际内科学杂志, 2007, 34(4): 712-714.
[3]国家质量监督检验检疫总局.GB/T 21981—2008 动物源食品中激素多残留检测方法: 液相色谱-质谱质谱法[S].北京: 中国标准出版社, 2008.
[4]农业部.农业部1031号公告-1-2008 动物源性食品中11 种激素残留检测: 液相色谱-串联质谱法[S].北京: 中国标准出版社, 2008.
[5]孙汉文, 李挥, 康占省, 等.气相色谱-质谱法同时检测婴幼儿配方奶粉中的6 种雌激素残留[J].河北大学学报: 自然科学版, 2011, 31(6):607-611.
[6]迂君, 张秀丽, 张玉黔.高效液相色谱法测定牛奶中雌激素残留量[J].中国卫生检验杂志, 2007, 17(6): 1139-1140.
[7]周建科, 岳强, 宿书芳, 等.牛奶中雌性激素的高效液相色谱分析[J].中国乳品工业, 2005, 33(11): 56-58.
[8]刘宏程, 邹艳红, 黎其万, 等.高效液相色谱分离牛奶中己烯雌酚、己烷雌酚和双烯雌酚[J].分析化学, 2008, 36(2): 245-248.
[9]YAN Wei, LI Ying, ZHAO Lixia, et al.Determination of estrogens and bisphenol A in bovine milk by automated on-line C30solid-phase extraction coupled with high-performance liquid chromatographymass spectrometry[J].Journal of Chromatography A, 2009, 1216(44):7539-7545.
[10]刘勇军, 吴银良, 姜艳彬, 等.固相萃取气相色谱-质谱联用法测定牛奶中的炔雌醇[J].畜牧与兽医, 2007, 39(9): 53-54.
[11]DU Xiaojing, WU Yan, ZHOU Han, et al.Development of a HPLCECD method for the simultaneous determination of three synthetic estrogens in milk[J].Analytical Methods, 2013, 5(11): 2822-2826.
[12]祝伟霞, 刘亚风, 杨冀州, 等.液相色谱-串联质谱法快速测定婴幼儿配方奶粉中39 种激素残留量[J].色谱, 2010, 28(11): 1031-1037.
[13]张宏, 王淑惠, 杨立学, 等.气相色谱-质谱法测定奶粉中的环境雌激素[J].现代预防医学, 2010, 37(4): 636-640.
[14]王全林, 张爱芝, 陈立仁.超高效液相色谱-串联质谱法对奶制品中苯甲酸雌二醇残留的测定[J].分析测试学报, 2009, 28(9): 1069-1073.
[15]曹燕花, 张霞, 王茜, 等.雌性大鼠血清和组织中壬基酚的高效液相色谱测定法[J].环境与健康杂志, 2010, 27(2): 138-139.
[16]赵金莲, 杜兰祥, 李月娟, 等.牛乳中三种雌激素残留的HPLC检测法[J].甘肃农业大学学报, 2009, 44(2): 153-156.
[17]刘祖强, 尹江伟, 白洁冰, 等.高效液相色谱法检测多种雌激素的结果分析[J].中国热带医学, 2006, 6(7): 1252-1253.
[18]周建科, 唐翠苓, 韩朝家, 等.固相分散萃取-液相色谱法测定奶酪中3种雌激素[J].中国乳品工业, 2012, 40(1): 56-58.
[19]郁倩, 王洪新, 安可.水中5 种雌激素的固相萃取高效液相色谱测定法[J].环境与健康杂志, 2008, 25(5): 438-441.
[20]kUEH H M, BALLSETMFITER k.Determination of endocrinedisrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per literrage[J].Environmental Science and Technology, 2001, 35(15): 3201-3206.
[21]周建科, 张明翠, 李娜, 等.豆奶粉中三种雌激素的高效液相色谱法测定[J].粮油食品科技, 2009, 17(1): 42-43.
[22]WANG S, HUANG W, FANG G Z, et a1.On-line coupling of solidphase extraction to high-performance liquid chromatography for determination of estrogens in environment[J].Analytica Chimica Acta,2008, 606(2): 194-201.
[23]YANG Yi, SHAO Bing, ZHANG Jing, et al.Determination of the residues of 50 anabolic hormones in muscle, milk and liver by very-highpressure liquid chromatography-electrospray ionization tandem mass spectrometry[J].Journal of Chromatography B-analytical Technologies in the Biomedical and Life Sciences, 2009, 877(5/6): 489-496.
[24]徐英江, 田秀慧, 张秀珍, 等.超高效液相色谱串联质谱法对水产品中8 种雌激素的测定[J].分析测试学报, 2010, 29(2): 152-156.
[25]王超, 马强, 王星.反相高效液相色谱法同时测定化妆品中的16种激素[J].色谱, 2006, 24(6): 654-655.

