L-半胱氨酸与发酵酸浆协同作用优化玉米湿磨工艺
李晓娜,张莉力,穆 静,李新华,
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.辽宁医学院食品科学与工程学院,辽宁 锦州 121001)
传统的玉米湿磨工艺是采用0.2%~0.3%的亚硫酸水溶液,在(50±2)℃条件下浸泡玉米粒40~60 h,在浸泡的过程中产生或添加部分乳酸和SO2协同作用,可增强对玉米的浸渍效果[1-2]。SO2具有还原性,可以还原二硫键,打破淀粉与蛋白质间的结合,释放玉米淀粉。但SO2对大气可造成严重污染且对人体的健康造成危害[3-5],在生产的过程中减少SO2的使用,可以减轻环境污染,有利于玉米淀粉产业的进一步发展。目前,一些研究采用酶法或发酵液浸泡玉米粒,或采用分步浸泡粉碎的方法改进玉米淀粉提取工艺取得了一定的效果[6-12]。
L-半胱氨酸是具有活泼巯基(—SH)的氨基酸,酸性条件下稳定,能还原二硫键化合物,削弱蛋白质间的结合[13-16]。因而L-半胱氨酸能够打破玉米淀粉与蛋白的结合作用,提取玉米淀粉。酸浆是在淀粉生产过程中,自然发酵而成的一种微酸味的淡乳白色液体,含有大量乳酸菌,具有凝集淀粉颗粒的能力,淀粉乳加入酸浆后,淀粉颗粒脱离了大部分蛋白质的吸附作用,沉降速度加快,从而使淀粉与蛋白质和一些细纤维分离开[17-21]。本实验采用加入L-半胱氨酸的玉米酸浆浸泡玉米,利用L-半胱氨酸使包裹在玉米淀粉外层蛋白质的二硫键断裂生成巯基,酸浆能够迅速沉降玉米淀粉的机理,缩短玉米淀粉与蛋白的分离时间,提高生产效率,以探求不使用亚硫酸水溶液浸泡的环境友好型玉米湿磨工艺。
1 材料与方法
1.1 材料与试剂
玉米:产地锦州,淀粉质量分数71.26%(干基),水分质量分数11.94%;副干酪乳杆菌副干酪亚种L1:生产甘薯淀粉用酸浆中提取,本实验室保存。
氢氧化钠、盐酸、考马斯亮蓝G-250、乙醇、磷酸、牛血清白蛋白、L-半胱氨酸均为分析纯。
MRS培养基配方:蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,柠檬酸氢二铵2.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸锰0.25 g,硫酸镁0.58 g,葡萄糖20.0 g,吐温1.0 mL,水1 000 mL,pH值为6.8。
1.2 仪器与设备
WFJ7200型分光光度计 尤尼柯(上海)仪器有限公司;HJ-3调温磁力搅拌器 金坛市晨阳电子仪器厂;pHS-3C pH计 上海雷磁仪器厂;DHG恒温鼓风干燥箱 上海精密仪器仪表有限公司。
1.3 方法
1.3.1 酸浆的制作
玉米粒加水磨浆(1∶3,m/V),200 目过滤后调pH值至4.0左右沉降蛋白质,静置后取上清液,加入乳糖1%,酵母膏1%,煮沸。冷却后调pH值至6.8左右,滤纸过滤,滤液121 ℃灭菌20 min。冷却后接入10% MRS培养基活化的副干酪乳杆菌,30 ℃培养48 h,制成纯培养玉米酸浆。将纯培养的玉米酸浆倒入磨浆后的玉米汁中,沉降蛋白质后,倒出上清液,将上清液接入10%纯培养玉米酸浆,制成自然发酵玉米酸浆,之后不断兑入提取淀粉后的废弃玉米酸浆,反复发酵培养[17-18,22-23]。
1.3.2 玉米湿磨工艺
50 g玉米粒破碎成6~8瓣→加入酸浆(1∶3,m/V)→加入酸浆体积1%的L-半胱氨酸→30 ℃浸泡48 h→充分搅拌,除去浮于液面上层的胚→加入1 000 mL水磨浆→200 目过滤→滤液30 ℃搅拌1 h→静置→除去上层浆液及麸质→加入清水洗涤→收集淀粉→烘干。
1.3.3 可溶性蛋白质增量的测定
采用考马斯亮蓝法测定溶液中可溶性蛋白含量[7]。可溶性蛋白质增量为浸泡后浸泡液中可溶性蛋白质含量与浸泡前加入L-半胱氨酸后的浸泡液中可溶性蛋白质含量的差值。
1.3.4 玉米淀粉提取率
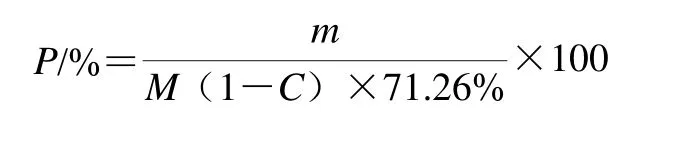
式中:P为玉米淀粉提取率/%;m为提取出的玉米淀粉质量(干基)/g;M为浸泡用玉米质量/g;71.26%为淀粉质量分数;C为玉米水分含量/%。
1.3.5 最佳湿磨工艺参数优化
采用单因素试验考察浸泡过程中酸浆用量、菌种接入量、L-半胱氨酸用量以及影响菌种活性和L-半胱氨酸作用效果的浸泡温度、浸泡pH值、浸泡时间对玉米湿磨工艺的影响,每次改变一个因素,测定浸泡液中可溶性蛋白质的增量和淀粉提取率。每组重复3 次取平均值。在单因素试验的基础上,采用响应面法优化玉米湿磨工艺参数。
根据单因素试验结果,选择对副干酪乳杆菌活力和L-半胱氨酸作用效果均有较大影响的浸泡pH值、浸泡时间以及对浸泡效果影响较大的L-半胱氨酸用量为自变量,淀粉提取率为响应值,设计三因素三水平的二次回归方程拟合自变量和淀粉提取率之间的函数关系,优化最佳浸泡参数。其他因素取值为:自然发酵酸浆用量比(m(玉米粒质量)∶V(酸浆体积))为1∶4,浸泡温度30 ℃。试验设计因素水平见表1。
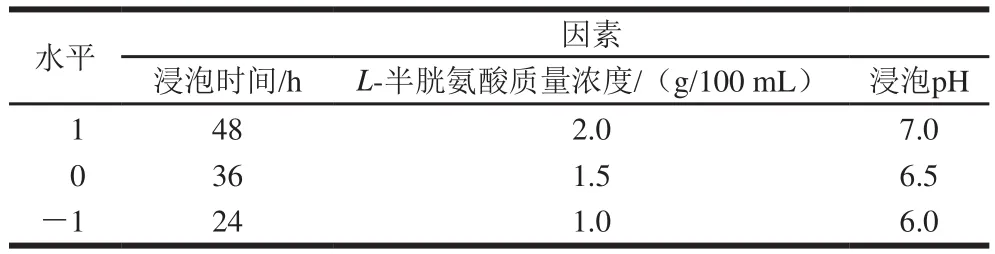
表1 响应面分析因素水平表Table 1 Factors and levels in response surface analysis
1.3.6L-半胱氨酸与酸浆协同作用湿磨工艺与SO2湿磨工艺比较
分别采用L-半胱氨酸与酸浆协同作用湿磨工艺(浸泡时间为48 h、L-半胱氨酸质量浓度1.5 g/100 mL、浸泡pH 7、自然发酵酸浆用量比(m(玉米粒质量)∶V(酸浆体积))1∶4、浸泡温度30 ℃)与传统SO2湿磨工艺((50±2) ℃,乳酸0.5%,SO20.2% 浸泡50 h)提取玉米淀粉。从组分含量、浸泡温度、浸泡时间等方面评价L-半胱氨酸与酸浆协同下的玉米湿磨工艺。
2 结果与分析
2.1 酸浆用量比对浸泡液中可溶性蛋白质增量和玉米淀粉提取率的影响
由图1可以看出,当酸浆体积用量与玉米粒质量比为2∶1时,蛋白质的增加量为0.217 5 mg/mL。之后随着酸浆用量的增大,蛋白质增加。当酸浆用量比为1∶5时,可溶性蛋白质增量最大。但再增加酸浆用量,可溶性蛋白质增量减少。这主要是由于酸浆过少,不利于蛋白质溶出。酸浆用量的增加,加速玉米粒吸水膨胀,进而削弱淀粉与蛋白质间的结合,加速蛋白质溶解[4]。当浸泡液中酸度增加,蛋白质溶解度降低。
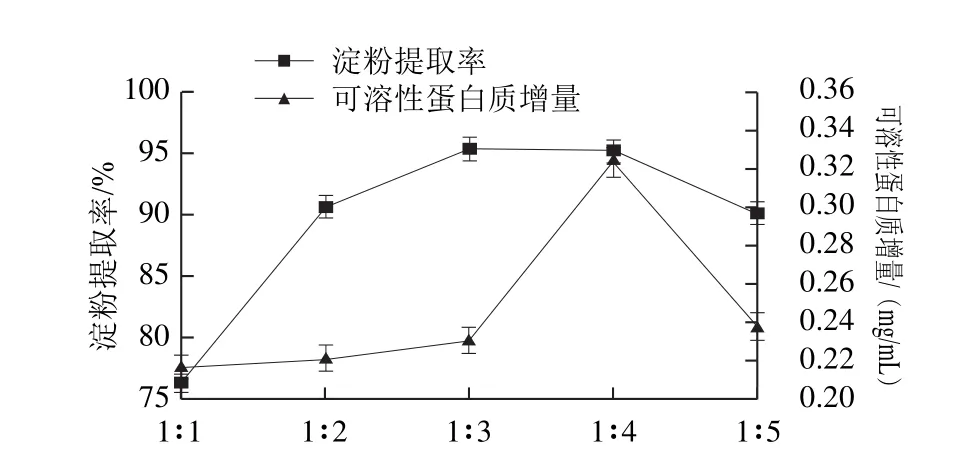
图1 酸浆用量比对浸泡液中可溶性蛋白质增量和玉米淀粉提取率的影响Fig.1 Effect of acid liquid amount on soluble protein increment and the extraction yield of corn starch
浸泡后的玉米加水磨浆后静置,在酸浆的作用下玉米淀粉迅速沉降,除去上层麸质后收集淀粉烘干。由图1可以看出,随着酸浆用量的增加,淀粉质量先增加后减少。当酸浆用量比为1∶4时淀粉提取率最高,为95.45%。随着酸浆用量的增加,部分蛋白质溶解,有利于释放玉米淀粉。但酸浆用量增大,溶液酸性增强,副干酪乳杆菌的絮凝活性减弱,不利于酸浆中淀粉与蛋白的分离[24]。实验同时采用整粒玉米浸泡,加水磨浆后静置沉淀,淀粉与蛋白质仍有联结,未分开。这可能是由于L-半胱氨酸分子较大,在浸泡的过程中很难进入玉米胚乳的内部破坏玉米淀粉与蛋白的结合,不能释放玉米淀粉。所以宜采用碎粒浸泡,酸浆的用量比以1∶4为最佳。2.2L-半胱氨酸用量对浸泡液中可溶性蛋白质增量和玉米淀粉提取率的影响
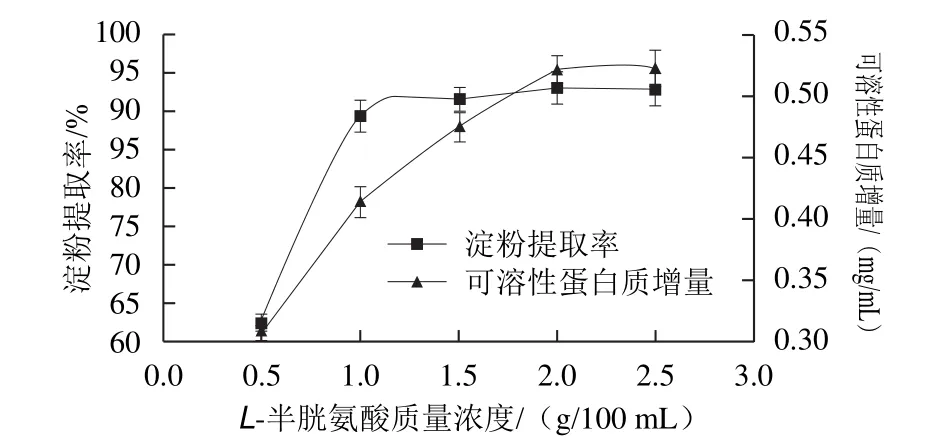
图2 L-半胱氨酸用量对玉米淀粉提取率和浸泡液中可溶性蛋白质的影响Fig.2 Effect of L-cysteine amount on soluble protein increment and the extraction yield of corn starch
L-半胱氨酸作为食品添加剂已广泛应用在面制品中[25-28]。在酸浆中L-半胱氨酸可以破坏玉米淀粉外层蛋白质的二硫键,使蛋白质结构展开,提高蛋白质的溶解度。由图2可知,随着L-半胱氨酸用量的增加,可溶性蛋白质增量逐渐增大。当L-半胱氨酸质量浓度大于2.0 g/100 mL时可溶性蛋白质增量增加缓慢。在L-半胱氨酸作用下,玉米淀粉游离出来,在副干酪乳杆菌的作用下迅速沉降。当L-半胱氨酸质量浓度0.5 g/100 mL时,淀粉提取率为62.32%,淀粉与蛋白质分离较少。随着L-半胱氨酸用量的增大,淀粉提取率增加,当L-半胱氨酸质量浓度为1.0 g/100 mL与2.5 g/100 mL时,淀粉提取率分别为89.45%和92.71%。当L-半胱氨酸1.0 g/100 mL之后淀粉提取率增加缓慢。
2.3 浸泡时间对浸泡液中可溶性蛋白质增量和玉米淀粉提取率的影响
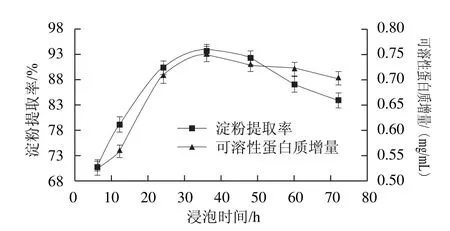
图3 浸泡时间对玉米淀粉提取率和浸泡液中可溶性蛋白质增量的影响Fig.3 Effect of steeping time on soluble protein increment and the extraction yield of corn starch
发酵酸浆中的副干酪乳杆菌絮凝活性以及L-半胱氨酸的作用效果都与浸泡时间有关。在浸泡过程中,酸浆中的副干酪乳杆菌吸收浸泡液中的营养成分,迅速繁殖生长。副干酪乳杆菌生长的过程中产生乳酸,有助于蛋白质的分解,并能防止腐败菌生长。随着浸泡时间的延长,酸浆与玉米碎粒接触充分,玉米淀粉外层包裹的层层蛋白质被逐渐分解,可溶性蛋白含量增加。由图3可知,在6~36 h范围内,可溶性蛋白质增加较快,36 h达到最大,但继续延长浸泡时间,可溶性蛋白质增量略有减少。可能是由于浸泡液酸性增强导致蛋白质溶解度降低。随着副干酪乳杆菌的生长,酸浆沉降淀粉的能力增强[24],有利于游离淀粉的分离。当浸泡时间为6~12 h时,淀粉与蛋白质分离效果较差,淀粉外包裹着少部分蛋白,淀粉较黄,酸浆沉降淀粉的速度较慢。当浸泡时间为36 h时,淀粉提取率最高,为93.71%。浸泡时间继续延长,淀粉提取率下降。这是由于随着时间的延长,副干酪乳杆菌进入衰亡期,絮凝活性降低,沉降淀粉的能力下降,淀粉与蛋白质分离不彻底[27]。
2.4 浸泡温度对浸泡液中可溶性蛋白质增量和玉米淀粉提取率的影响
有研究表明,副干酪乳杆菌在25~35 ℃之间生长旺盛和沉降淀粉能力较强,对淀粉和蛋白质等杂质的分离效果较好[24]。温度略高,可以促进L-半胱氨酸的渗透作用,加快反应速度。由图4可知,随着浸泡温度的升高,可溶性蛋白质增量先增加后降低。当浸泡温度为30 ℃时,可溶性蛋白质增量最大,为0.578 6 mg/mL。当浸泡温度为15 ℃时,淀粉提取率较低,仅为51.81%,当浸泡温度为30 ℃时,淀粉提取率最高为94.78%。因此酸浆与L-半胱氨酸协同作用浸泡玉米的最佳浸泡温度为30 ℃,此温度条件下副干酪乳杆菌的活力和产酸能力强,能有效促进蛋白质分解和淀粉沉降。
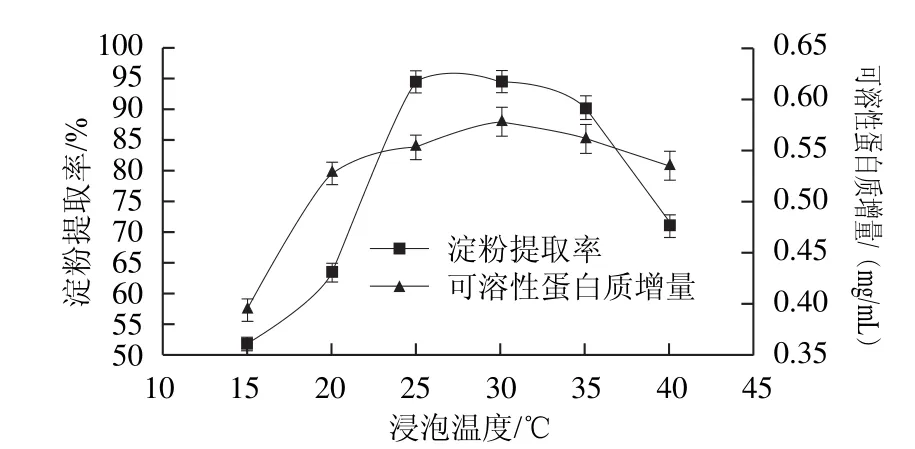
图4 浸泡温度对玉米淀粉提取率和浸泡液中可溶性蛋白质增量的影响Fig.4 Effect of steeping temperature on soluble protein increment and the extraction yield of corn starch
2.5 浸泡pH值对浸泡液中可溶性蛋白质增量和玉米淀粉提取率的影响
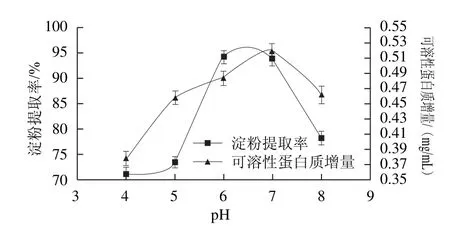
图5 浸泡pH值对玉米淀粉提取率和浸泡液中可溶性蛋白质增量的影响Fig.5 Effect of pH on soluble protein increment and the extraction yield of corn starch
L-半胱氨酸在酸性溶液中稳定,还原能力强。但溶液过酸,副干酪乳杆菌生长受到抑制[24],产酸和沉降淀粉能力减弱,浸泡效果不好。所以溶液过酸或偏碱性都可能影响蛋白质的溶出和淀粉释放。由图5可知,pH值4~7时,可溶性蛋白的增量随着pH值的增加而增大,当pH值为8时可溶性蛋白的增量减少。可以看出碱性条件下L-半胱氨酸还原二硫键的能力较差,不利于蛋白质的溶解。浸泡液的pH值为4~5时,淀粉仍与蛋白质结合,淀粉质量较少且颜色较黄。当pH值为6~8时提取的淀粉质量好,淀粉与蛋白质分离彻底,淀粉较白。这是由于副干酪乳杆菌在pH 6~8条件下生长均较好,且L-半胱氨酸稳定性好,絮凝率也较高,有利于打破玉米淀粉与蛋白质的结合,使玉米淀粉游离出来。
2.6 副干酪乳杆菌接入量对浸泡液中可溶性蛋白质增量和玉米淀粉提取率的影响
在玉米浆中分别接入酸浆体积10%、15%、20%、30%和50%的MRS培养基活化的副干酪乳杆菌,制成不同接种量的酸浆,经反复自然发酵后,浸泡碎玉米粒48 h。由图6可以看出,菌种接入量增大,副干酪乳杆菌浸泡效果增强。当接种量为10%时,可溶性蛋白质增量为0.293 6 mg/mL,接种量为50%时,可溶性蛋白质增量为0.538 1 mg/mL。但当接种量大于30%时,可溶性蛋白质增加缓慢。菌种接入量增大,副干酪乳杆菌沉降淀粉的能力增强,有效地促进淀粉与蛋白质的分离。当菌种接入量为50%时,在30 s之内与麸质迅速分离,提取率为94.09%。
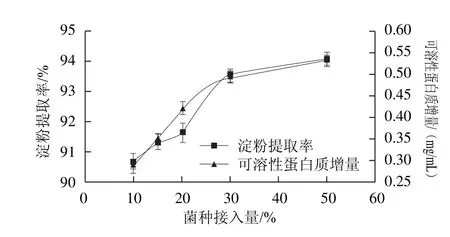
图6 副干酪乳杆菌接入量对玉米淀粉提取率和浸泡液中可溶性蛋白质增量的影响Fig.6 Effect of inoculum size of Lactobacillus paracasei subsp.paracasei L1 on soluble protein increment and the extraction yield of corn starch
2.7 响应面试验分析
2.7.1 响应面试验设计与结果
根据Box-Behnken试验设计原理,设计响应面试验[29]。试验设计与结果见表2。
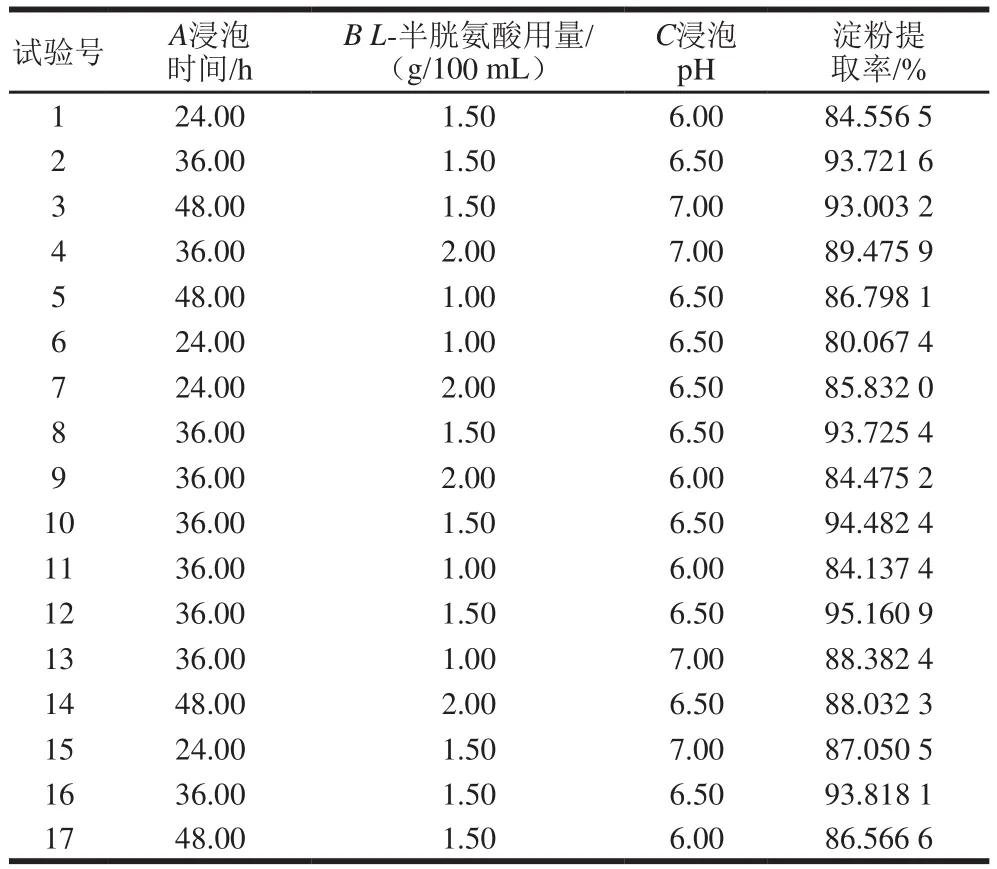
表2 工艺参数优化响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
2.7.2 方差分析
通过Design-Expert 8.0软件的Box-Behnken程序对试验结果进行响应面分析,经二次回归拟合后,得出回归模型参数估计值、方差分析见表3。
对表3中试验数据进行回归拟合分析得到回归方程为:Y=94.18+2.11A+1.05B+2.27C-1.13AB+0.99AC+0.19BC-3.91A2-5.09B2-2.48C2。由表3可知,模型P<0.01,表明响应回归方程达到了极显著水平,相关系数R2=0.982 5,表明98.25%的数据可以用此方程来解释,因而该模型拟合程度良好。RSN(信噪比)为19.374,远大于4,可知回归方程可信度很高,试验误差较小,因此可用此模型对玉米淀粉提取率进行分析和预测。从模型的失拟性方差分析可以看出,失拟项P>0.05,不显著,表明所得方程与实际拟合中非正常误差所占比例小,方程能很好地预测各因素对玉米淀粉提取率的变化。各因素影响程度从大到小的依次排列为浸泡pH值、浸泡时间和L-半胱氨酸用量。其中浸泡pH值(0.000 2)与浸泡时间(0.000 3)均达到极显著水平,L-半胱氨酸用量(0.012 6)达到了显著水平。浸泡时间、浸泡pH值和L-半胱氨酸用量二次项对淀粉提取率影响极显著。浸泡时间和L-半胱氨酸用量的交互作用(0.039 2)影响显著。
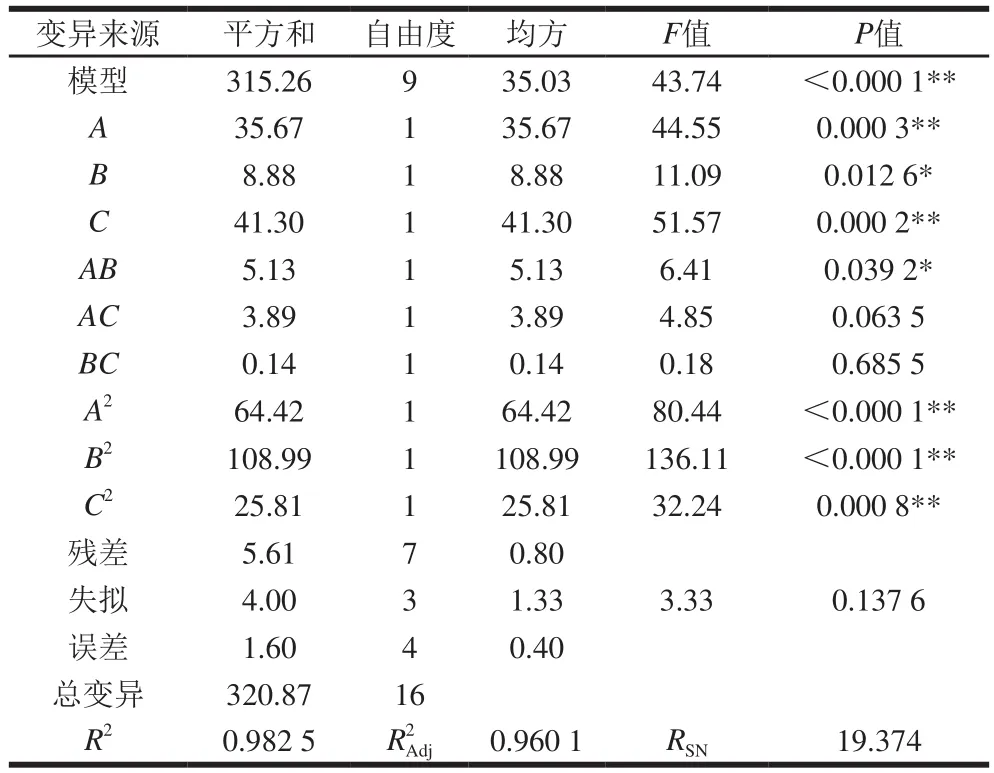
表3 回归模型方差分析结果Table 3 Analyses of variances for the established regression model
2.7.3 交互作用分析
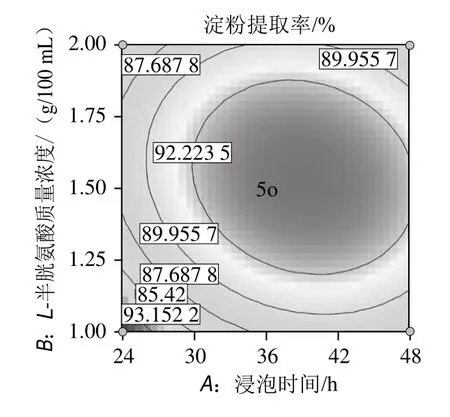
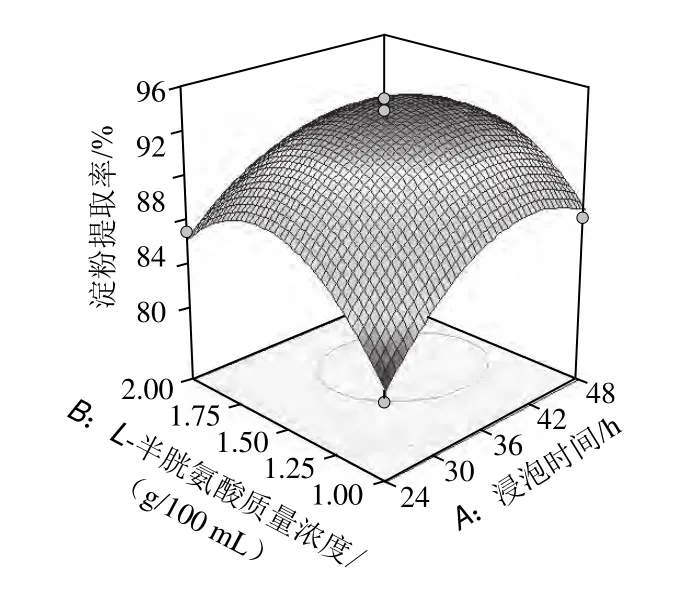
图7 浸泡时间与L-半胱氨酸用量交互作用的响应面和等高线图Fig.7 Response surface and contour plots for the interaction between steeping time and L-cysteine amount
根据图7中响应面及图中的等高线的形状分析浸泡时间和L-半胱氨酸用量对淀粉提取率的影响,由图7可以看出,交互作用显著,对淀粉提取率的影响较强。随着L-半胱氨酸用量的增加,淀粉提取率先增加后减少。随着浸泡时间的延长,淀粉提取率先增加后略有减少。
2.7.4 验证实验
通过对回归模型求解方程,对淀粉提取率的最大值进行预测为93.45%,预测参数为浸泡时间48 h、L-半胱氨酸质量浓度1.5 g/100 mL、浸泡pH值为6.83。根据实际情况,选择浸泡时间48 h、L-半胱氨酸质量浓度1.5 g/100 mL、浸泡pH 7进行3次验证实验,淀粉提取率的平均值为93.21%。与预测值差异为0.24%,说明回归方程与实际吻合较好,能够较真实反映酸浆法生产玉米淀粉工艺中淀粉的提取率。
2.8L-半胱氨酸与酸浆协同作用湿磨工艺与SO2湿磨工艺比较
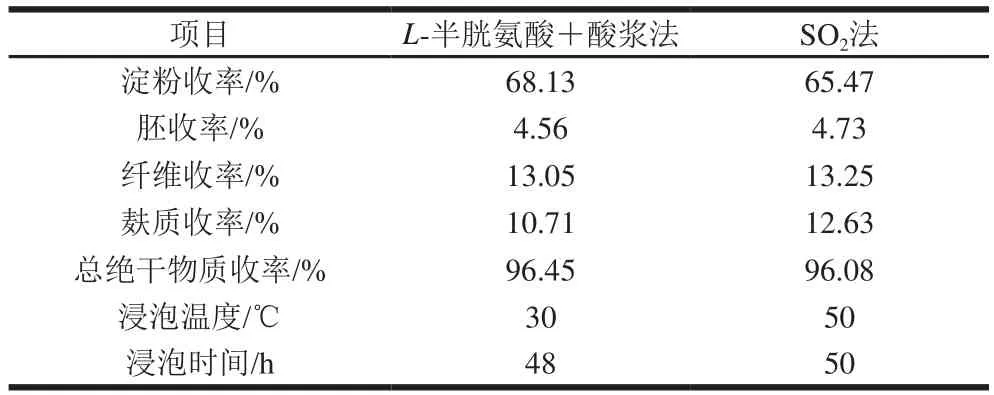
表4 L-半胱氨酸与酸浆协同作用湿磨工艺与SO2湿磨工艺对比Table 4 Comparison of wet milling using sulfur dioxide and synergistic action of L-cysteine and acid liquid
由表4可以看出,由L-半胱氨酸结合玉米酸浆玉米湿磨工艺中淀粉提取率高于传统SO2湿磨工艺,总绝干物质收率也高于传统方法。L-半胱氨酸与酸浆协同作用湿磨工艺能够在较低的温度条件下提取玉米淀粉,浸泡时间略低于SO2湿磨工艺。由表5可知,浸泡用的玉米酸浆能够反复发酵使用,不但可以解决传统方法中的环境污染问题,也有利于节约生产成本。玉米酸浆中具有絮凝活性的副干酪乳杆菌发酵液能够使玉米淀粉迅速沉降,减少淀粉与麸质的分离时间。L-半胱氨酸试剂成本虽然高于SO2,但用此法能耗低,生产设备损耗小,污水处理费用较低,降低部分生产成本,为环境友好型玉米湿磨工艺提供可能性。

表5 L-半胱氨酸与酸浆协同作用湿磨工艺与SO2湿磨工艺优缺点比较Table 5 Comparisons of the advantages and disadvantages of wet milling using sulfur dioxide and synergistic action of L-cysteine and acid liquid
3 结 论
3.1 适量的玉米酸浆能够有效促进玉米蛋白的溶解,有利于玉米淀粉提取,但在此工艺中玉米淀粉的提取率也取决于环境条件对副干酪乳杆菌絮凝活性的影响。
3.2 响应面优化设计表明,各因素影响程度从大到小依次为浸泡pH值、浸泡时间和L-半胱氨酸用量。浸泡时间与浸泡pH值是极显著水平,同时影响副干酪乳杆菌活力和L-半胱氨酸作用效果。最佳提取条件为浸泡浸泡时间48 h、L-半胱氨酸质量浓度1.5 g/100 mL、浸泡pH 7、自然发酵酸浆用量比(m(玉米粒质量)∶V(酸浆体积))1∶4、浸泡温度30℃,淀粉提取率的最大值为93.21%。
3.3 结果表明,采用发酵酸浆与L-半胱氨酸协同作用浸泡玉米碎粒生产玉米淀粉,能够在较低的浸泡温度条件下得到了较为理想的淀粉提取率。其各组分收率与SO2湿磨工艺相近。
由于L-半胱氨酸分子较大,渗透效果差于SO2浸泡法。L-半胱氨酸无法还原包埋于胚乳深处及蛋白质结构内部的二硫键,因此需要进一步破碎玉米粒使其与L-半胱氨酸充分接触。若在生产工艺中采用逆流循环浸泡的方式会进一步降低L-半胱氨酸用量,减少浸泡时间,提高玉米淀粉提取率,降低成本。
与SO2浸泡方法相比,此法浸泡温度低,能耗低、无污染。但L-半胱氨酸生产成本高于SO2,可以考虑在以后的研究中采用发酵法生产的L-半胱氨酸发酵液来代替食品级L-半胱氨酸纯品。也可通过与其他试剂结合使用同时破坏二硫键来降低生产成本。
[1]DU L, LI B, LOPES-FILHO J F, et al.Effect of delected organic and inorganic acids on corn wet milling yields[J].Cereal Chemistry, 1996,73(1): 96-98.
[2]陈璥.玉米淀粉工业手册[M].北京: 中国轻工业出版社, 2009: 62-100.
[3]高嘉安.淀粉与淀粉制品工艺学[M].北京: 中国农业出版社, 2001: 56.
[4]刘亚伟.玉米淀粉生产及转化技术[M].北京: 化学工业出版社,2003: 32-37.
[5]曹龙奎, 李凤林.淀粉制品生产工艺学[M].北京: 中国轻工业出版社, 2008: 37.
[6]赵寿经, 黄丽.利用发酵法和酶法综合技术改进玉米淀粉生产湿法浸泡工艺[J].吉林大学学报: 工学版, 2008, 38(6): 1489-1494.
[7]李锁霞.玉米淀粉生产两步浸泡工艺的研究[D].长春: 吉林农业大学, 2011: 8-27.
[8]张丹.基于提高玉米浸泡效果高产蛋白酶菌株的选育[D].长春: 吉林农业大学, 2011: 22-41.
[9]任海松.玉米淀粉的酶法湿磨工艺及其理化性质研究[D].泰安: 山东农业大学, 2007: 22-46.
[10]STEINKE J D, JOHNSON L A.Steeping maize in the presence of multiple enzymes.Ⅰ.Static batchwise steeping[J].Cereal Chemistry,1991, 68(1): 7-12.
[11]LING D, JACKSON D S.Corn wet milling with a commercial enzyme preparation[J].Cereal Chemistry, 1991, 68(2): 205-206.
[12]SINGH V, JOHNSTON D B.Pasting properties and surface characteristics of starch obtained from an enzymatic corn wet-milling process[J].Cereal Chemistry, 2002, 79(4): 523-527.
[13]陈敏元.L-半胱氨酸及其应用的进展[J].化工进展, 1992(2): 26-30.
[14]WERE L, HETTIARACHCHY N S, COLEMAN M.Properties of cysteine-added soy protein-wheat gluten films[J].Journal of Food Science, 1999, 64(3): 514-518.
[15]LAMBERT I A, KOKINI J L.Effect ofL-cysteine on the rheological properties of wheat flour[J].Cereal Chemistry, 2001, 78(3): 226-230.
[16]刘玉婷, 吴宏伟, 尹大伟, 等.半胱氨酸在食品中的应用研究[J].中国调味品, 2009, 34(12): 33-36.
[17]杨爱丽, 张莉力, 尤佳.甘薯淀粉传统工艺优化[J].中国酿造, 2009,28(9): 83-85.
[18]张莉力, 许云贺, 李新华.甘薯酸浆中微生物絮凝性研究[J].食品工业科技, 2010, 31(6): 172-175.
[19]张莉力, 许云贺, 李新华.自然发酵甘薯酸浆中乳酸菌的筛选与鉴定[J].安徽农业科学, 2009, 37(1): 9-10.
[20]王晓晕.酸浆中乳酸菌的分离鉴定及其在大米淀粉提取中的应用[D].雅安: 四川农业大学, 2010: 21-55.
[21]刘杰.酸浆法生产绿豆淀粉工艺及性质的研究[D].北京: 中国农业大学, 2005: 18-40.
[22]张莉力, 许云贺, 李新华.对甘薯淀粉具有絮凝活性的乳酸菌的分离鉴定及其特性研究[J].食品科学, 2010, 31(7): 228-231.
[23]张莉力.甘薯酸浆絮凝淀粉机理研究及发酵工艺优化[D].沈阳: 沈阳农业大学, 2010: 25-34.
[24]张莉力, 许云贺, 李新华.副干酪乳杆菌副干酪亚种L1的培养条件及絮凝活性研究[J].食品工业科技, 2011, 32(3): 139-141.
[25]李瑞.面团延伸性改良剂的研究[D].无锡: 江南大学, 2011: 12-36.
[26]ANGIOLONI A, ROSA M D.Effects of cysteine and mixing conditions on white/whole dough rheological properties[J].Journal of Food Engineering, 2007, 80(1): 18-23.
[27]ELKHALIFA A E O, El-TINAY A H.Effect of cysteine on bakery products from wheat-sorghum blends[J].Food Chemistry, 2002, 77(2):133-137.
[28]MAJZOOBI M, FARAHNAKY A, JAMALIAN J, et al.Effects ofL-cysteine on some characteristics of wheat starch[J].Food Chemistry,2011, 124(3): 795-800.
[29]MONTGOMERY D C.实验设计与分析[M].6版.北京: 人民邮电出版社, 2007: 405-462.

