TNAZ中间体(Ⅱ)的合成及表征
杨佳理,刘红利,解秋莲,刘 愆,李陶琦*
(1.陕西国防工业职业技术学院,陕西西安710300;2.西安近代化学研究所,陕西西安710065)
工程师园地
TNAZ中间体(Ⅱ)的合成及表征
杨佳理1,刘红利2,解秋莲2,刘 愆2,李陶琦2*
(1.陕西国防工业职业技术学院,陕西西安710300;2.西安近代化学研究所,陕西西安710065)
以3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪为原料,以水为溶剂,经酸性水解合成了TNAZ中间体(Ⅱ)2-叔丁氨甲基-2-硝基-l,3-丙二醇盐酸盐,并通过红外光谱、核磁共振和元素分析对其结构进行了表征。讨论了溶剂种类、水用量、盐酸用量、温度和时间对收率的影响。确定了最佳合成工艺条件为:当n(3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪)∶n(HCl)∶n(H2O)=1∶3.6∶20,控温35~45℃反应9h、55~60℃反应11h,产物纯度为98%,收率为95%。
TNAZ中间体(Ⅱ);合成;表征
TNAZ(1,3,3-三硝基氮杂环丁烷)以其高度对称的分子结构和潜在的分子张力的特点[1]成为高能量密度材料(HEDM)领域研究的热点,并以其优良的低熔点共融性[2]和安全特性[3-5]显示出在武器上广阔的应用前景[6]。但因为现有制备工艺的成本高[7,8],影响了其应用的推广。TNAZ中间体(Ⅱ)2-叔丁氨甲基-2-硝基-l,3-丙二醇盐酸盐是硝基甲烷法合成TNAZ的关键中间体[9],其合成方法直接影响其收率和TNAZ的应用成本[7,8]。为了降低合成成本,美国[7]、德国[8]、澳大利亚[9]等国家的研究人员先后开展了以硝基甲烷、甲醛为原料合成TNAZ中间体(Ⅱ)的工艺方法,使成本有所降低。毕卫宇[10]、舒远杰[11]等研究了以硝基甲烷和甲醛为原料、甲醇为溶剂,经酸性水解合成TNAZ中间体(Ⅱ)的工艺方法, TNAZ中间体(Ⅱ)的收率达到83%左右[10,11],降低了TNAZ的成本。我们研究了以水为溶剂、3-叔丁基-5-羟甲基-5-硝基四氢-1,3-噁嗪为原料,经酸性水解合成TNAZ中间体(Ⅱ)的方法。该法目标物收率由甲醇为溶剂方法的83%左右提高到了95%,对降低TNAZ生产成本和提高应用范围具有重要的意义。
1 实验部分
1.1 合成原理
TNAZ中间体(Ⅱ)2-叔丁氨甲基-2-硝基-l, 3-丙二醇盐酸盐的合成是以3-叔丁基-5-羟甲基-5-硝基四氢-1,3-噁嗪为原料,在HCl水溶液中经水解脱去甲醛得到。其原理如下式所示:
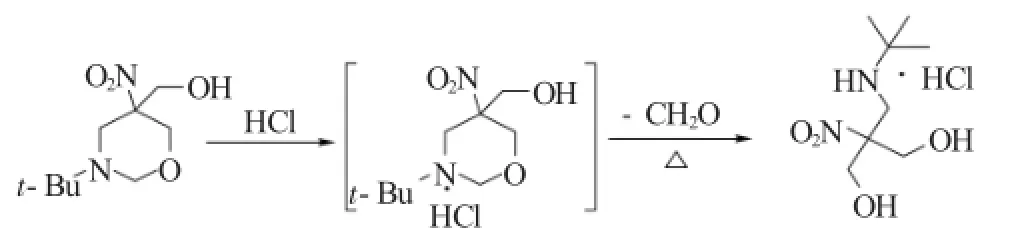
1.2 试剂
3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪(自制98%);HCl(A.R.36%~38%);去离子水。
1.3 仪器与测试方法及条件
红外光谱使用美国Nicolet公司Nexus870型傅里叶变换红外光谱仪,采用KBr压片法。
核磁共振谱使用瑞士布鲁克公司Bruker-AV500型超导核磁共振谱仪,取适量的合成产物样品于∅5mm核磁样品管中,用0.5mL的重水(D2O)溶解,然后把样品管置于磁体中,用Bruker的标准脉冲序列测其1H NMR、13C NMR谱。1H NMR观测频率为500.13MHz,13CNMR观测频率为125.721MHz。测试温度为25℃。1H NMR、13CNMR内标为TMS(80)。
元素分析使用德国elementar公司Vario ELⅢ元素分析仪,产物纯度使用日本天津岛公司LC-2010A液相色谱仪测定。
1.4 合成TNAZ中间体(Ⅱ)
将10mol去离子水加入具有搅拌、温度计、冷凝管、加料漏斗的500mL四口玻璃烧瓶中,将含1.8mol HCl的浓盐酸经加料漏斗加入去离子水中。搅拌下加入0.5mol 3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪,并缓慢加热至完全溶解,控温35~45℃反应9h、控温55~60℃11h。
反应到时后,将反应液经旋转蒸发器减压浓缩至产生结晶。结晶经过滤后,用异丙醇少许洗涤并过滤、干燥得白色固体合成产物TNAZ中间体(Ⅱ)。液相色谱仪检测其纯度为98%,收率95%。
2 结果与讨论
2.1 溶剂的选择
从合成原理看,水解过程在盐酸存在下进行。在酸性水解过程中,文献报道有用有机溶剂甲醇为溶剂的水解工艺[10,11]。但是,和有机溶剂相比,HCl更易溶于无机溶剂水中。虽然原料3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪在甲醇中的溶解性好于在水中的溶解性,但在HCl存在下3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪会以季铵盐的形式存在,季铵盐在水中的溶解性好于在甲醇中的溶解性,更重要的是产物TNAZ中间体(Ⅱ)在水中的溶解性好于在甲醇中的溶解性,以水为溶剂更有利于反应的进行。
此外,以水为溶剂的成本要低于以甲醇为溶剂成本。所以,选择甲醇作为溶剂为宜。
2.2 水用量的影响
水的用量通过影响HCl的浓度来影响反应的进程和进度,水的合理用量有利于提高产物收率。当n(3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪)∶n(HCl)=1∶3.6,控温35~45℃反应9h、55~60℃反应11h,水用量对产物TNAZ中间体(Ⅱ)得率的影响见表1。

表1 水对反应的影响Tab.1Effect of water on the reaction
从表1中知道,随着水用量的增加,产物的收率先升高然后降低。一方面由于水量少时,反应物溶解不好,影响了反应的进行,另一方面水量太多时,HCl浓度太低而影响反应进行。
2.3 HCl用量
HCl用量对反应的影响体现在HCl对反应的影响上。从反应原理可以知道,HCl参与了水解反应。HCl先与原料3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪生成季铵盐,然后经水解生成产物,其用量影响产物的收率。在n(3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪)∶n(H2O)=1∶20,控温35~45℃反应9、55~60℃反应11h,HCl用量对反应的影响见表2。

表2 HCl对反应的影响Tab.2Effect of HCl on the reaction
从理论上,HCl与3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪的摩尔比应该为1∶1,但表5说明实际的摩尔比远大于理论值。这是由于为了使反应物均匀地溶解在溶剂中水和反应物的摩尔比为20,随着HCl摩尔数的增加,盐酸的浓度增加。较高的盐酸浓度有利于反应物形成季铵盐,进而水解为目标产物。所以,HCl与3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪的摩尔比应该为3.6较好。
2.4 反应温度和时间
TNAZ中间体(Ⅱ)的生成过程包括两个阶段,第一个阶段是HCl和3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪反应生成季铵盐,此阶段的反应是放热反应,适宜在较低温度下进行。第二个阶段是季铵盐经水解脱去1mol甲醛生成TNAZ中间体(Ⅱ),适宜在较高温度下进行。
在n(3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪)∶n(HCl)∶n(H2O)=1∶3.6∶20的条件下,以反应时间和温度为因素,确定其水平:第一阶段温度为25~35℃、35~45℃、45~55℃,反应时间为8、9、10h;第二阶段温度为50~55℃、55~60℃、60~65℃,反应时间为10、11、12h。选用正交表L9(3)4设计正交试验,确定的最佳条件为:第一阶段阶段反应温度为35~45℃,反应时间为9h;第二阶段反应温度为55~60℃,反应时间为11h。同时,第一阶段的反应温度和反应时间相对于第二阶段的反应温度和反应时间对合成反应的影响较大,其中第一阶段反应温度影响最大。
n(3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪)∶n(HCl)∶n(H2O)=1∶3.6∶20,较佳实验条件验证实验结果见表3。

表3 验证试验结果Tab.3The result of experiment
2.5 产物表征
产物红外光谱见图1。

图1 产物红外光谱图Fig.1IR spectrum of the produc
图1中3321、3155cm-1处的吸收谱带是合成产物分子中羟基的伸缩振动,3077、2977、2780、2635、2516、2478、2383cm-1处的吸收谱带是其分子中基团的伸缩振动,1573、l550cm-1处的强吸收谱带是NH的弯曲振动,l354cm-1是C-NO2的伸缩振动,1106cm-1处的谱带是的C-N伸缩振动,1020cm-1处的谱带是C-O的伸缩振动。
产物核磁共振波谱1H NMR、13C NMR谱图见图2、3。
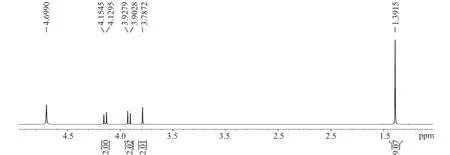
图2 合成产物的1H NMR谱图Fig.21H NMR of the product

图3 合成产物的13C NMR谱图Fig.313C NMR of the pruduct
图2所示合成产物的1H NMR中,δ4.69的峰是溶剂峰(未氘代完全的水),其余信号为样品的谱峰。氢谱中设定δ4.14的d峰的积分值为2,图谱总积分值为l5,与预定分子结构(图4)中的与碳相连的氢原子数目完全一致。δ4.14(d,J=12.50)、δ3.92(d,J=12.55)、δ3.79(S)从化学位移、积分面积分析应为亚甲基信号,δ3.79(s)应为甲基信号。由样品结构式可知该化合物中存在分子的对称面,因此l、3位的两个亚甲基出峰的位置相同,但是该对称面不平分亚甲基上的两个氢原子,因此这两个氢原子具有不同的化学位移数值,因而它们形成了AB体系,产生两重峰,故δ4.14(d,J=12.50Hz)为H-1a和H-3a,δ3.92(d,J=12.55Hz,0.94 Hz)H-lb和H-3b,而δ3.79(s)为H-4。H-6、H-7、H-8为叔丁基上的甲基,它们是化学等价的,因此,δ1.39(S)为H-6、H-7、H-8的信号。由于使用的溶剂为重水,活泼氢信号未观察到。
图3所示合成产物的13C NMR中,5条谱线均为样品碳信号,强度较高的谱线为连有氢的碳。结合DEPT-135谱可对该5条谱线信号做出碳的种类确认,即确定分子中有两种亚甲基CH2、一种甲基CH3、2种季碳,与预定结构也一致。
对合成产物的一维NMR图谱进行分析,认为结构符合其预定结构见图4。
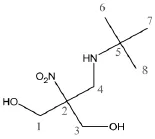
图4 合成产物的结构Fig.4Chemical constitution of the product
产物元素分析(%),C8H19O4N2C1,理论值:C39. 588,H 7.835,N 11.546,O 26.392,C 114.639;实测值:C39.460,H 7.849,N11.400,O26.501,C114.790,与理论值基本相符。
经红外光谱、核磁共振谱和元素分析证明白色固体合成产物为TNAZ中间体(Ⅱ)2-叔丁氨甲基-2-硝基-l,3-丙二醇盐酸盐。
3 结语
(1)以3-叔丁基-5-羟甲基-5-硝基四氢-l, 3-噁嗪为原料,以水为溶剂,经酸性水解合成了TNAZ中间体(Ⅱ)。
(2)确定了最佳合成条件,当n(3-叔丁基-5-羟甲基-5-硝基四氢-l,3-噁嗪)∶n(HCl)∶n(H2O)=1∶3.6∶
20,控温35~45℃反应9h、55~60℃反应11h,产物纯度98%,收率为95%。
[1]王伯周,朱春华,龙秋和.1,3,3-三硝基氮杂环丁烷的合成及性能初步研究[J].含能材料,1995,3(1):7-9.
[2]张教强,胡荣祖.1,3,3-三硝基氮杂环丁烷与几种材料的相容性[J].含能材料,2001,9(2):57-59.
[3]李洪珍,舒远杰,黄弈刚,等.高能量密度材料l,3,3-三硝基氮杂环丁烷研究进展[J].化学研究与应用,2003,15(1):111-114.
[4]丁黎,李英勃.L,3,3-三硝基氮杂环丁烷的合成方法及性能研究[J].火炸药学报,2002,25(4):42-44,165.
[5]Pavel Marecek,Kamil Dudek,Darel Vavra.Laboratory testing of TNAZmixtures.Proc32nd Int Annual ConfICT,2001,90/1-90/8.
[6]张光全.1,3,3-三硝基氮杂环丁烷的工业化合成现状及其应用进展[J].含能材料,2002,10(4):174-177.
[7]Schmid Konrad,Kaschmieder Doris.Sythesis and properties of TNAZ.Proc3ndInt Annual ConfICT,2000,10/1-20/9.
[8]Duncan SW,Matthew D C.Evaluation of l,3,3-trinitroazetidine(TNAZ)-AHighperformancemelt-castableexplosive.ADA383074.1994.
[9]Michael AHiskey,Mchael DCobum.Synthesis of l,3,3-trinitroazetidine[P].U.S.:5336784.1994.
[10]毕卫宇,刘愆,张志忠,等.TNAZ的硝基甲烷法合成研究[J].火炸药学报,2002,25(4):32-32.
[11]舒远杰,李洪珍,黄奕刚,等.1,3,3-三硝基氮杂环丁烷的合成[J].有机化学,2003,23(10):1139-1141.
Synthesis and characterization of TNAZ intermediate(Ⅱ)
YANG Jia-li1,LIU Hong-li2,XIE Qiu-lian2,LIU Qiang2,LI Tao-qi2*
(1.Shaanxi Institute of Technology,Xi'an 710300,China;2.Xi'an Modern Chemistry Research Institute,Xi'an 710065,China)
TNAZ Intermediate(Ⅱ)2-Tert-butylaminamethyl-2-nityl-l,3-propanediol hydrochloride was synthesized with 3-tert-butyl-5-nitro-tetrahydro-1,3(4H)-oxazine as materials,water as solvent by acid hydrolysis,The yield of TNAZ Intermediate(Ⅱ)was 95.0%on defilite conditions.The conditions were as follows: n(3-tert-butyl-5-nitro-tetrahydro-1,3(4H)-oxazine)∶n(HCl)∶n(H2O)=1∶1∶3.6∶20,35℃~45℃/9h,55℃~60℃/11h.The product was characterized by IR,HNMR,CNMR and element alanalysis.
TNAZ Intermediate(Ⅱ);synthesis;characterization
TQ223.2
A
1002-1124(2014)09-0052-04
2014-04-21
杨佳理(1964-),男,陕西户县人,实验师,主要从事精细化学教学和精细化工产品的研发。

