三叶人字草对胶原诱导关节炎大鼠的治疗及其抗氧化研究❋
罗 丹,荆生龙,赵宏艳,许慧慧,周晓峰,肖 诚
(1.北京中医药大学,北京 100029;2.中日友好医院临研所,北京 100029;3.江西中医学院,南昌 330004;4.中国中医科学院中医基础理论研究所,北京 100700)
类风湿关节炎(rheumatoid arthritis,RA)是一种原因不明的、慢性的、多发性的以关节对称性损害为主要表现的自身免疫性疾病,病理表现主要在于炎细胞浸润、滑膜增生、血管翳形成以及关节软骨和骨的侵蚀与破坏等。慢性炎症反应的持续发展,是类风湿关节炎的主要病理过程[1],因此抑制炎症反应就能有效地控制RA的进展。
三叶人字草(Kummerowia striata(Thunb)Schindl,Ks)为豆科鸡眼草属鸡眼草,潮汕地区别名称为鹿含草,外地别名称为鸡眼草、马帚、苍蝇翅等。为一年生草本,叶柄极短、一柄三叶,叶脉呈人字形排列,拉断叶片裂口即成人字形,一年之中除冬季外,其他季节均可采摘。Ks味甘淡,入肺肾经,性微凉、无毒,主治咳嗽胸痛、暑热口渴、小便尿血、急性胃肠炎、夜盲症等。现代研究表明,Ks具有抗炎镇痛作用,对炎症后期的结缔组织增生具有良好的抑制作用[2]。不同溶剂的Ks提取物均具有良好的抗氧化性,其总酚含量与DPPH 自由基清除能力有关[3]。然而目前尚未发现Ks对RA治疗的相关报道,因此本研究试图通过胶原诱导性关节炎(collagen- induced arthritis,CIA)大鼠模型,探讨其对RA的影响及共作用机理。
1 材料与方法
1.1 动物和药物
选用健康SPF级雄性SD大鼠,体质量160~180 g,购于军事科学院(合格证号SCXK(京)2007-004)。饲养于中国中医科学院中医基础理论研究所动物房(许可证号SYXK(京)2010-0032)。
Ks购自广州清平药材市场,经广州中医药大学中药学院中药标本中心鉴定为豆科植物Ks的全草干品。称取干燥全草加水煎煮1 h,共煎煮3次,合并煎液过滤,滤液浓缩至每100 ml相当于原生药160 g,置于冰箱冷藏备用,临用时用生理盐水稀释成所需浓度。
1.2 实验仪器和试剂
LEICA CTR6000 显微镜(德国Leica 公司产品);Leica-Qwin图像分析仪系统(德国Leica 公司产品);丙二醛(MDA)、总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)的测定试剂盒购于南京建成生物工程研究所(批号20130128、20130123、20130124);牛II型胶原购于美国Chondrex公司(批号101512);不完全弗氏佐剂购于美国Chondrex公司(批号100106)。
2 方法
2.1 分组与建立模型
将50只大鼠按随机数字表法分为正常对照组(N组)、模型组(M组)、三叶草低剂量组(KsL组)、三叶草中剂量组(KsM组)、三叶草高剂量组(KsH组),每组10只。除N组外,其余动物制备成CIA模型。
造模方法参照[4]如下:将浓度为2 mg/ml的牛II型胶原与等体积的不完全弗氏佐剂用均质器混合均匀,操作过程均在冰上进行。大鼠的尾根部75%酒精消毒后,于尾根部皮下注射上述终浓度为2 mg/mL的乳剂0.2 ml,N组大鼠同部位注射等体积的生理盐水。7 d后,在相同部位再次免疫,剂量为0.1 ml。第2次免疫后约1周左右出现多发性关节炎。
2.2 给药
于第2次免疫后1周,各给药组大鼠分别按70 kg成人等效剂量给予Ks低剂量(4 g生药/kg)、中剂量(8 g生药/kg)、高剂量(16 g生药/kg),每天1次灌胃给药;N组大鼠给予等量生理盐水。给药时间均固定在每天9时,给药周期为4周。
2.3 关节肿胀度的评定
于第1次免疫后14 d每隔5 d即第1、6、11、16、21天和第26天对大鼠左右后足关节红肿程度进行关节炎指数(Arthritis Index,AI)评定,累积评分最高为8分,标准如下[5~7]:0分:无关节炎;1分:个别足趾发红、肿胀;2分:大部分足趾及足底肿胀;3分:踝关节以下全部肿胀;4分:肿胀累及踝关节以上且不能负重。
2.4 大鼠踝关节病理学观察
取大鼠的踝关节多聚甲醛固定36 h后入10% EDTA脱钙,酒精逐级脱水,二甲苯透明,石蜡包埋、切片,常规苏木素-伊红(HE)染色。光镜下观察踝关节的病理学改变,包括滑膜增生、血管翳生成、炎细胞浸润、软骨及骨的病理改变等。
2.5 检测血清MDA、T-AOC、T-SOD
按照试剂盒说明书操作,硫代巴比妥酸法测定MDA,铁还原法测定T-AOC,羟胺法测定T-SOD。
3 统计学方法
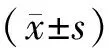
4 结果
4.1 大鼠AI的变化
表1显示,随着给药时间的延长,3个给药组大鼠AI积分都明显下降。从第16天开始, KsH组的AI积分与M组比较显著降低(P<0.01),其作用一直持续到第26天(P<0.01)。与M组比较,KsL组、KsM组也有下降趋势,但差异无统计学意义。
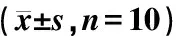
表1 各组大鼠AI 的变化
注:与N组比较:*P<0.05,**P<0.01;与M组比较:#P<0.05,##P<0.01(下同)
4.2 大鼠踝关节的病理学改变
病理学图片显示,N组关节结构、软骨和关节周围软组织未见异常,滑膜组织无增生。M组关节内可见明显的滑膜组织增生,淋巴细胞和巨噬细胞浸润。关节面完全破坏,增生的滑膜和血管形成血管翳浸入软骨或骨组织,软骨表层可见明显的坏死,关节腔内也可见坏死剥脱的软骨和滑膜组织。KsL组滑膜组织增生、炎性细胞浸润及关节破坏无明显改善。KsM组滑膜组织的增生和炎性细胞浸润略有减少,可见关节面明显的破坏;KsH组滑膜增生和滑膜组织水肿明显减轻,淋巴细胞和巨噬细胞浸润减少,血管新生显著减少,血管内膜增厚减轻,少见血管翳形成,关节面破坏减轻。

图1 各组大鼠踝关节的病理变化(A)N组;(B)M组;(C)KsL组;(D)KsM组;(E)KsH组。(HE,100×)
4.3 大鼠血清MDA含量、T-AOC和T-SOD活性的变化
表2显示,与N组比较,M组中的MDA含量、T-AOC和T-SOD活性差异有统计学意义(P<0.01)。与M组比较,各治疗组MDA含量明显降低(P<0.05),KsH组的T-AOC活性显著升高(P<0.05),KsM组、KsH组T-SOD的活性显著升高(P<0.01),但各治疗组之间差异无统计学意义。

表2 各组大鼠血清MDA含量、T-AOC和T-SOD活性的变化
5 讨论
RA是影响多个关节的慢性病,滑膜组织的增生和炎性细胞的浸润又是其主要病理特点,由此而形成的血管翳能对受影响关节的软骨和骨造成不可逆转的破坏。而本研究中所采用的CIA大鼠模型与人类RA在许多方面相似,因此它被普遍用作中药治疗RA的研究模型[4, 8]。
氧自由基是细胞代谢的产物,在生理条件下发挥第二信使的作用,但在RA存在时,氧自由基会过度表达,对细胞组织等产生毒性作用,是造成组织损伤的主要因素之一,也会影响到RA病人对治疗的反应[9~11]。SOD是体内抗氧自由基的重要生理防线,能够有效地清除体内自由基,对体内的氧化/抗氧化系统稳定有着十分重要的作用。MDA是氧自由基攻击生物膜中的多聚不饱和脂肪酸发生脂质过氧化而形成的脂质过氧化产物,脂质过氧化产物与蛋白中赖氨酸残基反应产生免疫原性分子,从而加剧炎症,而较长链的多不饱和脂肪酸尤其能增强脂质过氧化反应和导致细胞损害的氧化应激[12],而对T-AOC的检测又能客观反映机体内抗氧化酶类的浓度。因此,增强抗氧化能力将能有效缓解RA[4]。而现代研究证实,Ks中黄酮、多糖、氨基酸和多酚具有较强清除自由基的能力,对DPPH 自由基和羟自由基的清除率表现为显著的量效关系[13]。Ks对IgA肾病模型也具有很好的抗氧化活性,能够清除自由基,提高抗氧化酶活力[14]。
在本研究中,观察到M组的血清MDA含量明显升高,同时降低了血清T-AOC和T-SOD活性,具有显著的氧化效应,而关节的AI值和病理学图片也显示关节的炎症程度较重,相反,经Ks治疗后,关节的炎症程度得到降低,尤其KsH组抗氧化效果明显,对CIA模型能降低其MDA含量,提升T-AOC和T-SOD活性,关节的病理学图片显示滑膜组织的增生和炎性细胞的浸润减少,软骨及骨损伤等也出现明显缓解。因此本研究结果提示,Ks可能通过有效的抗氧化效应,对抗氧自由基来达到一定的缓解和治疗RA的目的,其具体机制值得进一步研究。
[1] YifanW,Dengming W, Zheng L, et al. Triptolide inhibits CCR5 expressed in synovial tissue of rat adjuvant-induced arthritis[J]. Pharmacol Rep, 2007, 59(6): 795-799.
[2] 周玖瑶, 黄桂英,韩坚. 三叶人字草抗炎镇痛作用研究[J]. 中国医药导报, 2007, 2(4): 155-156.
[3] 苏炜,李培源, 霍丽妮,等.三叶人字草抗氧化活性研究[J].时珍国医国药, 2011,10(22): 2438-2439.
[4] XiaoC, Li J, Dong XX, et al.Anti-oxidative and TNF-alpha suppressive activities of puerarin derivative (4AC) in RAW264.7 cells and collagen-induced arthritic rats[J]. Eur J Pharmacol, 2011,666(1-3): 242-250.
[5] KawahitoY,CannonGW,Gulko PS, et al.Localization of quantitative trait loci regulating adjuvant-induced arthritis in rats: evidence for genetic factors common to multiple autoimmune diseases[J]. J Immunol, 1998,161(8): 4411-4419.
[6] Meng HC, Griffiths MM, Remmers EF,et al., Identification of two novel female-specific non-major histocompatibility complex loci regulating collagen-induced arthritis severity and chronicity, and evidence of epistasis[J]. Arthritis Rheum, 2004,50(8): 2695-2705.
[7] Remmers EF, Longman RE, Du Y, et al.A genome scan localizes five non-MHC loci controlling collagen-induced arthritis in rats[J]. Nat Genet, 1996,14(1): 82-85.
[8] Xiao C, Zhao LH, Liu ZL, et al., The effect of triptolide on CD4+and CD8+cells in Peyer’s patch of DA rats with collagen induced arthritis[J]. Natural Product Research, 2009,23(18):1699-706.
[9] SurapneniKM, VSChandrasada Gopan. Lipid peroxidation and antioxidant status in patients with rheumatoid arthritis[J]. Indian J Clin Biochem, 2008, 23(1): 41-44.
[10] Halliwell B, MGrootveld.The measurement of free radical reactions in humans. Some thoughts for future experimentation[J]. FEBS Lett, 1987,213(1): 9-14.
[11] Di Cesare Mannelli L, Bani D, Bencini A, et al.Therapeutic Effects of the Superoxide Dismutase Mimetic Compound Mn(II)Me2DO2A on Experimental Articular Pain in Rats[J]. Mediators Inflamm, 2013,article ID:905360.
[12] Darlington LG , TWStone.Antioxidants and fatty acids in the amelioration of rheumatoid arthritis and related disorders[J]. Br J Nutr, 2001,85(3): 251-269.
[13] 李南薇,缪科亦.人字草功能性成分的抗氧化活性研究[J].食品工业科技, 2013, 3(34):128-131.
[14] 王霞,周玖瑶, 孙毅东. 三叶人字草对IgA肾病模型大鼠的影响[J].广州中医药大学学报, 2010,2 (27): 147-150+155.

