血培养阳性报警时间在大肠埃希菌血流感染患者预后评估中的应用价值研究
黄 磊,孙立颖,严 岩
大肠埃希菌(Escherichia coli,E.coli)是引起血流感染最常见的革兰阴性杆菌,其引起的感染程度轻重不一,可引起一过性菌血症,也可引起严重脓毒血症甚至脓毒血症休克,增加患者病死率[1]。但目前用于预测大肠埃希菌血流感染患者预后的指标较少[2-3]。阳性报警时间(time to positivity,TTP)是指把血培养瓶放入仪器至产生阳性报警信号所用的时间,其与细菌初始浓度及菌株自身的生长特性有关。国外研究表明,TTP能预测多种细菌引起的血流感染患者的预后[4-7],但国内相关研究报道较少。由于不同地区菌株及患者特点的差异,TTP的最佳诊断切点和诊断价值也存在差异。本研究旨在探讨血培养TTP对大肠埃希菌血流感染患者的预后评估价值。
1 对象与方法
1.1 研究对象 选择2008—2012年在我院行血培养分离到大肠埃希菌且病历资料完整的成年住院患者174例,其中男105例,女69例;年龄16~94岁,平均(59.6±18.4)岁;恶性肿瘤42例,白血病15例,慢性肾脏病13例,免疫系统疾病8例,糖尿病7例,冠心病5例,其他84例;排除不同时间分离到重复菌株患者及混合感染患者(同一份血培养中同时分离到大肠埃希菌和其他细菌或真菌),对同一患者血培养多次分离到大肠埃希菌时,仅选取首次分离菌株。由于儿童血流感染特点不同于成人[8],且所用血培养瓶及采血量也与成人不同,TTP在儿童中的应用情况可能不同于成人,本研究未纳入儿童患者;同时考虑到不同仪器和不同血培养瓶对TTP可能产生的影响,因此,本研究仅纳入在BACTEC 9240自动化血培养仪中培养的需氧瓶培养结果。
1.2 分组方法 从BACTEC 9240自动化血培养仪连接的EpiCenter数据库中读取各菌株的TTP,参照文献[3,6,9]中的方法,以TTP的P25为切点,将患者分为低TTP组43例和高TTP组131例,比较两组患者临床特征及预后情况。临床特征包括年龄、性别、院内获得性感染(患者在入院48 h后分离到大肠埃希菌)发生率、菌株产超广谱β内酰胺酶(ESBL)率、基础状态(以Charlson评分≥2分表示基础状态差)[10]、原发感染灶、感染相关危险因素;预后情况包括严重脓毒血症及脓毒血症休克发生率、住院期间死亡率,严重脓毒血症及脓毒血症休克的诊断参照文献[11]。
1.3 菌株鉴定 采集所有患者外周静脉血8~10 ml,注入血培养瓶后立即运送至微生物室上机培养,严格按照临床微生物学血培养操作规范进行操作[12]。采用美国BD公司BACTEC 9240自动化血培养仪及其配套需氧瓶(BD BACTEC Aerobic/F culture vials)进行血培养,孵育温度35 ℃,孵育时间 5 d;BACTEC 9240自动化血培养仪可自动记录TTP,然后从与之连接的EpiCenter数据库读取不同菌株的TTP。血培养标本阳性报警后涂片镜检、转种培养18~24 h,挑取单个菌落,采用法国生物梅里埃公司VITEK 2 Compact自动化鉴定仪进行菌株鉴定和药敏试验。
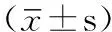
2 结果
2.1 菌株鉴定及药敏试验结果 经Kolmogorov-Smirnov检验,TTP为非正态分布,中位数为9.49 h,P25和P75分别为7.13 h和13.00 h;分离的174株大肠埃希菌菌株中,产ESBL菌株100株,未发现碳氢霉烯类抗生素耐药菌株。
2.2 临床特征及预后情况 两组患者中高龄(≥65岁)比例、男性比例、院内获得性感染发生率、基础状态差比例、菌株产ESBL率、原发感染灶、感染相关危险因素比较,差异均无统计学意义(P>0.05);低TTP组严重脓毒血症及脓毒血症休克发生率、住院期间病死率高于高TTP组,差异均有统计学意义(P<0.05,见表1)。

表1 低TTP 组和高TTP组患者临床特征与预后比较〔n(%)〕
注:*腹腔感染包括原发性或继发性腹膜炎、胆囊炎、胆管炎、腹腔脓肿;ESBL=超广谱β内酰胺酶

注:A为TTP对严重脓毒血症及脓毒血症休克预测价值的ROC曲线,B为TTP对住院期间死亡预测价值的ROC曲线
图1 TTP对严重脓毒血症及脓毒血症休克、住院期间死亡预测价值的ROC曲线
Figure1 ROC curve of TTP for predicting severe sepsis and septic shock,and in-hospital death
2.3 TTP预测价值 Logistic回归分析结果显示,低TTP预测患者发生严重脓毒血症及脓毒血症休克的OR为6.618〔95%CI(3.036,14.429),P<0.001〕,预测患者住院期间死亡的OR为4.159〔95%CI(1.623,0.657),P=0.003〕。绘制ROC曲线发现,TTP≤9.72 h为预测患者发生严重脓毒血症及脓毒血症休克的最佳切点,此时的AUC为0.792,95%CI为(0.724,0.850),敏感度为85.7%,特异度为53.6%,准确度为中等(见图1A);TTP≤9.38 h为预测患者住院期间死亡的最佳切点,此时的AUC为0.708,95%CI为(0.635,0.775),敏感度为76.4%,特异度为72.1%,准确度为中等(见图1B)。
3 讨论
大肠埃希菌是引起血流感染最常见的革兰阴性杆菌,文献报道其在我国血培养病原菌构成中所占比例为18.4%或34.9%[14-15]。大肠埃希菌可引起一过性菌血症,也可引起严重脓毒血症甚至脓毒血症休克,增加患者病死率[1]。因此,寻找能够快速评估大肠埃希菌血流感染患者预后的指标,为临床不易发现的早期菌血症提供预警信息,对指导抗感染治疗具有重要意义。TTP具有简便、快速、成本低廉的优点,国外文献报道其在金黄色葡萄球菌、大肠埃希菌和肺炎链球菌引起的血流感染中具有较高的预测价值[4-7]。体外试验表明,TTP与接种细菌的初始浓度有关[16],而血液中细菌浓度与患者感染严重程度有关,因此,TTP可用于预测血流感染患者的预后[6]。目前,基于我国人群的相关研究较少,且由于不同地区菌株与患者特点可能存在差异,因此,TTP的最佳诊断切点和诊断价值有必要在我国进行评价和验证。
本研究结果显示,低TTP组严重脓毒血症及脓毒血症休克发生率、住院期间病死率均高于高TTP组,表明低TTP提示大肠埃希菌血流感染患者病情严重、预后差,与文献报道一致[3,5-6,9]。但两组患者中高龄(≥65岁)比例、男性比例、院内获得性感染发生率、基础状态差比例、菌株产ESBL率、原发感染灶、感染相关危险因素均无明显差异,与文献报道TTP与性别、原发感染灶、恶性肿瘤及白细胞计数减少等因素有关不同[6,9],分析其原因可能与菌株或入选患者特点不同有关。关于区分高、低TTP的切点选择,Martínez等[3]和Peralta等[6]采用了P25,Bo等[9]则直接采用了Peralta等[6]报道的切点,而lvarez等[5]则选择了最接近中位数的整数作为切点,因此,本研究采用了报道较多的P25,TTP中位数为9.49 h,P25为7.13 h,与文献报道的切点接近[3,5-6,9]。通过绘制ROC曲线发现,TTP ≤ 9.38 h为预测大肠埃希菌血流感染患者住院期间死亡的最佳切点,略低于Peralta等[6]报道的TTP≤10.25 h。由于菌株耐药情况可能影响细菌生长速度[17-18],进而影响TTP,因此本研究进行了药敏试验,结果未发现碳氢霉烯类抗生素耐药菌株,而两组患者菌株产ESBL率间无明显差异,提示TTP与产ESBL情况无关,与文献报道一致[5]。
但由于本研究是回顾性研究,部分患者信息不完整的情况不可避免,而剔除这些患者有可能会造成选择偏倚,虽然采用较大样本量有助于降低选择偏倚对研究结果的影响,但仍存在一定局限性。而血培养过程中,采血后血培养瓶未及时送检,放置时间均会对TTP产生不同程度的影响[16];且TTP与细菌初始浓度(即接种量)有关,但实际操作中很难保证每个血培养瓶的接种量完全一致;此外,采血时机的选择(是否严格按照规定在寒战和发热初起时及抗生素使用之前采血)也会影响TTP。因此,需在今后研究中进行大样本的多中心研究以降低这些因素的影响,尽量保证统一、规范的血培养,以更加准确的结果指导临床。
综上所述,低TTP对大肠埃希菌血流感染患者发生严重脓毒血症及脓毒血症休克、住院期间死亡的预测价值为中等,可为临床不易察觉的早期菌血症提供重要预警信息,且TTP检测方便、快速、成本低廉,不失为一种值得推荐的辅助性诊断指标。应将TTP结合患者其他临床特征进行综合分析,以更加准确地判断患者预后,更好地指导临床抗感染治疗。
1 Kang CI,Song JH,Chung DR,et al.Risk factors and pathogenic significance of severe sepsis and septic shock in 2286 patients with gram-negative bacteremia[J].J Infect,2011,62(1):26-33.
2 Kuikka A,Sivonen A,Emelianova A,et al.Prognostic factors associated with improved outcome of Escherichia coli bacteremia in a Finnish university hospital[J].Eur J Clin Microbiol Infect Dis,1997,16(2):125-134.
3 Martínez JA,Soto S,Fabrega A,et al.Relationship of phylogenetic background,biofilm production,and time to detection of growth in blood culture vials with clinical variables and prognosis associated with Escherichia coli bacteremia[J].J Clin Microbiol,2006,44(4):1468-1474.
4 Kim J,Gregson DB,Ross T,et al.Time to blood culture positivity in Staphylococcus aureus bacteremia:association with 30-day mortality[J].J Infect,2010,61(3):197-204.
6 Peralta G,Roiz MP,Sánchez MB,et al.Time-to-positivity in patients with Escherichia coli bacteraemia[J].Clin Microbiol Infect,2007,13(11):1077-1082.
7 Peralta G,Rodríguez-Lera MJ,Garrido JC,et al.Time to positivity in blood cultures of adults with Streptococcus pneumoniae bacteremia[J].BMC Infect Dis,2006(6):79.
8 何玺玉,陈贤楠.儿童/新生儿血流感染的定义及诊断[J].实用儿科临床杂志,2009,24(18):1385-1386.
9 Bo SN,Bo J,Ning YZ,et al.Relationship between time to positivity of blood culture with clinical characteristics and hospital mortality in patients with Escherichia coli bacteremia[J].Chin Med J(Engl),2011,124(3):330-334.
10 Charlson ME,Pompei P,Ales KL,et al.A new method of classifying prognostic comorbidity in longitudinal studies:development and validation[J].J Chronic Dis,1987,40(5):373-383.
11 Bone RC,Sprung CL,Sibbald WJ.Definitions for sepsis and organ failure[J].Crit Care Med,1992,20(6):724-726.
12 中华医学会检验医学分会.临床微生物学血培养操作规范[J].中华检验医学杂志,2004,27(2):124-126.
13 孙振球,徐勇勇.医学统计学[M].2版.北京:人民卫生出版社,2009:666-667.
14 魏泽庆,沈萍,陈云波,等.Mohnarin 2010年报告:血流感染细菌构成及耐药性分析[J].中华医院感染学杂志,2012,22(3):465-470.
15 吴多荣,邱晓媚.血培养阳性患者病原菌分布及耐药性分析[J].中国全科医学,2012,15(12):4016-4018.
16 Haimi-Cohen Y,Vellozzi EM,Rubin LG.Initial concentration of Staphylococcus epidermidis in simulated pediatric blood cultures correlates with time to positive results with the automated,continuously monitored BACTEC blood culture system[J].J Clin Microbiol,2002,40(3):898-901.
17 Bagel S,Hüllen V,Wiedemann B,et al.Impact of gyrA and parC mutations on quinolone resistance,doubling time and supercoiling degree of Escherichia coli[J].Antimicrob Agents Chemother,1999,43(4):868-875.
18 展冠军,缪玉山,詹莹,等.大肠埃希菌耐药性与抗菌药物使用量的相关性分析[J].中国全科医学,2013,16(2):456.

