雌、孕激素受体和人表皮生长因子受体2共表达用于高级别浆液性卵巢癌患者复发预测的价值研究
吴 鹏,朱笕青,郑智国
卵巢癌是女性生殖系统常见的肿瘤之一,其死亡率居妇科肿瘤之首。据报道Ⅲ期卵巢癌患者的5年生存率仅为29.0%,近几十年来,其总生存率未得到明显改善[1]。高级别浆液性卵巢癌在上皮性卵巢癌中占大多数,超过2/3[2]。越来越多的证据表明高级别浆液性卵巢癌有别于其他卵巢癌亚型,几乎所有高级别浆液性卵巢癌均有P53突变,其他常见突变基因见于控制DNA双链断裂同源重组修复途径,如BRCA1/2、PALB2、RAD51、RAD50、BARD1、CHK2和BRIP1等[3]。因而,近年来高级别浆液性卵巢癌受到越来越多科学家的关注。治疗后复发是影响高级别浆液性卵巢癌患者存活率的重要因素,大多数进展期高级别浆液性卵巢癌患者在标准治疗(减瘤术+化疗)后几个月或几年内复发。其复发风险明显受病理分期和术后残留灶大小影响,但目前的研究还不足以准确地预测患者复发风险,因而还需要寻找更多的复发预测分子标志物,以便更好地指导卵巢癌患者个性化治疗[4]。P53、人表皮生长因子受体2(CerbB-2)、雌激素受体(ER)和孕激素受体(PR)的表达情况在卵巢癌患者中的预后价值已有研究[5-6],而其在高级别浆液性卵巢癌复发的预测价值研究较少。CerbB-2、ER和PR共表达对高级别浆液性卵巢癌中的复发预测价值鲜见报道。本研究应用免疫组化技术检测高级别浆液性卵巢癌中P53、CerbB-2、ER和PR的表达情况,探讨其与患者无复发生存时间(RFS)的关系。
1 资料与方法
1.1 一般资料 入选标准:(1)Ⅲ~Ⅳ期高级别浆液性卵巢癌;(2)本院首诊并接受手术和铂类药物为基础的化疗;(3)标准治疗后已治愈且复发后来本院接受后续治疗。根据以上标准,选取2002年9月—2011年2月入住本院的高级别浆液性卵巢癌患者32例。患者年龄39~69岁,平均(51.8±7.6)岁;宫颈癌国际妇产科联盟(FIGO)分期Ⅲ期30例、Ⅳ期2例,且所有标本均经本院病理科确诊。高级别浆液性卵巢癌患者RFS≥12个月为预后良好,RFS<12个月为预后差;以12个月为界,将患者分为RFS≥12个月组(18例)和RFS<12个月组(14例),两组的平均年龄分别为(51.0±8.1)和(52.8±7.1)岁,差异无统计学意义(t=-0.654,P=0.518)。所有患者或家属对研究知情同意。
1.2 方法
1.2.1 标本的处理 组织标本用10%中性甲酫溶液及时固定,后经梯度乙醇(75%、85%、95%、100%)脱水,二甲苯透明,浸蜡后石蜡包埋。
1.2.2 免疫组化实验 采用超敏试剂盒(均购自正规试剂公司)检测P53、CerbB-2、ER和PR抗体。按试剂盒说明书步骤进行染色,柠檬酸高温修复,二氨基联苯胺(DAB)显色,将已知阳性片作为阳性对照。实验结果判断:以CerbB-2阳性表达位于细胞膜和细胞质,P53、ER和PR阳性表达位于细胞核,呈棕黄色颗粒状为阳性表达。免疫组化定量分析(半定量)根据细胞着色深度及阳性细胞数分别记分为0~3分,着色深度以多数细胞呈色程度为准。凡细胞核或细胞膜内着浅棕色者为1分、棕色者为2分、深棕色者为3分、不着色为0分;镜下视野中阳性细胞占所有细胞的比例<10%为1分、10%~50%为2分、>50%为3分。根据上述两项指标的积分数分为4级,0分为阴性(-)、2~3分为弱阳性(+)低表达、4分为阳性(++)中表达、5~6分为强阳性(+++)高表达[7]。
1.2.3 RFS判断标准 患者接受标准治疗后获得临床治愈,RFS为从末次化疗到复发时间,复发标准为临床复发证据(妇科检查或影像学检查提示肿块)出现或血清糖类抗原125(CA125)持续升高。
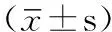
2 结果
2.1 P53、CerbB-2、ER和PR在高级别浆液性卵巢癌患者中的表达情况 P53蛋白主要定位于细胞核,阳性细胞核被染成棕黄色,胞膜、胞质均无着色;CerbB-2主要表达于细胞膜,细胞膜染成棕黄色,镜下见阳性细胞呈片状表达;ER免疫组化染色切片中,可见棕黄色或橘黄色颗粒位于细胞核内,胞质和胞膜未见染色颗粒;PR阳性表达情况与ER类似(见图1)。32例高级别浆液性卵巢癌患者中,P53、CerbB-2、ER和PR的阳性表达率见表1。

注:CerbB-2=人表皮生长因子受体2,ER=雌激素受体,PR=孕激素受体
图1 组织切片中P53、CerbB-2、ER和PR表达情况(×400)
Figure1 Expression of P53,CerbB-2,ER and PR in tissue sections
2.2 不同RFS的高级别浆液性卵巢癌患者中P53、CerbB-2、ER和PR阳性表达率的比较 不同RFS的高级别浆液性卵巢癌患者P53、ER和PR的阳性表达率比较,差异无统计学意义(P>0.05);RFS<12个月组CerbB-2的阳性表达率高于RFS≥12个月组,差异有统计学意义(P<0.05,见表2)。
2.3 不同RFS的高级别浆液性卵巢癌患者CerbB-2、ER和PR共表达情况 进一步对CerbB-2、ER和PR的共表达情况进行分析。以CerbB-2阴性、ER阳性或PR阴性为标准,同一个患者只要符合2个及以上标准即为共表达阳性(表明患者复发风险低),其余情况为阴性。RFS≥12个月组CerbB-2、ER和PR共表达阳性率高于RFS<12个月组,差异有统计学意义(χ2=7.619,P=0.008,见表3)。
表1 P53、CerbB-2、ER和PR在高级别浆液性卵巢癌患者中的表达情况
Table1 Expression of P53,CerbB-2,ER and PR in high-level serous ovarian cancer patients
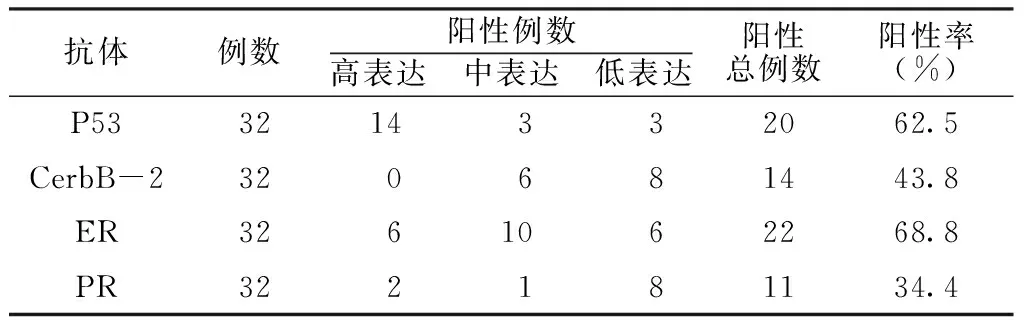
抗体例数阳性例数高表达 中表达 低表达阳性总例数阳性率(%)P533214332062.5CerbB-2320681443.8ER3261062268.8PR322181134.4
表3 不同RFS的高级别浆液性卵巢癌患者CerbB-2、ER和PR共表达阳性率的比较〔n(%)〕
Table3 Comparison of the positive co-expression rates of CerbB-2,ER and PR in high-level serous ovarian cancer patients with different RFSs

组别例数CerbB-2、ER、PR共表达为阳性CerbB-2、ER、PR共表达为阴性RFS≥12个月组1815(83.3)3(16.7)RFS<12个月组145(35.7)9(64.3)
3 讨论
高级别浆液性卵巢癌是卵巢癌中最常见的一个亚型,临床诊断时往往为晚期。虽然经过标准治疗后大多数患者能够获得临床治愈,但由于其易复发和耐药等原因,患者的5年生存率仅为35.0%~40.0%[4]。
P53基因是一个经典的抑癌基因,几乎所有高级别浆液性卵巢癌患者均存在P53突变[3]。Köbel等[8]通过对502例位于骨盆的高级别浆液性卵巢癌患者分析发现P53过表达预示着复发风险小。本研究显示,不同RFS的高级别浆液性卵巢癌患者P53阳性表达率间无明显差异,提示P53表达情况与RFS无关,这可能与本研究纳入分析样本数量少和病理分期晚等因素有关。
CerbB-2是一个癌基因,多数研究认为CerbB-2表达阳性的卵巢癌患者预后差[9]。Sueblinvong等[10]研究发现早期上皮性卵巢癌患者CerbB-2过表达与患者预后无关。可见由于纳入研究患者的分期不同,即使同一个分子标志物的临床价值也有差异。本研究结果表明RFS<12个月组CerbB-2的阳性表达率高于RFS≥12个月组,提示CerbB-2阳性患者预后差。结合文献报道可以推测CerbB-2在晚期卵巢癌细胞中起着重要的生物学功能,其过表达时癌细胞恶性程度更高。
有研究通过对106例卵巢癌患者进行分析,ER和PR阳性表达率分别为39.6%和33.0%,ER阳性表达率在高级别卵巢癌中明显增加,但ER表达与预后没有密切关系,而PR与RFS和总生存期(OS)有一定关系(基于单变量分析)[6]。本研究发现ER和PR的阳性表达率分别为68.8%和34.4%,ER阳性表达率明显高于文献报道,可能与本研究对象均为高级别浆液性卵巢癌患者有关。但不同RFS的高级别浆液性卵巢癌患者ER和PR的阳性表达率间无明显差异,提示ER和PR的表达情况与RFS无关。
本研究进一步分析发现CerbB-2阴性、ER阳性或PR阴性(其中符合2个及以上标准)的患者复发风险低,但还需要更多的病例研究来验证。另外,CerbB-2、ER和PR的共表达是否有明确的生物学功能也还需要进一步研究。
有研究表明,对于完成手术和化疗后临床已完全缓解的卵巢癌患者,随访监测发现无症状复发患者治疗后的总生存率(71.9%)明显高于有症状复发患者(50.7%)[11]。近年各国科学家也致力于卵巢癌首次治疗后复发控制的药物研究,如帕唑帕尼(pazopanib)[12]。然而在实施复发控制前最好能明确哪些卵巢癌患者能从中受益,因此,首次治疗后对复发风险的有效预测和复发的早期诊断已经成为业内关注的热点。本研究提示联合检测CerbB-2、ER和PR可作为预测高级别浆液性卵巢癌患者复发风险的潜在标志物,但还需要进一步扩大样本量来验证。
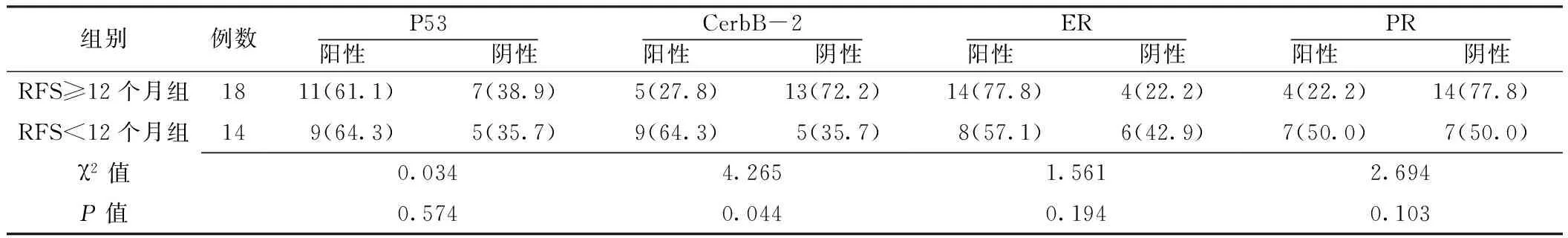
表2 不同RFS的高级别浆液性卵巢癌患者P53、CerbB-2、ER、PR阳性表达率的比较〔n(%)〕
1 Vaughan S,Coward JI,Bast RC Jr,et al.Rethinking ovarian cancer:recommendations for improving outcomes[J].Nat Rev Cancer,2011,11(10):719-725.
2 Prat J.New insights into ovarian cancer pathology[J].Annals of Oncology,2012,23(Suppl 10):x111-x117.
3 Cancer Genome Atlas Research Network.Integrated genomic analyses of ovarian carcinoma[J].Nature,2011,474(7353):609-615.
4 Berns EM,Bowtell DD.The changing view of high-grade serous ovarian cancer[J].Cancer Research,2012,72(11):2701-2704.
5 Hofstetter G,Berger A,Fiegl H,et al.Alternative splicing of p53 and p73:the novel p53 splice variant p53delta is an independent prognostic marker in ovarian cancer[J].Oncogene,2010,29(13):1997-2004.
6 Tangjitgamol S,Manusirivithaya S,Khunnarong J,et al.Expressions of estrogen and progesterone receptors in epithelial ovarian cancer:a clinicopathologic study[J].International Journal of Gynecological Cancer,2009,19(4):620-627.
7 Remmele W, Stegner HE.Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection(ER-ICA) in breast cancer tissue〗[J].Pathologe,1987, 8(3):138-140.
8 Köbel M,Reuss A,Bois A,et al.The biological and clinical value of p53 expression in pelvic high-grade serous carcinomas[J].The Journal of Pathology,2010,222(2):191-198.
9 Lafky JM,Wilken JA,Baron AT,et al.Clinical implications of the ErbB/epidermal growth factor(EGF) receptor family and its ligands in ovarian cancer[J].Biochim Biophys Acta,2008,1785(2):232-265.
10 Sueblinvong T,Manchana T,Khemapech N,et al.Lack of prognostic significance of HER-2/neu in early epithelial ovarian cancer[J].Asian Pac J Cancer Prev,2007,8(4):502-506.
11 Tanner EJ,Chi DS,Eisenhauer EL,et al.Surveillance for the detection of recurrent ovarian cancer:survival impact or lead-time bias?[J].Gynecologic Oncology,2010,117(2):336-340.
12 Kim K,Ryu SY.Major clinical research advances in gynecologic cancer 2009[J].Journal of Gynecologic Oncology,2009,20(4):203-209.

