溶液中木质素和葡萄糖的超滤分离
黄 洲,缪冶炼,陈介余,李文莉
(1.南京工业大学食品与轻工学院,南京211800; 2.日本秋田县立大学生物资源学部,秋田0100195)
溶液中木质素和葡萄糖的超滤分离
黄 洲1,缪冶炼1,陈介余2,李文莉1
(1.南京工业大学食品与轻工学院,南京211800; 2.日本秋田县立大学生物资源学部,秋田0100195)
以木质素和葡萄糖的混合溶液为木质纤维素水解液模型,采用截留相对分子质量为5 000的卷式聚醚砜膜对葡萄糖和木质素进行全回流模式的分离,探讨了木质素和葡萄糖浓度、操作压力、错流速率对通量、木质素和葡萄糖截留率的影响。结果表明:在实验条件范围内,通量随葡萄糖浓度和木质素浓度的增加而降低,并随操作压力、错流速率的增加而增加。木质素截留率不受任何条件的影响,基本稳定在97%。葡萄糖截留率随木质素浓度的增加而增加,并随错流速率的增加而减小。在0.8 g/L的木质素质量浓度条件下,当错流速率从0.12 m/s增加到0.17 m/s时,葡萄糖截留率从14%减小到7.3%。由此可见,在混合溶液的超滤过程中,通过合理选择错流速率,能够改善木质素和葡萄糖的分离。
酶解;葡萄糖;木质素;木质纤维素;膜分离
预处理和水解是以木质纤维素材料为原料生产生物乙醇的主要操作步骤。然而,在预处理和水解过程中,可溶性木质素会进入水解液,对发酵微生物产生毒性,影响木质纤维素水解液的发酵效率[1]。在发酵前需除去可溶性木质素的方法有活性炭吸附法[1]、过量石灰澄清法[2-3]、离子交换树脂法[4]及酶解法等[5]。本研究中笔者提出通过膜分离去除木质纤维素水解液中木质素,与现有方法相比,膜分离法具有对木质素成分的依赖性低、不会产生后续的毒性物质、处理能力强等特点。
造纸黑液呈强碱性,木质素和固形物含量高。在对黑液的膜分离中,通量、固形物和木质素截留率受到膜的材料和截留相对分子质量[6-7]、黑液的木质素[6]和固形物含量[7-8]、操作温度[8]和压力[7-8]等因素的影响。而木质纤维素水解液与造纸黑液的性质有很大区别。首先,两者的主要成分不同。木质纤维素水解液主要含有葡萄糖、木糖和阿拉伯糖等还原糖,而造纸黑液主要含有木质素和固形物;其次,木质纤维素水解液与造纸黑液中木质素的相对分子质量不同。木质纤维素水解液中的木质素质量浓度小于1 g/L,而造纸黑液中的木质素质量浓度可达到5~60 g/L[9]。可溶性木质素的相对分子质量随木质纤维素材料、提取方法和条件不同而变化[10-12]。木质纤维素水解液的性质必然影响其中还原糖和木质素的分离过程和效果。
Toledano等[11]比较了截留相对分子质量为5 000、10 000和15 0000的陶瓷膜对造纸黑液木质素(重均相对分子质量和数均相对分子质量分别为5 654、1 879)的分离性能。木质纤维素水解液中的还原糖主要为葡萄糖、木糖和阿拉伯糖,其质量浓度分别为8.9、4.7和0.3 g/L[13],相对分子质量分别为180、150和150 。木质素和还原糖的相对分子质量相差较大,为膜分离提供了技术依据。
笔者为了把握木质纤维素水解液中木质素和还原糖的膜分离特性,以木质素和葡萄糖的混合溶液为木质纤维素水解液模型,采用截留相对分子质量为5 000的卷式聚醚砜膜对葡萄糖和木质素进行分离,以期探讨木质素和葡萄糖浓度、操作压力、错流速率对通量、木质素和葡萄糖截留率的影响。
1 材料与方法
1.1 木质素和葡萄糖的混合溶液
在5 L纯水中加入一定量的木质素(日本关东化学株式会社)和葡萄糖(分析纯,国药集团化学试剂有限公司),制备木质素和葡萄糖的混合溶液。混合溶液的木质素质量浓度为0~1.6 g/L,葡萄糖质量浓度为2~15 g/L。
木质素的相对分子质量(Mr)采用凝胶渗透色谱法测定[14]。取木质素0.1 g,用0.1 mol/L 磷酸盐缓冲液(pH 6.0)定容至100 mL,制备出质量浓度为1 g/L的木质素溶液。取木质素溶液1 mL,用0.22 μm微滤膜过滤后,取20 μL上样分析。利用上海曦玉分析仪器科技有限公司XY100型GPC-凝胶渗透色谱系统及色谱仪进行分析。检测器为XY100型UV紫外检测器、检测波长为220 nm,分离柱为凝胶渗透色谱柱(7.8 mm×30 cm,SEC-150),流动相为0.1 mol/L 磷酸盐缓冲液,标准试样为聚氧化乙烯,流动相流速为0.6 mL/min,柱温为40 ℃,柱压为0.2 MPa。
图1表示木质素累积质量分数随相对分子质量(lgMr)的变化。由图1可知:木质素的相对分子质量分布范围为350~34 000。相对分子质量5 000时的累积质量分数为50.3%。木质素的重均相对分子质量、数均相对分子质量分别为6 858、2 370,比文献[10]中芒草木质素(通过7.5% NaOH、90 ℃、90 min处理得到)的重均相对分子质量5 654、数均相对分子质量1 879 稍大。两者的多分散系数相近,在3左右。
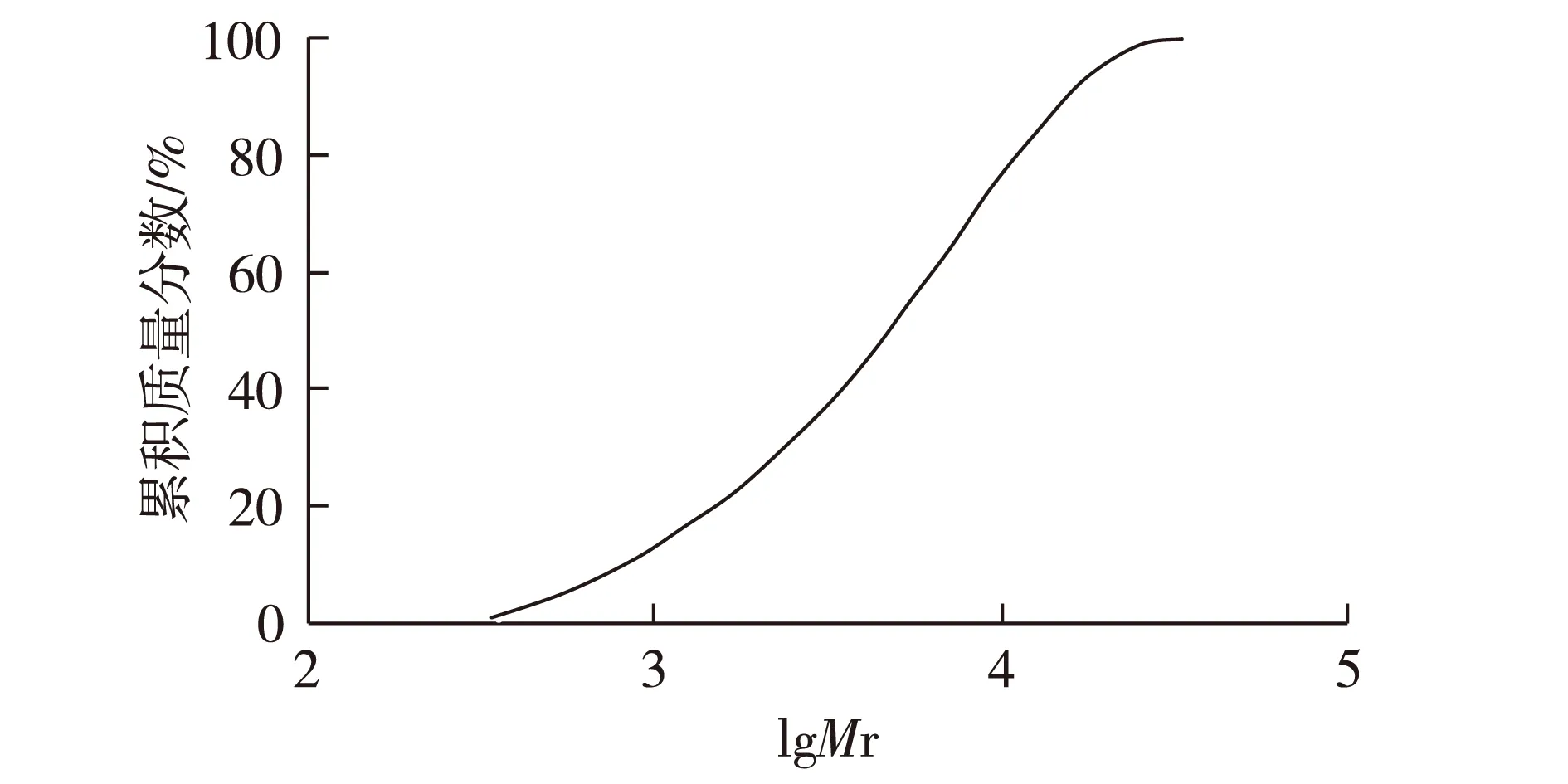
图1 木质素累积质量分数随相对分子质量的变化Fig.1 Change of the cumulative weight fraction with molecular weight of lignin
1.2 膜分离实验装置
膜分离实验装置主要由不锈钢材质原料罐、高压柱塞泵(HYDRA-CELL,美国普菲克公司)、超滤膜组件、温度表、压力表、流量计、截留液和渗透液取样口等部分组成。其中,原料罐的外径为185 mm,内径为155 mm,高度为340 mm,高压柱塞泵的最大流量为8.4 m3/h,最高压力为7 MPa,超滤膜(PT1812C型,美国GE-Osmosis公司)的特性如表1所示。
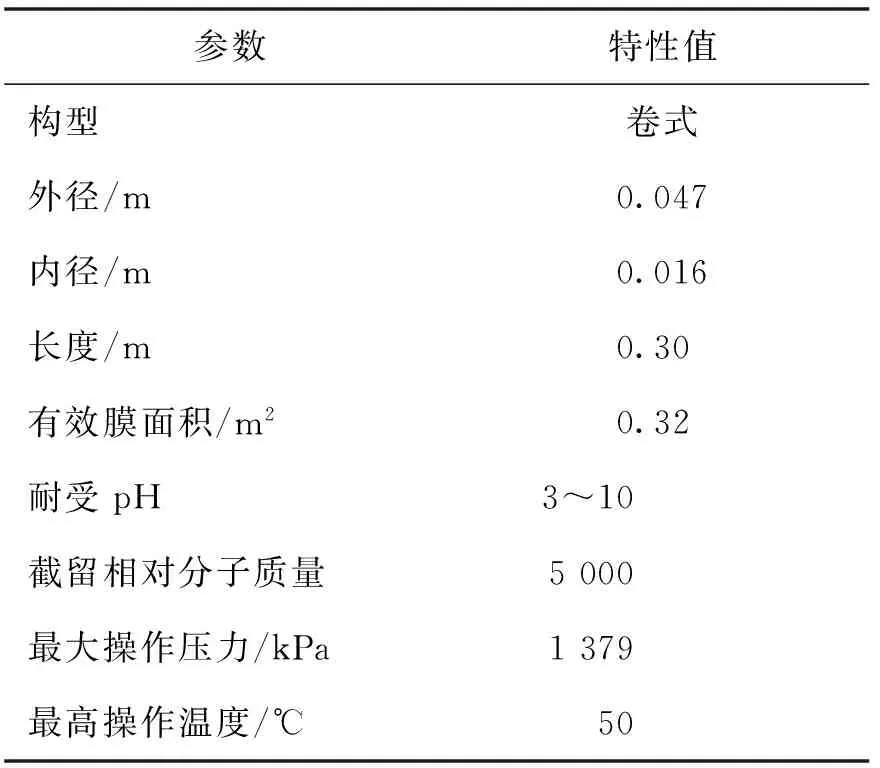
表1 超滤膜的特性Table 1 Characteristics of the ultrafiltration membrane
注:以上数据来源于美国GE-osmosis公司。
操作温度会改变溶液的黏度,从而影响通量,但对截留率的影响很小[8,15]。本研究的主要讨论内容为木质素和还原糖的超滤分离特性,因此选择在室温条件下进行分离操作。原料罐采用夹层结构。在实验中,向原料罐夹层中通入自来水,以维持料液温度在室温。
1.3 超滤
超滤前,首先测定膜的纯水通量。向原料罐内倒入纯水5 L,在操作压力0.6 MPa、室温、错流速率0.12 m/s的条件下使纯水在分离装置内循环。在稳定运行的状态下,测定纯水的流量。上述操作重复2次,取平均值。
排除原料罐中的纯水,加入木质素和葡萄糖的混合溶液5 L,采用全回流模式进行分离。所谓全回流分离操作模式,就是混合溶液经过高压柱塞泵打入超滤膜组件中,流出的截留液和渗透液全部返回原料罐中,以保证原料罐中的混合溶液处于浓度稳定状态[16]。使混合溶液在一定的操作压力和错流速率条件下运行10 min后,测定渗透液和截留液的流量,取出渗透液5 mL和截留液5 mL作为木质素和葡萄糖分析试样。超滤中,混合溶液温度一定(室温),操作压力分别设定为0.2、0.4、0.6、0.8和1 MPa,错流速率分别设定为0.12、0.13、0.15、0.17、0.20和0.22 m/s。每个条件的分离操作重复2次,其测定取平均值。
超滤结束后,排出混合溶液,向料液罐内装入清洗液(三聚磷酸钠5 g/L,十二烷基苯磺酸钠2 g/L)5 L,运行15 min,再用纯水5 L运行15 min,反复4~5次,以冲洗分离装置。
通量(Jv)采用式(1)计算。
(1)
式中:Q为渗透液流量,L/h;S为膜的有效面积,m2。
木质素或葡萄糖的截留率(R)采用式(2)计算。
(2)
式中:ρp为渗透液中木质素或葡萄糖的质量浓度,g/L;ρr为截留液中木质素或葡萄糖的质量浓度,g/L。
1.4 木质素浓度的测定
木质素浓度采用紫外分光光度法测定[1]。取测试液2 mL,在280 nm波长处测定溶液的吸光值,并按照式(3)计算木质素质量浓度。
木质素测定的标准曲线制作方法如下。准确称取木质素100 mg,用蒸馏水定容至500 mL,然后分别稀释至质量浓度0.012、0.018、0.024、0.030、0.036和0.042 g/L,作为标准溶液。采用紫外分光光度计(752S型紫外分光光度计,上海棱光技术有限公司)测定标准溶液在280 nm处的吸光值A280。吸光值与木质素质量浓度的关系见式(3):
(3)
式中:A280为吸光值;ρL为木质素质量浓度,g/L。
1.5 葡萄糖浓度的测定
葡萄糖浓度采用DNS法测定[17]。取测试液2 mL于试管中,加入3,5-二硝基水杨酸(DNS试剂)(分析纯,国药集团化学试剂有限公司)2 mL,置于沸水浴中加热10 min,冷却后加蒸馏水20 mL。用快速混匀器(SK-1型,常州国华电器有限公司)将试管中的液体充分混匀,静置30 min,在波长540 nm处测定吸光值,并按照式(4)计算葡萄糖质量浓度。
葡萄糖标准曲线的制作方法如下:准确称取干燥至恒质量后的葡萄糖100 mg,加少量蒸馏水溶解后,以蒸馏水定容至100 mL,即含葡萄糖为1.0 mg/mL。分别取标准葡萄糖溶液0、0.2、0.4、0.6、0.8和1.0 mL于试管中,用蒸馏水补足至2 mL,加入DNS试剂2 mL。在沸水浴中加热10 min,冷却后加蒸馏水20 mL,用快速混匀器将试管中的液体充分混匀,静置30 min。在波长540 nm下测定其吸光值A540。吸光值与葡萄糖质量浓度的关系见式(4)。
(4)
式中:A540为吸光值;ρg为葡萄糖质量浓度,g/L。
2 结果与讨论
2.1 膜通量的稳定性
每次对混合溶液进行超滤前,在操作压力0.6 MPa、错流速率0.12 m/s的条件下测定膜的纯水通量,以检验膜通量的稳定性,结果见图2。由图2可知:膜的纯水通量几乎不变,维持在130 L/(m2·h)左右。这说明每次清洗能使膜通量恢复到初始水平,从而保证实验数据的可比性。
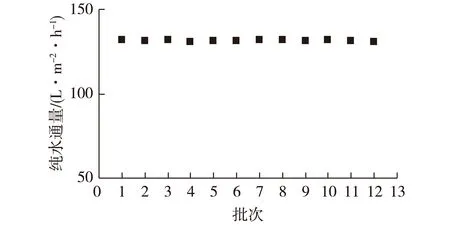
图2 实验前超滤膜的纯水通量Fig.2 Pure-water flux of ultrafiltration membrane before each test
2.2 分离过程中通量、截留率的变化
在操作压力0.6 MPa、错流速率0.12 m/s的条件下对混合溶液(木质素质量浓度为0.8 g/L,葡萄糖质量浓度为6 g/L)进行分离,图3表示分离过程中通量的变化。由图3可知:通量初始值为131 L/(m2·h),5~20 min后稳定在108 L/(m2·h)。
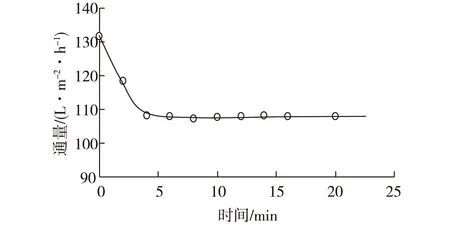
图3 分离过程中通量的变化Fig.3 Changes of flux during separation
膜分离的操作压力和错流速率分别设定在0.6 MPa、0.12 m/s。图4表示分离过程中木质素和葡萄糖截留率的变化。由图4可知:木质素截留率随时间的变化很小,基本稳定在97%。葡萄糖的初始截留率为3.4%,5 min后基本稳定在14%。因此,本研究在超滤10 min后取样,再测定通量、木质素和葡萄糖的浓度。

图4 分离过程中木质素和葡萄糖截留率的变化 Fig.4 Changes of retention of lignin and glucose during separation
2.3 木质素和葡萄糖浓度的影响

图5 木质素和葡萄糖质量浓度对通量的影响Fig.5 Effects of concentration of lignin and glucose on flux
图5表示木质素和葡萄糖浓度对通量的影响。膜分离的操作压力和错流速率分别设定在0.6 MPa、0.12 m/s。由图5可知:通量随葡萄糖和木质素浓度的上升而下降。葡萄糖质量浓度为2 g/L、木质素质量浓度为0时,通量为113 L/(m2·h)。当葡萄糖质量浓度上升到15 g/L,木质素质量浓度上升到1.6 g/L时,通量下降到89 L/(m2·h)。通量下降的主要原因在于驱动力降低和浓差极化。在同一操作压力下,木质素和葡萄糖浓度增加使膜两侧的渗透压差增大,驱动力降低。与此同时,木质素浓度越高,在膜表面形成浓差极化阻力越大。经预实验发现,葡萄糖浓度对木质素和葡萄糖截留率影响很小。因此,在后续实验中,混合溶液的葡萄糖质量浓度设定为6 g/L。
图6表示木质素浓度对木质素和葡萄糖截留率的影响。膜分离的操作压力和错流速率分别设定在0.6 MPa、0.12 m/s。由图6可知:木质素截留率不受木质素浓度影响,基本稳定在97%。本研究中50.3%木质素的相对分子质量小于5 000(图1),而大部分小于膜截留相对分子质量的木质素也被截留,其原因在于木质素分子具有复杂的空间结构。在秸秆的木质素结构中愈创木酚基团和紫丁基基团含量最多。而愈创木酚基团的空间结构松散,紫丁香基基团的空间结构紧凑。Toledano等[11]和Alriols等[12]发现,用不同截留相对分子质量的膜对木质素分级时,低相对分子质量组分中含有较多的紫丁香基基团,高相对分子质量组分中含有较多的愈创木酚基团。此外,可溶性木质素含有大量的酚羟基和醇羟基,通过氢键[17-18]结合,会形成更大的聚合物。
葡萄糖截留率受木质素浓度的影响较大。当木质素质量浓度从0增加到1.2 g/L时,葡萄糖截留率从4%上升到16%,但是当木质素质量浓度大于1.2 g/L时,葡萄糖截留率基本稳定。这是因为部分木质素堵塞在膜孔内,使膜孔空隙变小,造成部分葡萄糖被截留。此外,膜表面形成木质素浓差极化层,其厚度会随着木质素浓度的增加而增加,使葡萄糖截留率增大。当木质素浓度达到一定程度后,浓差极化层厚度趋于稳定,葡萄糖的截留率不再增加[18]。
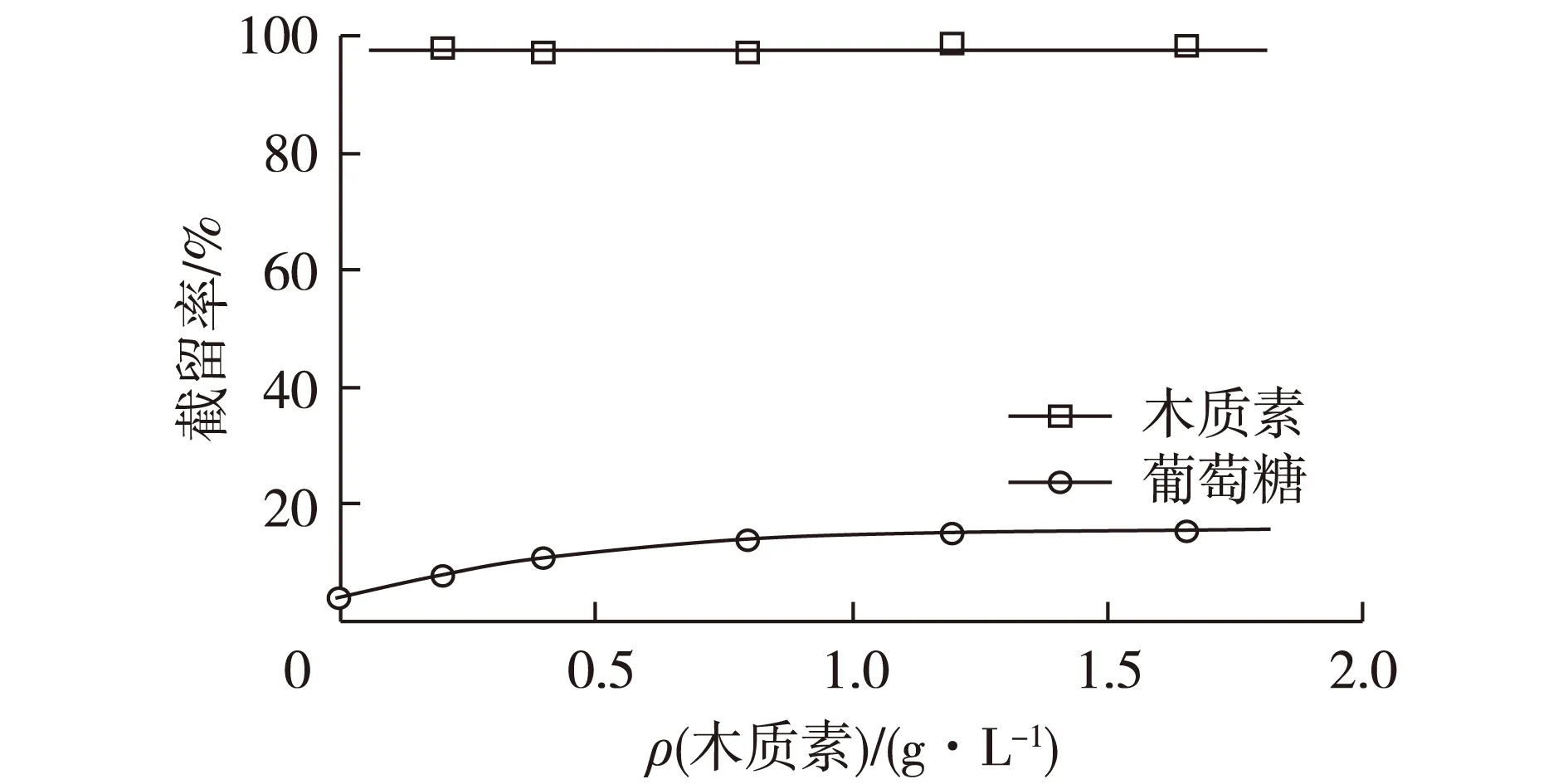
图6 木质素浓度对木质素和葡萄糖截留率的影响Fig.6 Effects of lignin concentration on retention of lignin and glucose
2.4 操作压力和错流速率的影响
因为超滤是一种压力驱动的过程,所以操作压力在分离过程中扮演着重要的角色[17]。本研究在不同压力下对混合溶液(葡萄糖质量浓度为6 g/L,木质素质量浓度为0.4 g/L)进行分离,考察了操作压力对通量、木质素和葡萄糖截留率的影响。
图7、图8分别表示操作压力对通量和截留率的影响。其中,葡萄糖质量浓度设定在6 g/L,木质素质量浓度设定在0.4 g/L,错流速率设定在0.12 m/s。由图7可知:通量随操作压力的升高而呈线性增加。此时的膜分离中,渗透压基本不变,因此驱动力的增加与操作压力的升高相一致[19]。在错流速率为0.12 m/s的条件下,当操作压力从0.2 MPa增加到1 MPa时,通量从33 L/(m2·h)增加到186 L/(m2·h)。由图8可知:在0.2~1 MPa的操作压力范围内,木质素和葡萄糖的截留率基本不变,分别稳定在97%、10%左右。

图7 操作压力对通量的影响Fig.7 Effects of applied pressure on flux

图8 操作压力对木质素和葡萄糖截留率的影响Fig.8 Effects of applied pressure on retention of lignin and glucose
在操作压力一定(0.6 MPa)、错流速率不同的条件下对混合溶液(葡萄糖质量浓度为6 g/L,木质素质量浓度为0.8 g/L)进行分离,测定通量、木质素和葡萄糖的截留率。图9表示错流速率对通量的影响。由图9可知:当错流速率从0.12 m/s增加到0.17 m/s时,通量从94 L/(m2·h) 增加到118 L/(m2·h)。当错流速率大于0.17 m/s时,通量基本不变。由此可见,在一定范围内增加错流速率能够减小膜表面的浓差极化,从而提高通量[17,20-21]。

图9 错流速率对通量的影响Fig.9 Effect of crossflow velocity on flux
图10表示错流速率对木质素和葡萄糖截留率的影响。其中,葡萄糖质量浓度设定在6 g/L,木质素质量浓度设定在0.8 g/L,操作压力设定在0.6 MPa。由图10可知:木质素截留率在错流速率为0.12~0.22 m/s范围内基本不变,稳定在97%。另一方面,在错流速率范围0.12~0.17 m/s内,葡萄糖截留率随错流速率的增加而逐渐降低。在错流速率为0.12 m/s时,葡萄糖截留率为14%,当错流速率大于0.17 m/s时,截留率保持稳定在7.3%。
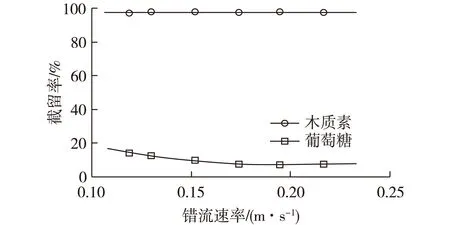
图10 错流速率对木质素和葡萄糖截留率的影响Fig.10 Effects of crossflow velocity on retention of lignin and glucose
一般来说,膜表面的浓差极化和膜孔堵塞是葡萄糖被截留的主要原因。错流速率的增加可以减少浓差极化,从而降低葡萄糖截留率[17,20-21]。很明显,错流速率的增加有助于提高处理能力,改善木质素和葡萄糖的分离。
3 结 论
以木质素和葡萄糖的混合溶液为木质纤维素水解液模型,采用截留相对分子质量为5 000的卷式聚砜膜对葡萄糖和木质素进行分离,在木质素质量浓度0~1.6 g/L、葡萄糖质量浓度2~15 g/L、操作压力0.2~1 MPa、错流速率0.12~0.22 m/s的范围内,分别探讨了木质素和葡萄糖浓度、操作压力、错流速率对通量、木质素和葡萄糖截留率的影响。
1) 通量随葡萄糖浓度和木质素浓度的增加而降低,随操作压力、错流速率的增加而增加。在葡萄糖质量浓度6 g/L、木质素质量浓度0.8 g/L、操作压力0.6 MPa的条件下,当错流速率从0.12 m/s增加到0.17 m/s时,通量从94 L/m2·h 增加到118 L/(m2·h)。当错流速率大于0.17 m/s时,通量不受错流速率的影响。
2)木质素截留率不受木质素和葡萄糖浓度、操作压力、错流速率的影响,基本稳定在97%。
3)葡萄糖截留率不受葡萄糖浓度、操作压力的影响,随木质素浓度的增加而增加,并随错流速率的增加而减小。在0.8 g/L的木质素质量浓度条件下,当错流速率从0.12 m/s增加到0.17 m/s时,葡萄糖截留率从14%降到7.3%。当错流速率大于0.17 m/s时,葡萄糖截留率不受错流速率的影响。
本研究通过实验证明了采用截留分子相对质量为5 000的卷式聚醚砜膜分离混合溶液中木质素和葡萄糖的可行性,今后将以木质纤维素水解液为对象,探讨其中各成分对木质素和还原糖分离的影响。
[1] Wang L,Chen H Z.Increased fermentability of enzymatically hydrolyzed steam-exploded corn stover for butanol production by removal of fermentation inhibitors[J].Process Biochem,2011,46:604-607.
[2] 薛珺,蒲欢,孙春宝.纤维素稀酸水解产物中发酵抑制物的去除方法[J].纤维素科学与技术,2004,12(3):48-52.
[3] Qureshi N,Saha B C,Hector R E,et al.Production of butanol (a biofuel) from agricultural residues:part II.use of corn stover and switchgrass hydrolysates[J].Biomass Bioenergy,2010,34:566-571.
[4] Larsson S,Reimann A,Jönsson L,et al.Comparison of different methods for the detoxification of lignocellulosic hydrolysates of spruce[J].Appl Microbiol Biotech,1999,77:91-103.
[5] Cho D H,Lee Y J,Um Y,et al.Detoxication of model phenolic compounds in lignocellulosic hydrolysates with peroxidase for butanol production fromClostridiumbeijerinckii[J].Appl Microbiol Biotech,2009,83:1035-1043.
[6] Wallberg O,Anders H,Jonsson A S.Kraft cooking liquors from a continuous cooking process[J].Desalination,2005,180:109-118.
[7] Dafinov A,Font J,Ricard G V.Processing of black liquors by UF/NF ceramic membranes[J].Desalination,2005,173:83-90.
[8] Wallberg O,Jarwon A S,Roland W.Ultrafiltration of kraft black liquor with a ceramic membrane[J].Desalination,2003,156:145-153.
[9] Zabkova M,Silva E A B,Rodrigues A E.Recovery of vanillin from lignin/vanillin mixture by using tubular ceramic ultraltration membranes[J].J Membrane Sci,2007,301:221-237.
[10] Sun R,Mark L J,Banks W B,et al.Effect of extraction procedure on the molecular weight of wheat straw lignins[J].Ind Crop Prod,1997,6:97-106.
[11] Toledano A,García A,Mondragon I,et al.Lignin separation and fractionation by ultraltration[J].Sep Purif Technol,2010,71:38-43.
[12] Alriols M G,García A,Llano-ponte R,et al.Combined organosolv and ultrafiltration lignocellulosic biorefinery process[J].Che Eng J,2010,157:113-120.
[13] 何珣.木质纤维素生产蛋白质饲料的基础研究[D].南京:南京工业大学,2009:1-63.
[14] 李静,付时雨,张汉英.水溶性凝胶渗透色谱法测定碱木素分子量[J].色谱,1998,16(3):235-237.
[15] 董艳.膜分离提取纯化中药多糖的工艺研究[D].天津:天津大学,2007:1-67.
[16] Weng Y H,Wei H J,Tsai T Y,et al.Separation of acetic acid from xylose by nanofiltration[J].Sep Purif Technol,2009,67:95-102.
[17] 张龙翔,张庭芳,李令媛.生化实验方法和技术[M].北京:北京高等教育出版社:1997.
[18] Schmidt J A,Rye C S,Gurnagul N.Lignin inhibits autoxidative degradation of cellulose[J].Polym Degrad Stabil,1995,49:291-297.
[19] Zhang Z,Yang R,Zhang S,et al.Purification of lactulose syrup by using nanofiltration in a diafiltration mode[J].J Food Eng,2011,105:112-118.
[20] Jonsson G,Boesen C E.Concentration polarization in a reverse-osmosis test cell[J].Desalination,1977,21:1-10.
[21] Sutzkover I,Hasson D,Semiat R.Simple technique formeasuring the concentration polarization level in a reverse osmosis system[J].Desalination,2000,131:117-127.
(责任编辑 周晓薇)
Separation of lignin and glucose in solutions by ultrafiltration
HUANG Zhou1,MIAO Yelian1,CHEN Jieyu2,LI Wenli1
(1.College of Food and Light Industrial Engineering,Nanjing Tech University,Nanjing 211800,China;2.Faculty of Bioresource Science,Akita Prefectural University,Akita 0100195,Japan)
Solutions of lignin and glucose were used as models of lignocellulose hydrolysates,and the lignin and the glucose were separated using a spiral-wound polyethersulfone membrane with a molecular weight cut-off of 5 000.The effects of lignin concentration and glucose concentration,applied pressure and crossflow velocity on solution flux,lignin retention and glucose retention were discussed.Under the experimental conditions,the solution flux decreased with increasing of glucose concentration and lignin concentration,and increased with increasing of applied pressure and crossflow velocity.The lignin retention was almost constant at 97%.The glucose retention increased with increasing of lignin concentration,and decreased with increasing of crossflow velocity.Under the condition of a lignin concentration at 0.8 g/L,the glucose retention decreased from 14% to 7.3% when the crossflow velocity increased from 0.12 m/s to 0.17 m/s.A suitable crossflow velocity could improve the ultrafiltration separation of the lignin and the glucose.
enzymatic hydrolysis;glucose;lignin;lignocellulose;membrane separation
10.3969/j.issn.1672-3678.2014.02.011
2012-11-19
国家重点基础研究发展计划(973计划)(2009CB724700)
黄 洲(1986—),男,江苏常熟人,硕士研究生,研究方向:生物化工;缪冶炼(联系人),教授,E-mail:ylmiao@njtech.edu.cn
TK6
A
1672-3678(2014)02-0056-07

