离子交换层析结合反向色谱纯化聚二氨基丙酸
夏 军,许召贤,薄芳芳,冯小海,迟 波,徐 虹
(南京工业大学食品与轻工学院,南京211800)
离子交换层析结合反向色谱纯化聚二氨基丙酸
夏 军,许召贤,薄芳芳,冯小海,迟 波,徐 虹
(南京工业大学食品与轻工学院,南京211800)
ε-聚赖氨酸生产菌株StreptomycesalbulusPD-1可合成一种新型非蛋白质氨基酸均聚物聚二氨基丙酸,采用离子交换层析和反向色谱,对聚二氨基丙酸的分离纯化进行研究。离子交换层析柱选用DEAE-Sepharose Fast Flow填料,50 mmol/L 磷酸盐缓冲液(pH 7.5)平衡上样,含0.5 mol/L NaCl的磷酸盐缓冲液(pH 7.5)洗脱,收集洗脱液用分子筛Sephadex G-25除去磷酸盐缓冲液。然后用C18反相色谱进一步纯化,流动相为V(甲醇)/V(0.1%磷酸)=5/95。经过离子交换层析和反向色谱,纯化得到聚二氨基丙酸纯品,回收率为39.8%,样品纯度达98.4%,为后续的聚二氨基丙酸的深入研究奠定基础。
聚二氨基丙酸;纯化;离子交换层析;反向色谱
聚氨基酸是由氨基酸单体的羟基和氨基形成的酰胺键连接而成的一类聚合物,聚氨基酸的结构和蛋白质有些相似,但是二者的合成机理是完全不同的。生物体内蛋白质的合成是在DNA指导下通过转录、翻译,按照特定的氨基酸顺序(mRNA上碱基序列)进行合成的,而聚氨基酸一般是在非核糖体多肽合成酶催化下,氨基酸单体聚合而成的具有一定相对分子质量的聚合物[1]。目前,已发现的微生物合成均聚氨基酸(包括非蛋白质氨基酸)有ε-聚赖氨酸、γ-聚谷氨酸、γ-聚二氨基丁酸[2-4],此外,微生物合成的多聚氨基酸有聚(精氨酸-组氨酸)、聚-L-精氨酰-聚(L-天冬氨酸)(藻青素)[1,5]。聚氨基酸一般具有水溶性、电荷密度高、可生物降解等许多独特的理化和生物学特性,聚氨基酸及其衍生物在食品、医药、农业、电子等诸多领域具有十分广阔的应用前景[1]。
聚二氨基丙酸 (poly(L-diaminopropionic acid),PDAP) 是从ε-聚赖氨酸生产菌StreptomycesalbulusPD-1发酵液中发现的一种新型非蛋白质氨基酸均聚物,是由L-二氨基丙酸单体的羟基和氨基形成的酰胺键连接而成的,其结构式如图1所示。由于侧链上拥有大量游离氨基,聚二氨基丙酸属于一种带正电荷的多肽类物质,对细菌、酵母等微生物具有抑制作用[6]。放线菌Streptomycealbulus是工业生产菌株,其主产物ε-聚赖氨酸具有抑菌谱广、安全性高、热稳定性高以及试用pH范围广等特点,目前包括美国、日本、韩国在内的多个国家已经批准ε-聚赖氨酸作为防腐剂在食品中添加使用。此外,ε-聚赖氨酸衍生物在医药、农业、电子等领域也有着广泛应用[7]。PDAP作为Streptomycealbulus生产ε-聚赖氨酸的副产物,对于Streptomycealbulus代谢途径解析以及聚氨基酸联产研究具有重要的研究价值。本文应用实验室常用的离子交换层析和反向色谱纯化技术,以预处理的StreptomycealbulusPD-1的发酵液为研究对象,探索PDAP的分离纯化工艺。
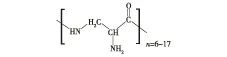
图1 聚二氨基丙酸结构式Fig.1 Chemical structure of poly (L-diaminopropionic acid)
1 材料与方法
1.1 试剂与仪器
离子交换层析柱填料DEAE-Sepharose Fast Flow、分子筛Sephadex G-25,GE Healthcare公司;SinoChrom ODS-BP反向色谱柱(20 mm×150 mm,10 μm),大连依利特公司;AKTA FPLC蛋白纯化仪,Amersham Bioscience公司;K2HPO4、KH2PO4、甲醇、三氟乙酸及磷酸(分析纯),国药集团化学试剂有限公司。
1.2 实验方法
1.2.1StreptomycealbulusPD-1的发酵液的预处理
取StreptomycealbulusPD-1的发酵液,过滤除去菌体,滤液中加入V(甲醇)/V(丙酮)=3的混合有机溶剂至饱和度0~40%,形成沉淀,沉淀用去离子水复溶,然后超滤得到预处理的发酵液。
1.2.2 离子交换层析
将填料DEAE-Sepharose Fast Flow装入柱中,用1 mol/L NaOH冲洗1~2 h,流速40 cm/h,然后用去离子水洗涤至pH近中性,再用2~4个柱体积的70%(体积分数)乙醇冲洗1~2 h,去离子水洗涤至pH近中性。
取预处理的发酵液,以50 mmol/L K2HPO4-KH2PO4缓冲液平衡上样,pH分别6.5、7.5和8.5,含0.5 mol/L NaCl的K2HPO4-KH2PO4缓冲液作为洗脱液,流速2.0 mL/min,洗脱液经紫外检测仪,检测波长215 nm,选择分离效果最好的pH为7.5的磷酸盐缓冲液作为流动相,根据检测峰收集样品。
收集的含有PDAP的洗脱液经过减压旋转蒸发,以去离子水为流动相,上样分子筛Sephadex G-25,流速4 mL/min,洗脱液经紫外检测后收集,检测波长215 nm。
1.2.3 C18反向色谱
收集分子筛纯化后的洗脱液,加入C18反向色谱柱中,分别以V(甲醇)/V(水)=5/95、V(甲醇)/V(水)=15/85、V(甲醇)/V(0.1%三氟乙酸)=5/95和V(甲醇)/V(0.1%磷酸)=5/95做流动相,选择分离效果最好的V(甲醇)/V(0.1%磷酸)=5/95作为流动相,流速4 mL/min,洗脱液经紫外检测仪,检测波长215 nm,根据检测峰收集样品。
1.3 检测方法
PDAP的检测采用高效液相色谱(HPLC)法[7],色谱柱:TSKgel ODS-120T色谱柱(4.6 mm×250 mm,日本 TOSOH公司),流速 0.4 mL/min,紫外检测波长为215 nm。用V(0.05%三氟乙酸)/V(乙腈)为95/5的溶液作为初始流动相平衡色谱柱。洗脱分为两阶段,在第一阶段,进样后以初始流动相洗脱,持续10 min后进入第二阶段洗脱,V(0.05%三氟乙酸)/V(乙腈)的比值,在5 min内由初始的95/5,线性梯度上升至85/15。
2 结果与讨论
2.1 离子交换层析结果
在DEAE-Sepharose Fast Flow型离子交换层析纯化PDAP的过程中,用不同pH的磷酸盐缓冲液洗上样洗脱,选择分离效果较好的pH 7.5磷酸盐缓冲液作为流动相,收集含有目的组分的洗脱液后,用分子筛Sephadex G-25做进一步纯化,以除去离子交换层析中引入的小相对分子质量的磷酸盐,纯化图谱如图2所示。
以pH分别为6.5、7.5和8.5的磷酸盐缓冲液上样预处理后的发酵液,PDAP均在穿透峰里被检测到,提高洗脱液的比例后,陆续有其他杂质峰被洗脱下来。由于PDAP是由碱性氨基酸聚合而成,其等电点高于缓冲盐最高pH 8.5,在3种pH的条件下PDAP带正电,而DEAE-Sepharose Fast Flow离子交换填料属于弱阴型,该填料的正电基团与PDAP不能吸附结合,因此PDAP存在于穿透峰中。
用HPLC法分别检测pH为6.5、7.5和8.5条件下收集的含有PDAP的洗脱液,结果显示pH 7.5的条件下收集液中杂质较少些,从图2可以看出,pH 7.5的条件下穿透液中PDAP与其他杂质的分离度较好,提高离子强度洗脱后除去的杂质比较多一些,因此选择pH 7.5的磷酸盐缓冲液进行纯化。考虑到使用50 mmol/L磷酸盐缓冲液作为流动相,收集的纯化液中也含有这些磷酸盐,需要除去,聚二氨基丙酸相对分子质量与磷酸盐相差较大,根据相对分子质量差异性,用分子筛Sephadex G-25除去磷酸盐(图2(d))。
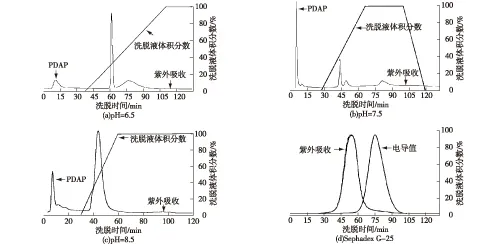
图2 DEAE-Sepharose Fast Flow弱阴离子交换层析和分子筛Sephadex G-25纯化聚二氨基丙酸的洗脱曲线Fig.2 Elution curves of PDAP purification by DEAE-Sepharose Fast Flow and Sephadex G-25
2.2 C18反向色谱纯化结果
用C18反向色谱纯化离子交换层析处理后的发酵液,首先使用V(甲醇)/V(水)=5/95、V(甲醇)/V(水)=15/85的流动相,纯化图谱如图3所示,分别收集洗脱峰1、2、3和4进行HPLC检测,如图4所示。
从图4可以看出,使用甲醇/水作为流动相,分离效果并不好,收集的洗脱峰中除了PDAP以外均含有杂质。值得注意的是,当流动相中甲醇体积分数为5%时,保留时间10 min以后的杂质被除去了,当流动相中甲醇体积分数上升至15%,保留时间10 min以后杂质又出现了。由此得出结论:上样前的料液中,PDAP的疏水性明显弱于其他杂质,因此,要想除去这些杂质,首先应该保证流动相中甲醇体积分数不超过5%,使疏水性较强的杂质与色谱柱填料相结合,后期可以通过提高流动相中甲醇的体积分数将其洗脱除去。同时,尝试在流动相水相成分中加入三氟乙酸或者磷酸,以改善分离效果,结果见图5。
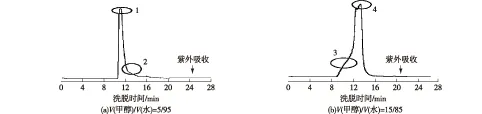
图3 C18反向色谱纯化聚二氨基丙酸的洗脱曲线Fig.3 Elution curves of PDAP purification by C18 reversed-phase chromatography
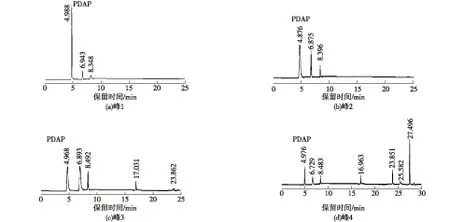
图4 高效液相色谱检测图3中C18反向色谱洗脱峰Fig.4 HPLC detection of C18 reversed-phase chromatography elution peaks in figure 3
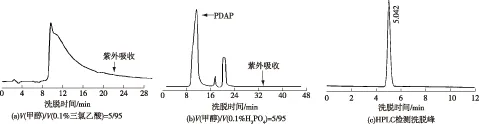
图5 加入三氟乙酸或磷酸后C18反向色谱纯化聚二氨基丙酸的洗脱曲线Fig.5 Elution curves of PDAP purification by C18 reversed-phase chromatography with trifluoroaceticacid and phosphoric acid
由图5可以看出:使用V(甲醇)/V(0.1%三氟乙酸)=5/95的流动相,分离效果没有得到明显改善,有拖尾现象,而使用V(甲醇)/V(0.1% H3PO4)=5/95的流动相时,分离效果得到明显改善,收集箭头所指的洗脱峰进行检测,结果洗脱峰内收集到的是PDAP纯品,没有其他杂质,表明使用该流动相,可以达到分离纯化聚二氨基丙酸的目的,收集的洗脱液经减压旋转蒸发,以除去洗脱液中的少量甲醇,然后透析处理除去洗脱液中的少量磷酸后进行冷冻干燥。将得到的固体进行结构表征,表征图谱如图6所示。由图6可知:质谱、核磁共振碳谱和红外图谱表明纯化得到的PDAP结构与图1相符,由于聚合度分布在6~17之间,PDAP相对分子质量分布在500~1 500之间,各纯化步骤的收率和样品纯度如表1所示,纯化后的PDAP样品纯度达98.4%。
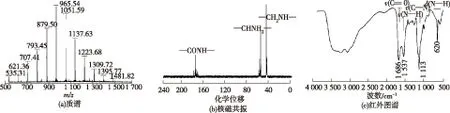
图6 聚二氨基丙酸纯品表征图谱Fig.6 Characterization spectra of PDAP purified sample
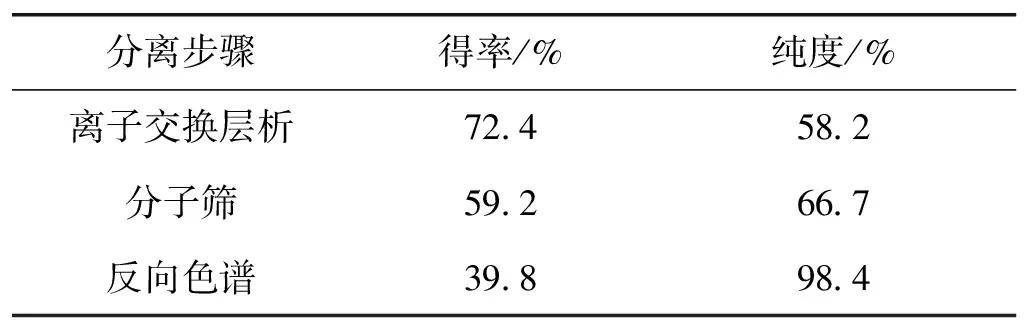
分离步骤得率/%纯度/%离子交换层析724582分子筛592667反向色谱398984
3 结 论
采用离子交换层析结合C18反向色谱技术,对菌株StreptomycealbulusPD-1发酵液进行分离纯化,获得PDAP纯品,纯化的回收率为39.8%,PDAP样品纯度达98.4%。离子交换层析柱选用DEAE-Sepharose Fast Flow填料,50 mmol/L 磷酸盐缓冲液(pH 7.5)平衡上样,含0.5 mol/L NaCl的磷酸盐缓冲液(pH 7.5)洗脱,洗脱液用分子筛Sephadex G-25除去磷酸盐缓冲液,然后用C18反相色谱进一步纯化,流动相为V(甲醇)/V(0.1% H3PO4)=5/95。PDAP是聚阳离子物质,相对分子质量分布在500~1 500之间,亲水性较强。
[1] Oppermann-Sanio F B,Steinbüchel A.Occurrence,functions and biosynthesis of polyamides in microorganisms and biotechnological production[J].Natur Wissen Schaften,2002,89:11-22.
[2] Ivánovics G,Erlös L.Ein Beitrag zum Wesen der Kapselsubstanz des Milzbrandbazillus[J].Z Immunitätsforsch Exp Ther,1937,90:5-19.
[3] Shima S,Sakai H.Polylysine produced byStreptomyces[J].Agric Biol Chem,1977,41:1807-1809.
[4] Takehara M,Saimura M,Inaba H,et al.Poly(γ-L-diaminobutanoic acid),a novel poly(amino acid),coproduced with poly(ε-L-lysine) by two strains ofStreptomycescelluloflavus[J].FEMS Microbiol Lett,2008,286:110-117.
[5] Nishikawa M,Ogawa K.Antimicrobial activity of a chelatable poly(arginyl-histidine) produced by the ergot fungusVerticilliumkibiense[J].Antimicrob Agents Chemother,2004,48:229-235.
[6] Xia J,Xu H,Feng X H,et al.Poly(L-diaminopropionic acid),a novel non-proteinic amino acid oligomer co-produced with poly(ε-L-lysine) byStreptomycesalbulusPD-1[J].Appl Microbiol Biotechnol,2013,97(17):7597-7605.
[7] Yoshida T,Nagasawa T.ε-Poly-L-lysine:microbial production,biodegradation and application potential[J].Appl Microbiol Biotechnol,2003,62:21-26.
(责任编辑 荀志金)
Purification of poly (L-diaminopropionic acid) by ion-exchange andreversed-phase chromatography
XIA Jun,XU Zhaoxian,BO Fangfang,FENG Xiaohai,CHI Bo,XU Hong
(College of Food Science and Light Industry,Nanjing Tech University,Nanjing 211800,China)
Theε-polylysine producing strainStreptomycesalbulusPD-1 could synthesize a novel non-proteinic amino acid oligomer:poly(L-diaminopropionic acid) (PDAP).Ion-exchange and reversed-phase chromatography were used to study the purification conditions of PDAP.In the ion-exchange chromatography purification,DEAE-Sepharose Fast Flow was selected,50 mmol/L phosphate buffer was used as mobile phase and 0.5 mol/L NaCl in the phosphate buffer acted as elution.In the reversed-phase chromatography purification,ratio of methanol to 0.1% phosphoric acid was 5/95 (V/V) and was used as the mobile phase.Pure PDAP sample was obtained by ion-exchange and reversed-phase chromatography,the recovery rate of the purification was 39.8%,and the purity of the sample was 98.4%.
poly(L-diaminopropionic acid); purification; ion-exchange chromatography; reversed-phase chromatography
10.3969/j.issn.1672-3678.2014.06.011
2013-06-26
国家自然科学基金(21176123、21006050);国家重点基础研究发展计划(973计划)(2013CB733600);高等学校博士学科点专项科研基金(20113221130001);长江学者和创新团队发展计划(IRT1066);江苏省普通高校研究生科研创新计划(CXZZ13_0464)
夏 军(1986—),男,江苏句容人,博士研究生,研究方向:发酵工程;徐 虹(联系人),教授,E-mail:xuh@njtech.edu.cn
TQ028.8
A
1672-3678(2014)06-0057-05

