白酒丢糟的多酶复配降解制备可发酵性糖
刘跃红,吴正云,杨 健,吴艳萍,袁玉菊,张文学,2
(1.四川大学食品工程系,成都610065; 2.四川大学锦江学院白酒学院,眉山620860)
白酒丢糟的多酶复配降解制备可发酵性糖
刘跃红1,吴正云1,杨 健1,吴艳萍1,袁玉菊1,张文学1,2
(1.四川大学食品工程系,成都610065; 2.四川大学锦江学院白酒学院,眉山620860)
为有效利用纤维质原料制备可发酵性糖生产燃料酒精,通过NaOH-过氧乙酸预处理白酒丢糟,经质量分数2%NaOH和体积分数6%过氧乙酸处理后,白酒丢糟中木质素去除率达66.13%~77.02%,总纤维素回收率78.04%~90.73%。对处理后的白酒丢糟进行多酶复配糖化降解,通过均匀设计实验确定白酒丢糟酶降解的数学模型,得出总糖降解率与各酶添加量之间的回归关系,在最优条件下白酒丢糟降解率为(0.432 8±0.013 5) g/g。
NaOH-过氧乙酸;白酒丢糟;多酶复配;均匀设计
白酒生产过程中最主要副产物之一的白酒丢糟不及时处理,会腐败变质,不仅浪费资源,而且严重污染环境[1]。白酒丢糟的主要成分为纤维素、半纤维素和木质素[2], Zhao等[3-4]用NaOH-过氧乙酸处理,再用纤维素酶等相关酶系糖化,得到较好的降解效果。Charles等[5]研究发现纤维素经氨水处理后会产生膨胀现象,造成原料的结晶度降低,从而显著提高纤维素和半纤维素的反应活性,便于酶水解的进行。Zhang等[6]认为碱处理对连接半纤维素和其他组分分子间的酯键起到皂化作用,膨胀纤维素,脱除木质素,提高酶解糖化率;赵雪冰等[7]、Teixeira等[8]利用过氧乙酸的强氧化性和良好的脱木质素和漂白能力的特点,通过过氧乙酸与木质素进行羟基化反应等有效地脱除了木质素类大分子。
目前,国内外对纤维质原料生产燃料酒精的研究主要集中在不同预处理方法对单酶糖化效果的影响上,Tabka等[9]、Kataria等[10]、Rabelo等[11]也对多酶复配做了一定的研究,但是对多酶复合糖化降解运用于白酒丢糟的研究报道较少。本文中笔者研究NaOH-过氧乙酸预处理白酒丢糟,用4种不同的酶复配糖化降解白酒丢糟,以期得到较好的糖化效果。
1 材料和方法
1.1 实验材料
白酒鲜丢糟由四川水井坊股份有限公司提供,含水率65%左右,冷冻保存,使用前置于70 ℃烘箱干燥至恒质量,烘干后总纤维素质量分数(51.24±1.7)%,木质素质量分数(18.62±2.1)%;过氧乙酸体积分数16%,使用前需滴定浓度[12],购于长征试剂公司;葡萄糖试剂盒,购于长春汇力生物技术有限公司;纤维素酶NS22086(FPU比酶活为25.47 IU/mL)、β-葡萄糖苷酶NS22118(比酶活为15.12 IU/mL)、木聚糖酶NS22083(比酶活为17.08 IU/mL)、复合酶NS22119(其中主要的β-葡萄糖苷酶比酶活为6.77 IU/mL),购于诺维信天津分公司。
1.2 实验仪器
UV-1100型紫外分光光度计,上海美谱达仪器有限公司;HZO-X100型气浴摇床,太仓市豪诚实验仪器制造有限公司;LX-400型管式离心机,深圳市赛亚泰科仪器设备有限公司;HWS28型电热恒温水浴锅,DHG-905A型电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;100~1 000 μL百得移液枪,上海摩亿科贸有限公司。
1.3 实验方法
1.3.1 实验流程
白酒丢糟预处理后多酶糖化降解工艺流程如图1所示。工艺流程中,白酒丢糟干燥均为70 ℃恒温至恒质量。
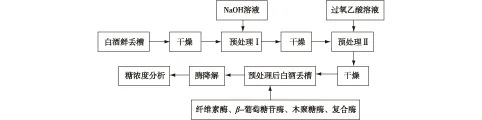
图1 白酒丢糟降解工艺流程Fig.1 Flow chart of distillers′ grains degradation experiment
1)鲜丢糟干燥与检测。从酒厂提取白酒鲜丢糟置于电热恒温鼓风干燥箱中,70 ℃恒温至恒质量得干糟,并测定其指标。2)预处理Ⅰ用2%NaOH溶液按固液比1∶ 10(g/mL)添加白酒干丢糟,在85 ℃水浴恒温槽中处理1.5 h。3)预处理Ⅱ用6%过氧乙酸按固液比1∶ 5(g/mL)添加白酒干丢糟,在60 ℃水浴恒温槽中处理5 h。4)酶降解用pH 4.8~5.0的柠檬酸钠缓冲液调节白酒丢糟百分比,于50 ℃、150 r/min的气浴摇床处理48 h。
1.3.2 成分分析
白酒丢糟中纤维素和半纤维素含量分析参照文献[13],酶解液中总糖、葡萄糖及木糖含量的测定方法分别采用3,5-二硝基水杨酸(DNS)法[14]、葡萄糖试剂盒法和间苯三酚法测定[15]。酶解液中总糖、葡萄糖及木糖得率计算见式(1):
(1)
式中:Y为酶解液中总糖、葡萄糖或木糖产率,mg/g;0.9为修正系数;m为酶解液中还原糖、葡萄糖或木糖质量,g;m′为白酒丢糟预处理后干质量,g;2次平行实验,取其平均值。
1.3.3 木质素的测定
按照国标GB/T2677.8—1994测定白酒丢糟中木质素的含量。
(2)
式中:R为木质素去除率,%;m0为白酒丢糟处理前木质素质量,g;m1为白酒丢糟处理后木质素质量,g。
1.3.4 总纤维素的测定
按照国标GB/T2677.10—1995测定白酒丢糟中总纤维素的含量。
(3)
式中:Z为总纤维素回收率,%;m3为白酒丢糟处理前总纤维质量,g;m4为白酒丢糟处理后总纤维质量,g。
1.3.5 样品酶降解
白酒丢糟经预处理后用pH 4.8~5.0的柠檬酸钠缓冲液调节底物浓度,添加2%叠氮化钠1 mL,同时添加纤维素酶NS22086、β-葡萄糖苷酶NS22118、木聚糖酶22083和复合酶22119,于50 ℃、150 r/min的气浴摇床糖化降解48 h,离心得上清液[16-17]。将上清液稀释一定倍数后,测定酶解液中总糖、葡萄糖和木糖浓度及产率。
2 结果与讨论
2.1 NaOH-过氧乙酸处理白酒丢糟
根据文献[18],称取100 g白酒干丢糟于1 000 mL烧杯中,按照图1所示工艺条件进行白酒丢糟预处理,该实验进行3次重复,处理后白酒丢糟中总纤维素回收率和木质素去除率如表1所示。由表1可知:总纤维素回收率为78.04%~90.73%,木质素去除率为66.13%~77.02%。
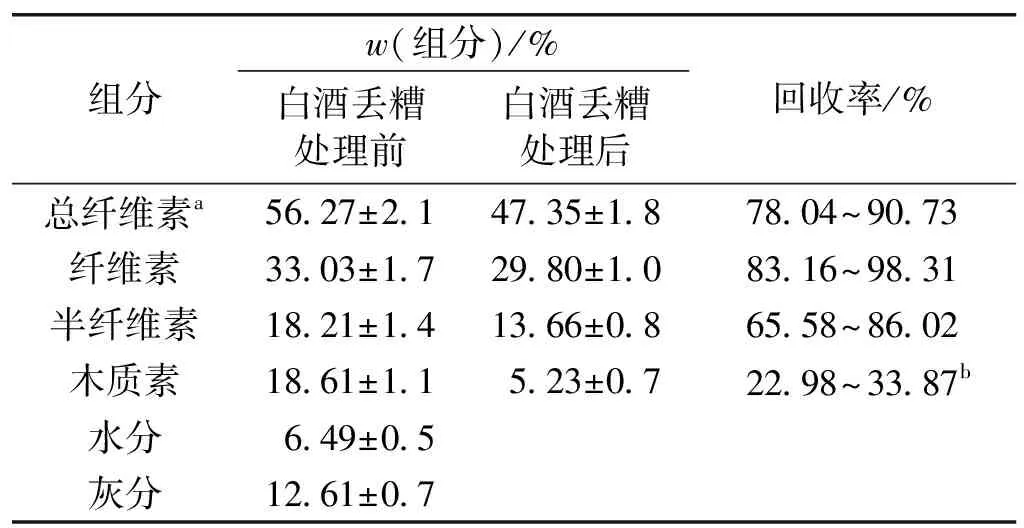
表1 白酒丢糟预处理前后组分变化
注:a—文献[19]的数据; b—木质素去除率=100%-回收率。
2.2 预处理后白酒丢糟酶降解
2.2.1 均匀实验设计
通过比较前期实验结果[18]及查阅相关文献[20],总结5个影响白酒丢糟复合酶糖化降解的因素X1、X2、X3、X4、X5。①X1:白酒丢糟百分比(g/100 mL);②X2:纤维素酶NS211086体积(mL);③X3:β-葡萄糖苷酶NS22118体积(mL);④X4:木聚糖酶NS22083体积(mL);⑤X5:复合酶NS22119体积(mL)。以总糖降解率为考察指标,用DPS(date processing system)数据处理系统[21]设计 U8(85)均匀设计表,设计方案结果见表2。根据表2实验方案,分别在4、11、23、33、48 h测定酶解液中的总糖、葡萄糖和木糖浓度。结果如图2~图4所示。
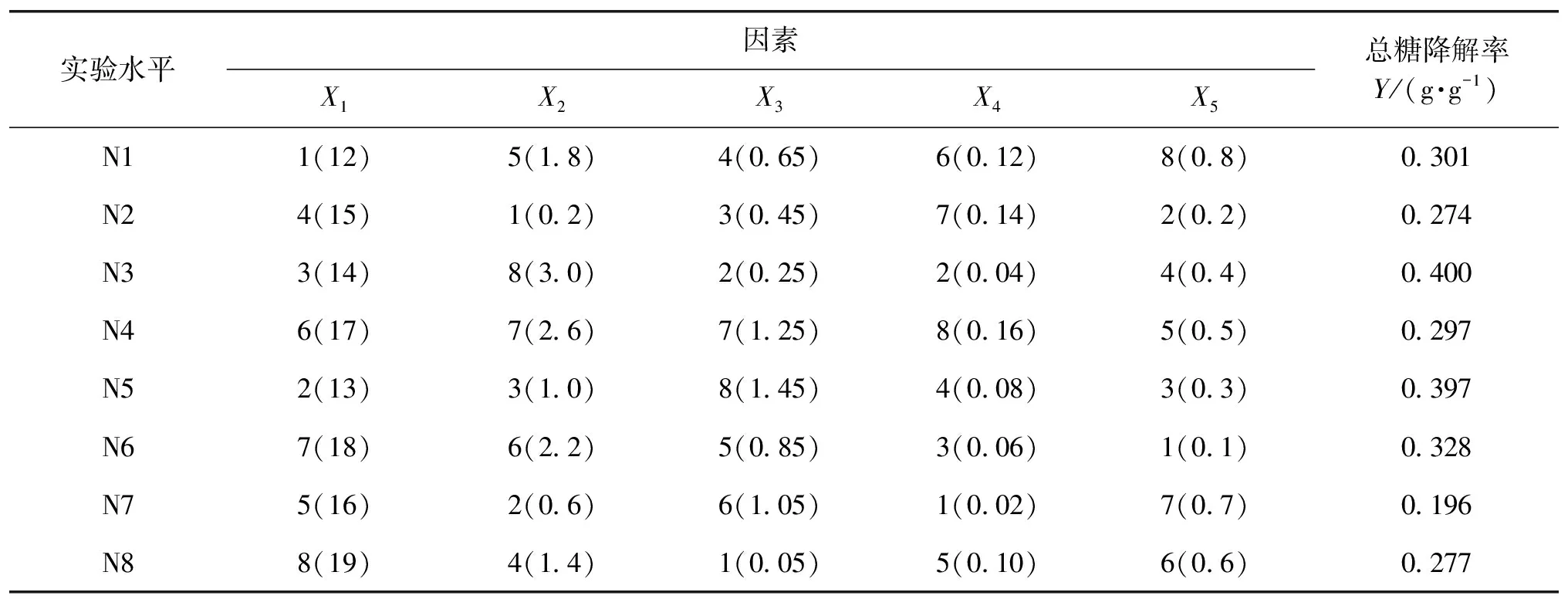
表2 U8(85)均匀设计方案
由图2~图4可以看出:酶解液中糖浓度随着酶解时间的延长而增加。在开始4 h内,酶解速率较高,随后酶解液中葡萄糖浓度逐渐增大,葡萄糖浓度的升高会延缓酶降解速率,在11~23 h内酶解速率降低,糖浓度增加缓慢;当33 h时,酶解液中糖浓度达到最高,之后糖浓度不再增加或增加很少,主要是因为溶液中葡萄糖浓度的增大影响了酶的活性,使得酶解速率降低直至停止。在后续实验中,用复配酶处理白酒丢糟33 h,对各酶添加量进行均匀实验设计优化,总糖降解率见表2。由表2可以得出,总糖降解率最高为0.4 g/g,为第3组实验,该组实验中,底物浓度和纤维素酶NS22086为主要影响总糖降解率的因素。
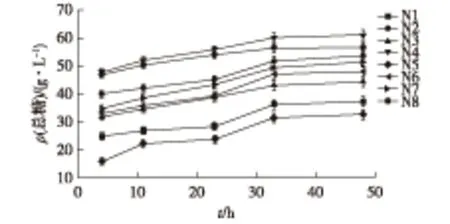
图2 酶解液中总糖浓度随时间的变化Fig.2 Changes of total sugar over time in the enzyme solution
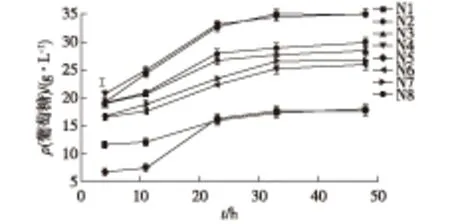
图3 酶解液中葡萄糖浓度随时间的变化Fig.3 Changes of glucose over time in the enzyme solution
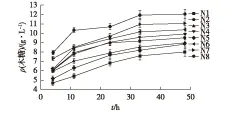
图4 酶解液中木糖浓度随时间变化Fig.4 Changes of xylose over time in the enzyme solution
2.2.2 回归方程的建立和分析
通过均匀设计和DPS数据处理系统分析,根据各因素对酶降解白酒丢糟总糖降解率的影响显著程度进行多元二次回归,所得多元二次回归方程:
复相关系数R=0.998 6,F值为58.125 8,显著水平P值为0.007 8,剩余标准差为0.009 5,复相关系数R和F值越大。剩余标准差越小,说明数据和方程的拟合度越高。从回归方程可以得出,X2与X5之间存在相互作用,X2、X3和X4对酶解的作用明显,因为X2(纤维素酶NS211086)的主要组分是葡萄糖内切酶、葡萄糖外切酶和β-葡萄糖苷酶。只有当这3个主要组分的活性比例适当时,才能协同完成对纤维素的高效降解[22-23]。如果再添加因素3(β-葡萄糖苷酶NS22118),会显著提高纤维素酶糖化效率[24]。同时半纤维素被木聚糖酶水解后,可降低物料对纤维素酶的无效吸附,提高单糖产率[25]。根据回归方程,由DPS得出最佳复配酶降解白酒丢糟组合,见表3。

表3 总糖降解率最高时各个因素组合
2.2.3 验证实验
根据DPS数据处理系统的分析及预测,总糖降解率最高时,白酒丢糟百分比0.12 g/mL,纤维素酶NS211086添加量2.965 5 mL,β-葡萄糖苷酶NS22118添加量1.303 9 mL,木聚糖酶NS22083添加量0.078 4 mL,复合酶NS22119添加量0.633 1 mL。由回归方程计算出总糖理论最大得率为0.464 8 g/g,在此实验条件下进行3次重复实验,得到总糖的实际得率为(0.432 8±0.013 5) g/g,低于理论值,但明显高于前述各实验条件下得出的实验数值。
3 结 论
1)用质量分数2%NaOH溶液和体积分数6%过氧乙酸溶液相结合的方法对白酒丢糟进行预处理,白酒丢糟中木质素去除率达到66.13%~77.02%,总纤维回收率为78.04%~90.73%左右,木质素的脱除有利于下一步酶的糖化降解。
2)对白酒丢糟复配酶降解首次采用DPS数据处理系统设计均匀试验并分析数据,通过回归分析得出影响总糖降解得率的各因素之间存在一定的相互作用。根据本研究的前期实验选定主要影响白酒丢糟总糖降解率的因素及各因素的取值范围,由回归方程计算出总糖理论最大得率为0.464 8 g/g,经过验证实验,得出总糖实际得率为(0.432 8±0.013 5) g/g,与理论值接近。
[1] 秦广利,郭坤亮,汪强,等.纤维素酶对白酒酒糟资源化利用研究[J].酿酒科技,2009(4):34-35.
[2] Wang Z Y,Xiao M.Comprehensive utilization of distillers′ grains and its development foreground[J].Liquor-Making Science & Technology,2004,1:65-68.
[3] Zhao X B,Song Y Q,Liu D H.Enzymatic hydrolysis and simultaneous saccharification and fermentation of alkali/peracetic acid-pretreated sugarcane bagasse for ethanol and 2,3-butanediol production[J].Enzyme and Microbial Technology,2011,49(4):413-419.
[4] Zhao X B,Feng P,Cheng K K,et al.Enhancement of the enzymatic digestibility of sugarcane bagasse by alkali-peracetic acid pretreatment[J].Enzyme and Microbial Technology,2009,44(1):17-23.
[5] Charles J K,John F K.Degradation of cellulose under alkaline conditions[J].Carbohydrate Polymers,2003,51(3):281-300.
[6] Zhang Y H,Lynd L R.Toward an aggregated understanding of enzymatic hydrolysis of cellulose:noncomplexed cellulase systems[J].Biotechnology and Bioengineering,2004,88(7):797-824.
[7] 赵雪冰,苏凤宜,邢新会.过氧乙酸氧化木质素磺酸钠[J].清华大学学报:自然科学版,2005,45(9):1244-1247.
[8] Teixeira L C,Linden J C,Schroeder H A.Alkaline and peracetic acid pretreatments of biomass for ethanol production[J].Applied Biochemistry and Biotechnology,1999,78:19-34.
[9] Tabka M G,Herpoel-Gimbert I,Monod F,et al.Enzymatic saccharification of wheat straw for bioethanol production by a combined cellulase xylanase and feruloyl esterase treatment[J].Enzyme and Microbial Technology,2006,39(4):897-902.
[10] Kataria R,Ghosh S.Saccharification of Kans grass using enzyme mixture fromTrichodermareeseifor bioethanol production[J].Bioresource Technology,2011,102(21):9970-9975.
[11] Rabelo S C,Amezquita Fonseca N A,Andrade R R,et al.Ethanol production from enzymatic hydrolysis of sugarcane bagasse pretreated with lime and alkaline hydrogen peroxide[J].Biomass and Bioenergy,2011,35(7):2600-2607.
[12] 薛广波.灭菌 消毒 防腐 保藏[M].北京:人民卫生出版社,1993.
[13] Sluiter A,Hames B,Ruiz R,et al.Determination of structural carbohydrates and lignin in biomass[EB/OL].[2013-07-25].http://www.docin.com/p-99928203.html.
[14] Ghose T K.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,59(2):257-268.
[15] 黎军友,孙丹.间苯三酚显色法微量快速测定木糖含量[J].感染、炎症、修复,2002,3(9):167-169.
[16] Kim S,Holtzapple M T.Effect of structural features on enzyme digestibility of corn stover[J].Bioresource Technology,2006,97(4):583-591.
[17] Yang J,Zhang X,Yong Q,et al.Three-stage hydrolysis to enhance enzymatic saccharification of steam-exploded corn stover[J].Bioresource Technology,2010,101(13):4930-4935.
[18] 杨健,陈喆,钟霞,等.NaOH 预处理对白酒丢糟纤维素降解效果的影响[J].食品工业,2013,34(2):151-154.
[19] 李淑君,张春雷,方桂珍.微波辅助法制备木材综纤维素[J].东北林业大学学报,2004,32(3):40-41.
[20] Cristobal C,Manuel M,Ignacio B,et al.Influence of solid loading on enzymatic hydrolysis of steam exploded or liquid hot water pretreated olive tree biomass[J].Process Biochemistry,2007,42(6):1003-1009.
[21] 唐启义,冯明光.DPS数据处理系统[M].北京:科学出版社,2007.
[22] 杜文娟,王家东,侯红萍.纤维素酶的制备及其应用研究[J].酿酒,2007,34(3):60-62.
[23] Deepa D,Yogender P K,Ramesh C K.Optimization of cellulase production by a brown rot fungusFomitopsissp.RCK2010 under solid state fermentation[J].Bioresource Technology,2011,102 (10):6065-6072.
[24] 冯月,蒋建新,朱莉伟,等.纤维素酶活力及混合纤维素酶协同作用的研究[J].北京林业大学学报,2009(增刊1):169-173.
[25] Pratima B.Microbial xylanolytic enzyme system:properties and applications[J].Advances in Applied Microbiology,1997,43:141-194.
(责任编辑 管 珺)
Preparing of fermentable sugars from pretreatment Chinese liquor distillers′ grains by using multi-enzyme hydrolysis
LIU Yuehong1,WU Zhengyun1,YANG Jian1,WU Yanping1,YUAN Yuju1,ZHANG Wenxue1,2
(1.Department of Food Engineering,Sichuan University,Chengdu 610065,China; 2.College of China Spirits,Jinjiang College,Sichuan University,Meishan 620860,China)
We used NaOH-peracetic acid pretreatment of distillers′ waste grains to convert holocellulose to fermentable sugars for bioethanol production.The results show that when the distillers′ grains is pretreated with a mixture of 2% (m/m) NaOH solution and 6% (V/V) peracetic acid solution,66.13% to 77.02% lignin was removed and 78.04%-90.73% cellulose was recovered.The experiment of multienzyme hydrolysis with multiple factors and multiple levels was designed by the date processing system according to U8(85).The mathematic model for total sugars degradation rate was acquired and it showed that under the optimal condition,the total sugars degradation rate was (0.432 8±0.013 5) g/g.
NaOH-peracetic acid;distillers′ grains;multienzyme;uniform design
10.3969/j.issn.1672-3678.2014.06.004
2013-08-06
科技部国际合作项目(2009DFA60890);四川省科技支撑计划(2013GZX0161)
刘跃红(1985—),男,江西南昌人,博士研究生,研究方向:发酵工程;张文学(联系人),教授,E-mail:foodbitech@126.com
TQ261
A
1672-3678(2014)06-0018-05

