膳食摄入染料木素对ICR小鼠血脂及肝脏的影响
刘丹凤,聂少平,刘 昕,李文娟,胡晓鹃,帅小雪
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
膳食摄入染料木素对ICR小鼠血脂及肝脏的影响
刘丹凤,聂少平*,刘 昕,李文娟,胡晓鹃,帅小雪
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的:研究自胎儿期开始长期膳食摄入染料木素对ICR雌、雄子代小鼠血脂及肝脏的影响。方法:自ICR母鼠妊娠第1天开始分别以0、5、25、50 mg/(kg·d)(以体质量计,下同)的染料木素灌胃母鼠并在子代小鼠出生后继续对子代小鼠进行相同的处理,分别于子代小鼠出生后第21、42、80天对其分离血清和肝脏,测定血清中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量;采用苏木精-伊红染色对子代小鼠肝脏进行组织形态观察。结果:自胎儿期开始长期膳食摄入染料木素可降低第21、42、80天ICR雌、雄子代小鼠的血清TC水平,且这种作用在第42、80天时更显著;自胎儿期开始长期膳食摄入染料木素还可以降低子代小鼠血清中TG和LDL-C水平,且对雄性子代小鼠LDL-C的降低效果更显著。染色结果显示自胎儿期开始长期膳食摄入染料木素可能会增加子代小鼠肝脏脂肪变性的风险。结论:自胎儿期开始长期膳食摄入染料木素可降低子代小鼠血清中TC、TG、LDL-C水平,同时可能会增加子代小鼠肝脏脂肪变性的风险。
染料木素;ICR小鼠;血脂;肝脏;苏木精-伊红染色
植物雌激素是一类来源于植物的化合物,它们在结构和功能上与内源性雌激素相似,可与体内的雌激素受体结合,发挥雌激素样作用。由于其雌激素样作用,植物雌激素有包括降低患骨质疏松[1-2]、心脏病[3]、癌症[4-5]和更年期症状[6]等风险在内的诸多益处。然而,植物雌激素也被认为有内分泌干扰效应,可能具有对健康不利的潜在危害,这一点越来越受到人们的关注。研究发现孕期、幼年动物对激素水平的敏感性远比成年动物高,激素水平的微量改变即可对动物的终生造成影响[7-9],因此研究植物雌激素对子代小鼠的影响具有重要的意义。
染料木素是一种在大豆和大豆产品中含量很高的植物雌激素,也是人和动物植物雌激素暴露的主要来源。本实验选取染料木素为材料,参考植物雌激素的人群摄入量[10],以接近人群膳食摄入的不同剂量进行处理,研究自胎儿时期开始长期膳食摄入染料木素对不同年龄段的ICR雌、雄子代小鼠的血 脂水平及肝脏的影响,以期为染料木素或植物雌激素的摄入提供膳食指导。
1 材料与方法
1.1 动物、材料与试剂
SPF级健康雌、雄ICR小鼠各40 只,体质量23~26 g(雌性)、28~30 g(雄性),由湖南斯莱克景达实验动物有限公司提供(许可证号:SCXK(湘)2009-0004)。SPF级AIN-93饲料由江苏南通特洛菲饲料科技有限公司提供。
染料木素(纯度≥98%) 上海同田生物技术有限公司;总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)试剂盒中生北控股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
KD-TS3D生物组织脱水机、KD-BM、BL生物组织冷冻包埋机、KD-2258轮转切片机、KD-T摊、烤片机 浙江金华科迪仪器设备有限公司;光学倒置显微镜日本Nikon公司;7160全自动生化仪 日本日立公司;独立通气笼具 苏州苏杭科技器材有限公司;TGL-16C离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 动物分组及处理
SPF级ICR雌、雄鼠各40 只分开,于SPF级动物房适应性喂养1 周后,将雌鼠按体质量随机分为对照组、染料木素3 个剂量组,每组10 只。观察雌鼠性周期,并于动情前期以雌雄比1∶1合笼,隔天上午观察雌鼠阴栓,有阴栓的即为孕鼠,视为妊娠第1天并开始按照相应剂量灌胃,直至子代出生。子代出生当天视为出生第0天,此后改为对子代进行相同的处理,每组按体质量随机选取雌、雄子代小鼠各24 只,并于第21、42、80天各随机选取8 只子代小鼠处死,分离血清、肝脏进行检测。染料木素低、中、高3 个剂量组分别灌胃5、25、50 mg/(kg·d)染料木素(以玉米油为溶剂),对照组灌胃等量的溶剂。室内保持在(22±2)℃温度,光照时间按正常昼夜节律调节,饲喂SPF级AIN-93饲料,实验期间所有小鼠均自由饮水、饮食,每周称量一次体质量并记录。
1.3.2 血脂的测定
分别于子代小鼠出生后第21、42、80天禁食过夜(12 h),眼球采血,8 000 r/min离心15 min,分离血清,采用放射免疫法测定TC、TG、LDL-C含量。
1.3.3 肝脏指数及组织形态观察
分别于子代小鼠出生后第21、42、80天禁食过夜(12 h),称体质量,脱臼处死,分离肝脏称质量,按照下式计算肝脏指数。
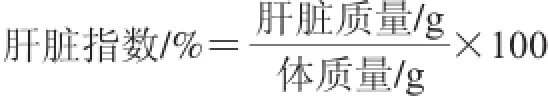
将肝脏置于中性福尔马林固定液中固定,经脱水、包埋、切片后,石蜡切片常规脱蜡,梯度乙醇水化,苏木精染色2 min,体积分数1%盐酸乙醇分化3~5 s,稀氨水返蓝1~2 s,伊红染色15 s,脱水、透明、中性树胶封片,光学倒置显微镜进行病理学观察并拍照。
1.4 数据分析
2 结果与分析
2.1 染料木素对子代小鼠血脂指标的影响
2.1.1 染料木素对子代小鼠血清TC含量的影响
表1 染料木素对雌性子代小鼠血清TC含量的影响(±s,n=8)Table1 Effect of genistein on the serum TC level of female ICR mice±s, n=8)

表1 染料木素对雌性子代小鼠血清TC含量的影响(±s,n=8)Table1 Effect of genistein on the serum TC level of female ICR mice±s, n=8)
注:*. 与对照组相比,差异显著(P<0.05)。下同。
组别TC含量/(mmol/L)21 d42 d80 d对照组3.757±0.2204.026±0.4684.256±0.422染料木素低剂量组3.355±0.260*3.309±0.319*3.565±0.340*染料木素中剂量组3.580±0.2183.129±0.294*3.381±0.058*染料木素高剂量组3.444±0.2953.312±0.412*3.317±0.182*
由表1可知,雌性子代小鼠出生第21天时,染料木素各剂量组小鼠的TC浓度均低于对照组,其中染料木素低剂量组的TC浓度与对照组相比有显著差异,而染料木素各剂量组间没有显著差异。第42、80天时,染料木素各剂量组小鼠的TC浓度均显著低于对照组,而染料木素各剂量组间没有显著差异。
表2 染料木素对雄性子代小鼠血清TC含量的影响(±s,n=8)Table2 Effect of genistein on the serum TC level of male ICR mice±s, n=8)

表2 染料木素对雄性子代小鼠血清TC含量的影响(±s,n=8)Table2 Effect of genistein on the serum TC level of male ICR mice±s, n=8)
组别TC含量/(mmol/L)21 d42 d80 d对照组4.069±0.2885.120±0.5175.315±0.564染料木素低剂量组3.700±0.2913.893±0.600*4.185±0.119*染料木素中剂量组3.867±0.3254.139±0.329*4.114±0.110*染料木素高剂量组3.747±0.4564.100±0.215*3.796±0.536*
由表2可知,雄性子代小鼠在出生第21天时,染料木素各剂量组小鼠的TC浓度均低于对照组,但无显著差异。第42、80天时,染料木素各剂量组小鼠的TC浓度均显著低于对照组,但染料木素各剂量组间无显著差异。
由以上结果可知,膳食摄入染料木素可降低ICR雌、雄子代小鼠的血清TC含量,且可能与染料木素摄入的时间长短有关。
2.1.2 染料木素对子代小鼠血清TG含量的影响
表3 染料木素对雌性子代小鼠血清TG含量的影响(±s,n=88)Table3 Effect of genistein on the serum TG level of female ICR mice±s, n=8)

表3 染料木素对雌性子代小鼠血清TG含量的影响(±s,n=88)Table3 Effect of genistein on the serum TG level of female ICR mice±s, n=8)
组别TG含量/(mmol/L)21 d42 d80 d对照组1.909±0.2701.399±0.1791.284±0.186染料木素低剂量组1.541±0.061*1.282±0.1661.213±0.266染料木素中剂量组1.473±0.297*1.365±0.2201.441±0.328染料木素高剂量组1.438±0.260*1.283±0.1281.222±0.126
由表3可知,雌性子代小鼠出生第21天时,染料木素各剂量组小鼠的血清TG浓度均显著低于对照组。第42、80天时,染料木素各剂量组小鼠TG浓度与对照组相比有降低的趋势,但无显著差异。
表4 染料木素对雄性子代小鼠血清TG含量的影响(±s,n=8)Table4 Effect of genistein on the serum TG level of male ICR mice±s, n=8)
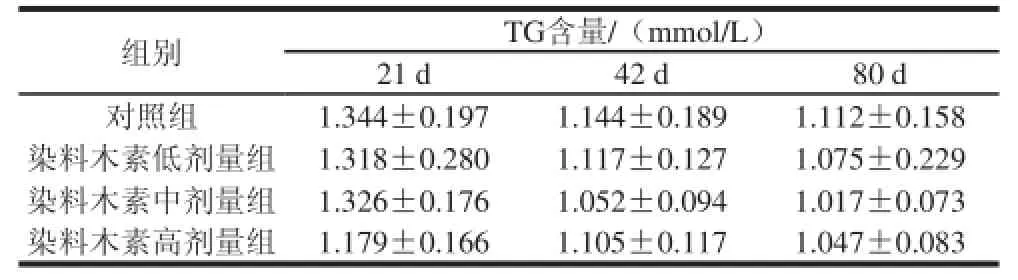
表4 染料木素对雄性子代小鼠血清TG含量的影响(±s,n=8)Table4 Effect of genistein on the serum TG level of male ICR mice±s, n=8)
组别TG含量/(mmol/L)21 d42 d80 d对照组1.344±0.1971.144±0.1891.112±0.158染料木素低剂量组1.318±0.2801.117±0.1271.075±0.229染料木素中剂量组1.326±0.1761.052±0.0941.017±0.073染料木素高剂量组1.179±0.1661.105±0.1171.047±0.083
由表4可知,雄性子代小鼠出生第21、42、80天时,染料木素各剂量组小鼠的TG浓度与对照组相比均有所降低,但无显著差异。
由以上结果可知,膳食摄入染料木素具有降低ICR雌、雄子代小鼠的血清TG含量的效果。
2.1.3 染料木素对子代小鼠血清LDL-C含量的影响
表5 染料木素对雌性子代小鼠血清LDL-C含量的影响(±s,n=8)Table5 Effect of genistein on the serum LDL-C level of female ICR mice(±s, n=8)

表5 染料木素对雌性子代小鼠血清LDL-C含量的影响(±s,n=8)Table5 Effect of genistein on the serum LDL-C level of female ICR mice(±s, n=8)
注:#. 与染料木素低剂量组相比,差异显著(P<0.05);&. 与染料木素中剂量组相比,差异显著(P<0.05)。下同。
组别LDL-C含量/(mmol/L)21 d42 d80 d对照组0.505±0.080.323±0.1650.436±0.274染料木素低剂量组0.446±0.1940.240±0.1040.345±0.149染料木素中剂量组0.982±0.326*#0.330±0.1250.465±0.082染料木素高剂量组0.279±0.020*&0.303±0.0660.208±0.036*#
由表5可知,雌性子代小鼠在出生第21、42、80天时,染料木素低剂量组小鼠的血清LDL-C浓度均低于对照组,但无显著差异;在第21、80天时,染料木素高剂量组小鼠的血清LDL-C浓度显著低于对照组;在第21天时,染料木素中剂量组小鼠的LDL-C浓度高于对照组,其原因可能是个体差异引起的。
表6 染料木素对雄性子代小鼠血清LDL-C含量的影响(±s,n=8)Table6 Effect of genistein on the serum LDL-C level of male ICR mice±s,n=8)
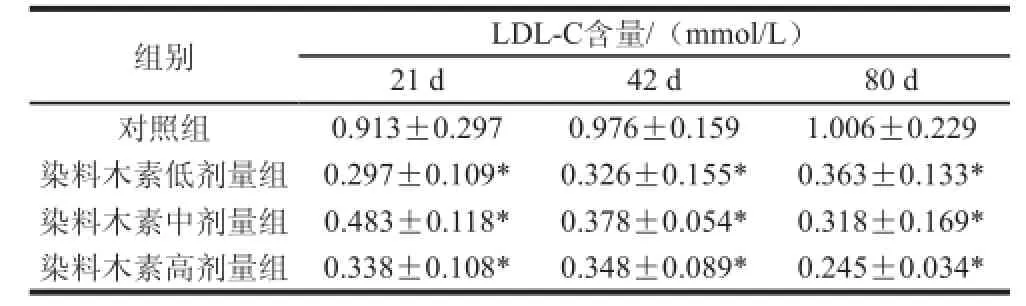
表6 染料木素对雄性子代小鼠血清LDL-C含量的影响(±s,n=8)Table6 Effect of genistein on the serum LDL-C level of male ICR mice±s,n=8)
组别LDL-C含量/(mmol/L)21 d42 d80 d对照组0.913±0.2970.976±0.1591.006±0.229染料木素低剂量组0.297±0.109*0.326±0.155*0.363±0.133*染料木素中剂量组0.483±0.118*0.378±0.054*0.318±0.169*染料木素高剂量组0.338±0.108*0.348±0.089*0.245±0.034*
由表6可知,雄性子代小鼠在出生第21、42、80天时,染料木素各剂量组小鼠的血清LDL-C浓度均显著低于对照组,但染料木素各剂量组间相比无显著差异。
由以上结果可知,染料木素可降低小鼠血清LDL-C浓度,且这种作用在雄鼠身上体现得更明显,其原因可能是雌、雄鼠本身体内的雌激素水平的差异引起的[11]。
2.2 染料木素对子代小鼠肝脏的影响
2.2.1 染料木素对子代小鼠肝脏指数的影响
表7 染料木素对雌性子代小鼠肝脏指数的影响(±s,n=8)Table7 Effect of genistein on the liver index of female ICR mice±s, n=8)
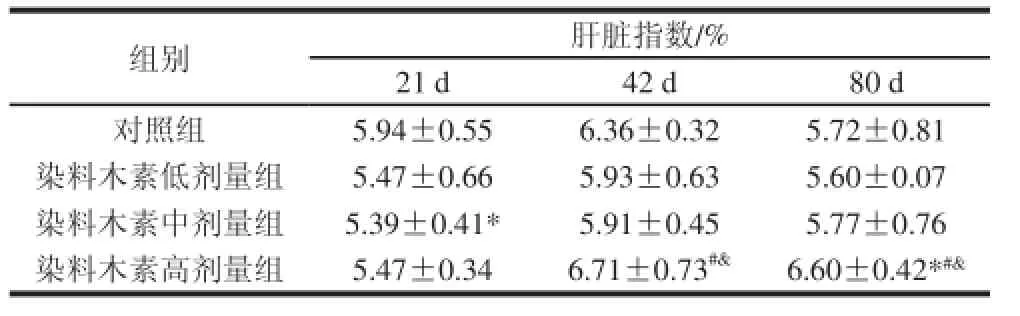
表7 染料木素对雌性子代小鼠肝脏指数的影响(±s,n=8)Table7 Effect of genistein on the liver index of female ICR mice±s, n=8)
组别肝脏指数/% 21 d42 d80 d对照组5.94±0.556.36±0.325.72±0.81染料木素低剂量组5.47±0.665.93±0.635.60±0.07染料木素中剂量组5.39±0.41*5.91±0.455.77±0.76染料木素高剂量组5.47±0.346.71±0.73#&6.60±0.42*#&
由表7可知,雌性子代小鼠在出生第21、42、80天时,染料木素低剂量组小鼠的肝脏指数与对照组相比无显著性差异;在第21天时,染料木素中剂量组的肝脏指数显著低于对照组,但在第42、80天这种差异性消失,染料木素高剂量组与对照组及低、中剂量组之间有显著差异,但这种差异可能是由于个体差异所造成的。
表8 染料木素对雄性子代小鼠肝脏指数的影响(±s,n=8)Table8 Effect of genistein on the liver index of male ICR mice±s, n=8)

表8 染料木素对雄性子代小鼠肝脏指数的影响(±s,n=8)Table8 Effect of genistein on the liver index of male ICR mice±s, n=8)
组别肝脏指数/% 21 d42 d80 d对照组5.90±0.796.42±0.505.03±0.43低剂量组5.70±0.875.80±0.355.48±0.52中剂量组5.33±0.44*5.32±0.58*5.14±0.26高剂量组5.32±0.46*6.53±0.61#&5.40±0.35
由表8可知,雄性子代小鼠在出生第21、42天时,染料木素中、高剂量组小鼠的肝脏指数与对照组相比有显著差异,但在第80天时这种差异消失。
由以上结果可知,长期膳食摄入染料木素可能对子代小鼠的肝脏指数的影响不明显。
2.2.2 肝脏组织形态观察
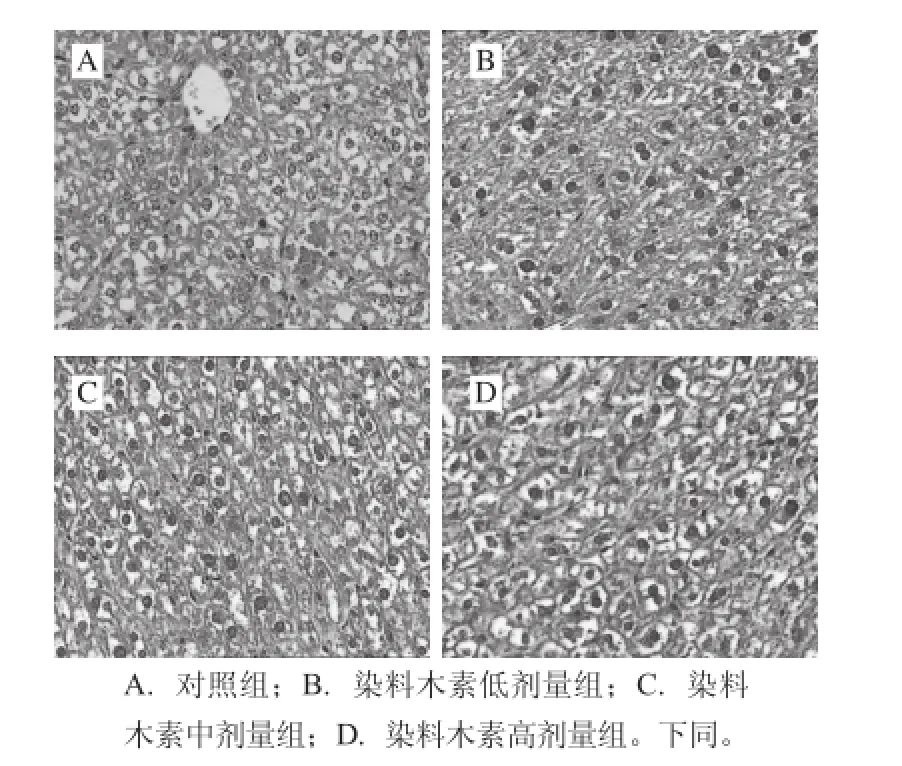
图1 80 d雌性子代小鼠肝脏组织形态学观察(HE,×400)Fig.1 Histomorphological observations of the livers of 80-day-old female mice from different groups (HE,×400)
如图1所示,对照组雌性子代小鼠肝细胞胞质浅染,细胞内可见大小不等、数量不一的脂滴空泡,有些肝细胞甚至被脂滴充满,肝脏发生了脂肪变性,可能是由于对照组小鼠灌胃的是溶剂玉米油,尽管是微量的,但长期作用也可能会使肝脏发生病变。染料木素低剂量组小鼠的肝细胞核深染,细胞界限模糊,肝脏发生脂肪变性且有肝硬化的趋势。染料木素中剂量组小鼠的肝细胞核深染,胞质有大量脂肪空泡,肝脏发生脂肪变性,肝硬化趋势不明显。染料木素高剂量组小鼠的肝细胞核深染,甚至有细胞坏死,细胞界限模糊,肝脏脂肪变性严重,有肝硬化的趋势。这说明长期膳食摄入染料木素可能会加重肝脏脂肪变性的程度,甚至引起肝硬化。

图2 80 d雄性子代小鼠鼠肝脏组织形态学观察(HE,×400)Fig.2 Histomorphological observationsof the livers of 80-day-old male mice from different groups (HE,×400)
如图2所示,对照组雄性子代小鼠的肝细胞胞质有脂肪空泡,细胞界限不清晰,肝脏发生脂肪变性,有肝硬化的趋势,雄性子代小鼠与雌性子代小鼠的差异可能是由于雄鼠体质量更大,日摄入溶剂玉米油的量也相应增多造成的。染料木素低剂量组小鼠的肝细胞界限模糊,甚至有细胞核消失的现象,肝脏有肝硬化的趋势且有细胞退变。染料木素中剂量组小鼠的肝细胞界限模糊,甚至有细胞核消失的现象,有肝硬化的趋势。染料木素高剂量组小鼠肝细胞肿胀、界限模糊,甚至有细胞核消失的现象,发生肝硬化。以上结果说明长期膳食摄入染料木素加重了肝脏脂肪变性的程度,甚至会引起肝硬化。
3 讨 论
染料木素是一种植物来源的雌激素,可以通过其雌激素样效应和弱雌激素效应调节机体的代谢。胆固醇主要在肝脏中合成[12],在血浆中以游离胆固醇或者胆固醇酯的形式存在,以低密度脂蛋白(low density lipoprotein,LDL)和高密度脂蛋白(high density lipoprotein,HDL)的形式在肝脏和肝外组织进行转运。TG由脂肪酸在肝脏合成,由极低密度脂蛋白转运到肝外组织中,以脂蛋白的形式进入血液循环,经脂蛋白脂酶的作用转变成能量[13]。LDL是由极低密度脂蛋白转变而来,主要功能是把胆固醇运输到全身各处细胞,以及运输到肝脏中合成胆酸[14]。LDL水平过高可导致动脉粥样硬化,增加机体患冠心病的风险[15]。血清TC、TG、LDL-C水平过高可能是动脉粥样硬化[16]、肝硬化等疾病的临床表现[17],因此降低血清TC、TG、LDL-C水平具有重要的意义。研究表明染料木素可以改善糖尿病[18]、高脂血症[19]、动脉粥样硬化[20]等模型大鼠的血脂异常。本实验通过对ICR子代小鼠自胎儿期开始进行长期膳食染料木素干预,发现其可以降低ICR子代小鼠血清中TC、TG、LDL-C水平,且这种效应在子代小鼠出生后的第42、80天更明显,说明降血脂效果与染料木素作用的时间长短也有关系。另外还发现,自胎儿期开始长期膳食摄入染料木素对子代小鼠血脂的影响还与子代小鼠的性别有关,染料木素对子代雄鼠具有较显著的降血脂作用,而对子代雌鼠的降血脂作用没有呈现出一定的规律性,其可能原因是雌鼠存在性周期,体内雌激素环境更为复杂,而雄鼠没有性周期的变化。实验还对比了自胎儿期开始长期膳食摄入不同剂量的染料木素对子代小鼠血脂含量的影响,发现接近人群摄入量的低、中、高剂量对子代小鼠的血脂水平具有一定的调节作用,但没有呈现一定的剂量依赖性。染料木素降血脂的机制可能是由于其作用于肝细胞的内质网,上调LDL受体表达,增加其活性,从而加速胆固醇的分解代谢和消除,并通过抑制胆固醇转化为胆汁酸的限速酶——胆固醇7α-羟化酶的活性而影响了胆固醇自身的稳定[21]。
肝脏是脂质代谢的重要器官,LDL在血浆中形成,负责将肝脏合成的内源性脂质转运至肝外组织[14],其浓度过低可能会导致肝脏相关疾病。前期研究发现,染料木素对肝脏具有保护作用,如染料木素可预防大鼠肝纤维化的形成[22],减轻小鼠急性肝损伤的症状[23]。也有研究发现,大豆异黄酮对肝脏的保护作用是大豆苷元在起作用而染料木素对其没有影响[24]。然而,最新研究发现,高剂量的植物雌激素对肝脏有损伤作用[25-27]。本实验结果显示自胎儿期开始长期膳食摄入染料木素可能会增加子代小鼠肝脏脂肪变性的风险,其可能原因是染料木素降低了血清中载脂蛋白B的含量[28]。Ozer等[29]研究发现组织学变化与血清指标呈负相关,这与本实验结果一致。
综上所述,自胎儿期开始长期膳食摄入染料木素可以降低ICR子代小鼠血清中TC、TG和LDL-C水平。与此同时,自胎儿期开始长期膳食摄入染料木素还可能通过降低血清中载脂蛋白B的含量[28-29],而影响肝内脂质的转运从而加重或导致子代小鼠肝脏脂肪变性。实验结果表明自胎儿期开始长期膳食摄入染料木素可能会增加子代小鼠肝脏脂肪变性的风险,但更为详尽的结论还需要进一步的实验数据支持。
[1] 张建梅, 李瓦里. 植物雌激素防治绝经后骨质疏松的研究进展[J].现代药物与临床, 2012, 27(1): 65-69.
[2] 孙纪元, 缪珊, 李纪鹏, 等. 染料木素对雌激素缺乏诱发的大鼠骨质疏松症的作用研究[J]. 中国药学杂志, 2009, 44(12): 900-904.
[3] 王晨, 曾俊杰. 植物雌激素防治绝经期女性冠心病研究进展[J]. 实用中医药杂志, 2011, 27(5): 350-352.
[4] 魏华波, 马海蓉, 王振华. 植物雌激素抗肿瘤作用机制研究进展[J].食品科学, 2011, 32(1): 274-277.
[5] 周雪明, 谢长生. 中药植物雌激素效应与乳腺癌关系的研究进展[J].肿瘤学杂志, 2011, 17(1): 63-66.
[6] 王欢, 杨海侠. 植物雌激素治疗围绝经期综合征研究进展[J]. 河北中医, 2012, 34(6): 940-942.
[7] 李娜, 邢萌萌, 李文娟, 等. 早期给予膳食槲皮素对大鼠母代生殖及其子代生长发育的影响[J]. 食品科学, 2012, 33(23): 297-300.
[8] 谢明勇, 胡晓鹃, 聂少平. 植物雌激素早期摄入对个体生殖发育的影响[J]. 中国食品学报, 2012, 12(7): 1-8.
[9] 杨克敌. 环境优生学[M]. 北京: 人民卫生出版社, 2007: 181-182.
[10] 高丽英. 食品中植物雌激素的含量分析及摄入量评估初探[D]. 南昌: 南昌大学, 2011: 46.
[11] DLUZEN D E, MCDERMOTT J L, LIU Binjun. Estrogen as a neuroprotectant against MPTP-induced neurotoxicity in C57/B1 mice[J]. Neurotoxicol Tenatol, 1996, 18(5): 603-605.
[12] 宋红梅, 魏珉, 朱传. 肾病综合征与高脂血症[J]. 中华儿科杂志, 1996, 34(5): 353-355.
[13] THABET M A E H, SALCEDO J R, CHAN J C M. Hyperlipidemia in childhood nephrotic syndrome[J]. Pediatric Nephrology, 1993, 7(5): 559-566.
[14] 张楚富. 生物化学原理[M]. 北京: 高等教育出版社, 2003: 400-440.
[15] 陶寿淇. 血脂与冠心病[J]. 中华心血管病杂志, 1997, 25(3): 234-236.
[16] 胡大一, 向小平. 动脉粥样硬化早期检测的临床应用: 大动脉僵硬度(弹性)和功能检查[J]. 中国心血管病研究杂志, 2007, 5(2): 81-82.
[17] 胡阳黔, 王子强. 肝硬化患者脂质代谢紊乱及其临床意义[J]. 临床消化病杂志, 2001, 13(5): 214-216.
[18] 杨维霞, 梁宗锁, 王四旺, 等. 染料木素对Ⅱ型糖尿病大鼠模型血糖和血脂的影响[J]. 西北农林科技大学学报: 自然科学版, 2009, 37(9): 1-6.
[19] 赵绿英, 刘玉玲, 李金兰, 等. 染料木素对大鼠食饵性高脂血症PON1及CRP的影响[J]. 中国药理学通报, 2012, 28(4): 567-572.
[20] 贺中民, 谢艳华, 杨倩, 等. 染料木素抗动脉粥样硬化实验研究[J].转化医学杂志, 2012, 1(3): 139-143.
[21] 柯晓安, 张舜, 王珊珊. 大豆异黄酮预防心血管疾病的研究进展[J].东南国防医药, 2009, 11(3): 235-237.
[22] 臧晶, 王继峰, 牛建昭, 等. 大豆异黄酮类成分对去卵巢大鼠脂质代谢的影响[J]. 中国药科大学学报, 2004, 35(3): 254-258.
[23] 余震, 李建芳, 张培趁, 等. 染料木索预防大鼠肝纤维化形成的实验研究[J]. 浙江医学, 2009, 31(4): 466-467.
[24] 李培恒, 王继峰, 牛建昭, 等. 染料木素和大豆苷元对去卵巢大鼠甘油三酯代谢的作用[J]. 中国药理学通报, 2004, 20(1): 72-75.
[25] SINGH P, SHARMA S, RATH S K. Genistein induces deleterious effects during its acute exposure in Swiss mice[J]. BioMed Research International, 2014: 619617. doi: 10.1155/2014/619617.
[26] SINGH P, MISHRA S K, NOEL S, et al. Acute exposure of apigenin induces hepatotoxicity in Swiss mice[J]. PLoS One, 2011, 7(2): e31964. doi: 10.1371/journal.pone.0031964.
[27] 高治平, 文玲, 刘代华, 等. 染料木素对小鼠急性肝损伤的保护作用[J].中华劳动卫生职业病杂志, 2008, 26(5): 294-295.
[28] BORRADAILE N, de DREU L, WILCOX L, et al. Soya phytoestrogens, genistein and daidzein, decrease apolipoprotein B secretion from HepG2 cells through multiple mechanisms[J]. Biochemical Journal, 2002, 366: 531-539.
[29] OZER J, RATNER M, SHAW M, et al. The current state of serum biomarkers of hepatotoxicity[J]. Toxicology, 2008, 245(3): 194-205.
Effects of Dietary Genistein on Serum Lipid and Liver of ICR Mice
LIU Dan-feng, NIE Shao-ping*, LIU Xin, LI Wen-juan, HU Xiao-juan, SHUAI Xiao-xue
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In order to study the effects of long-term dietary intake of genistein which starts from maternal mice on the blood lipids and liver of female and male offspring, maternal mice were orally adminstered with 0, 5, 25 and 50 mg/(kg·d) of genistein, and the administrations were conducted on the offspring instead of the mother mice after birth. On the 21st, 42ndand 80thdays after birth, the contents of serum triglycerides (TG), total cholesterol (TC), low-density lipoprotein cholesterol (LDL-C) of the female and male offspring were detected, and liver morphology were observed by hematoxylin-eosin (HE) stained section. The results showed that long-term dietary genistein intake signif cantly reduced the serum levels of TC, TG and LDL-C of the offspring mice and serum LDL-C was decreased more signif cantly in the male offspring. HE staining showed that liver steatosis could be more serious and potentially be developed into cirrhosis in response to genistein intake.
genistein; ICR mice; serum lipid; liver; hematoxylin-eosin (HE) staining
Q946.8
A
1002-6630(2014)23-0292-05
10.7506/spkx1002-6630-201423057
2014-06-27
中德科学基金研究交流中心国际合作项目(GZ731)
刘丹凤(1989—),女,硕士研究生,研究方向为食品质量与安全。E-mail:374072156@qq.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品营养与安全、糖化学与糖生物学。E-mail:spnie@ncu.edu.cn

