葡萄糖、果糖和蔗糖/脯氨酸的共裂解行为研究
罗昌荣,谢 焰,印黔黔,黄 伟,李炎强,刘百战
1.上海牡丹香精香料有限公司,上海市孙桥路1067号 201200
2.上海烟草集团有限责任公司技术中心,上海市长阳路717号 200082
3.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
卷烟中糖类物质的含量、组成及糖类物质之间的相对比例对卷烟感官品质具有非常重要的影响。因此,研究卷烟产品中糖类物质及其组成比例在卷烟燃吸过程中的行为变化具有重要意义。目前国内外已有研究大多是采用裂解的方法对各种类型的烟草样品或烟叶组分进行裂解行为研究[1-6],以模拟其在燃吸时的裂解行为和机理,但关于烟草组分之间的共裂解研究则鲜见报道。由于烟草是一个非常复杂的体系,一种组分的裂解行为可能会受到其他化学组分的影响,从而表现出与其单独裂解时不一样的裂解行为。烟叶中的糖类物质即是如此,在卷烟燃烧过程中,其裂解产物的种类、相对比例可能会受到卷烟产品中其他组分的影响,比如,卷烟产品中的蛋白质、氨基酸、有机酸等。氨基酸是烟叶中的重要组分之一,对卷烟香气的形成和风格具有非常重要的影响。脯氨酸是烤烟型烟叶和卷烟中一种非常重要的氨基酸,约占游离氨基酸含量的40%左右,而且其与烟叶中的葡萄糖形成的1-脱氧-1-(L-脯氨酸基)-D-果糖,约占烤烟烟叶干重的1.5%~2.0%[7]。因此,对葡萄糖、果糖和蔗糖与脯氨酸的共裂解行为进行了研究,旨在考察其共裂解产物的变化规律,为烟气成分的形成机理及其对卷烟感官品质的影响研究提供理论参考。
1 材料与方法
1.1 材料、试剂和仪器
D-(+)-葡萄糖(99%)、D-(-)-果糖(98%,比利时Acros 公司);D-(+)-蔗糖(99.9%,百灵威科技有限公司);L-脯氨酸(99%,美国Sigma-Aldrich 公司);石英棉(农残级,美国CDS Analytical 公司)。
CDS2000 热裂解仪(美国CDS Analytical 公司);Agilent 6890-5973 气相色谱-质谱联用仪(GC/MS,美国Agilent 公司);XP603S 电子分析天平(感量:0.00001 g,瑞士Mettler Toledo 公司);CIS4 程序升温进样器及C506控制器(德国Gerstel 公司);Milli-Q Advantage A10 超纯水仪(美国Millipore 公司)。
1.2 方法
1.2.1 样品配制
(1)葡萄糖、果糖和蔗糖溶液配制。准确称取1 g 葡萄糖、果糖或蔗糖,分别用5 mL 超纯水溶解后转移至10 mL 容量瓶中,用超纯水定容至10 mL,即得到浓度为100 mg/mL 的葡萄糖、果糖和蔗糖溶液。
(2)脯氨酸溶液配制。准确称取0.1 g 的脯氨酸,用5 mL 超纯水溶解后转移至10 mL 容量瓶中,用超纯水定容,即得到浓度为10 mg/mL 的脯氨酸溶液。
(3)葡萄糖、果糖、蔗糖与脯氨酸(5∶1或10∶1)共裂解溶液配制。准确称取0.5 或1.0 g 的葡萄糖和0.1 g 的脯氨酸,用5 mL 超纯水溶解后转移至10 mL 容量瓶中,用超纯水定容,即得到浓度为50 或100 mg/mL 葡萄糖+10 mg/mL 脯氨酸的溶液。采用上述的方法配制果糖/脯氨酸和蔗糖/脯氨酸的共裂解溶液。
(4)混合糖Ⅰ,Ⅱ与脯氨酸共裂解溶液的配制。首先分别准确称取5 g葡萄糖、5 g果糖、1 或2g蔗糖放入研钵中,反复研磨,得混合糖Ⅰ(葡萄糖∶果糖∶蔗糖=5∶5∶1)和混合糖Ⅱ(葡萄糖∶果糖∶蔗糖=5∶5∶2)。然后分别称取0.5或1 g混合糖Ⅰ(或混合糖Ⅱ)和0.1 g的脯氨酸,用5 mL 超纯水溶解后转移至10mL 容量瓶中,用超纯水定容至10mL。所得溶液为50或100mg/mL 混合糖Ⅰ+10mg/mL 脯氨酸(或50或100mg/mL 混合糖Ⅱ+脯氨酸10mg/mL)。
1.2.2 样品裂解[8]
进样方式和进样量:取裂解管,装填石英棉,并压实至2mm,固定于裂解管中央位置。在900℃下烘30 min后,冷却备用。对样品进行裂解时,使用10μL 进样针取试样2μL 置于裂解管中的石英棉上,然后用镊子将裂解管放入裂解仪铂丝圈上进行裂解。裂解和G C/MS条件分别为:
色谱柱:DB-5MS 弹性毛细管柱(30m×0.25 mm×0.25 μm);载气流量:1.0mL/min;分流比:100∶1;升温程序:40℃;质谱传输线温度:280℃;离子源温度:230℃;四极杆温度:150℃;电离方式:电子轰击电离(EI);电子能量:70eV;质量扫描范围:29~450amu;溶剂延迟时间:5.4 min。
采用RTE 积分方式,对峰面积大于最大峰峰面积0.1%的热裂解产物予以积分,并应用质谱谱库进行检索定性,采用峰面积归一化法计算产物相对含量,以两次平行测定的平均值为测定结果。
2 结果与讨论
2.1 葡萄糖、果糖和蔗糖的单独裂解产物
碳水化合物裂解过程中形成的产物有主要有3 类:一部分为可冷凝的化合物,一部分为不容易冷凝的气体,剩下的为裂解形成的碳。葡萄糖、果糖和蔗糖单独裂解时的主要挥发性化合物如表1 所示。由表1 可知,在模拟卷烟燃烧条件下,葡萄糖、果糖和蔗糖裂解形成的挥发性化合物的种类基本一致,但是挥发性化合物的生成量和各裂解产物之间的相对含量存在较大的差异。果糖裂解形成的总挥发性化合物量最大,蔗糖次之,葡萄糖最少。由此可以推断,葡萄糖裂解形成的碳量可能会比较大,形成碳量最少的可能为果糖。Ponder等[9]通过对蔗糖和葡萄糖的真空裂解研究发现蔗糖裂解形成的焦油量要大于葡萄糖,与本研究的结果基本一致。

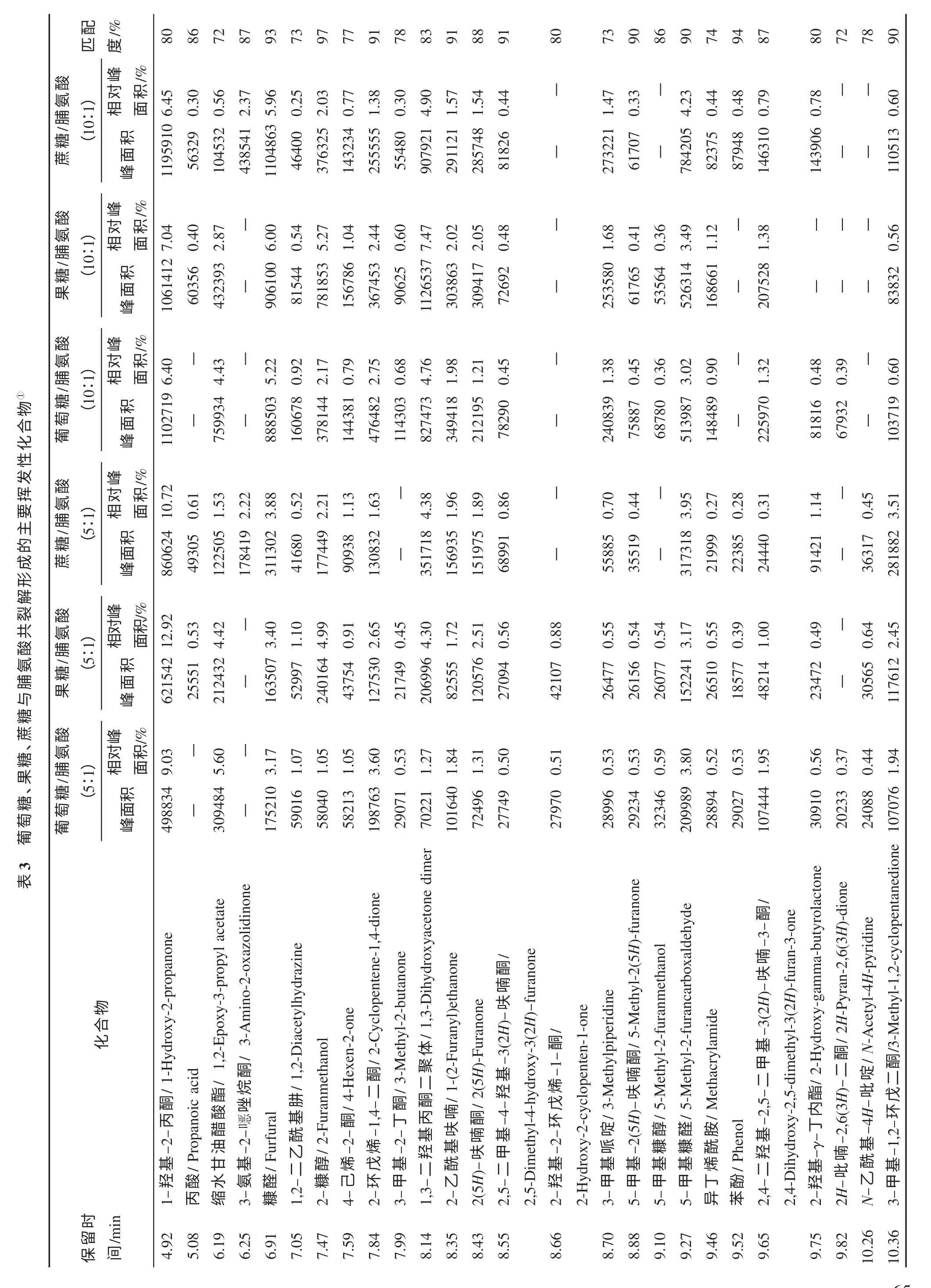
表1 葡萄糖、果糖和蔗糖单独裂解形成的主要挥发性化合物①
葡萄糖、果糖和蔗糖在裂解时,主要裂解产物是5-羟甲基糠醛、糠醛、2,5-呋喃二甲醛、5-甲基糠醛以及一些脱水糖类物质。5-羟甲基糠醛是3 种糖裂解形成的最主要的裂解产物,其次为糠醛,这与Sanders[10]和Huyghues-Despointes[11]等的结论一致。果糖、蔗糖和葡萄糖3 种糖裂解形成的5-羟甲基糠醛分别占3 种糖裂解所形成挥发性化合物总量的38.39%,37.44% 和28.92%。与5-羟甲基糠醛相似,糠醛的形成也遵循同样的规律,果糖裂解形成的糠醛量最大(35.47%),蔗糖次之(27.51%),而葡萄糖裂解产生的糠醛量最少(18.38%)。
葡萄糖、果糖和蔗糖在裂解过程中也形成了一些脱水糖类物质,比如左旋葡聚糖(Levoglucosan)和1,4:3,6-二脱水-α-D-吡喃葡萄糖。这些脱水糖类物质是在裂解过程中通过发生分子内部脱水反应而形成的。Nagodawithana 认为[12],糖类裂解时,在相对较低的温度下(200~250 ℃),首先会形成脱水糖类物质,然后这些脱水糖类物质在高温下会进一步裂解形成各种挥发性化合物。由表1 可知,葡萄糖裂解时产生的左旋葡聚糖达到了20.08%,说明在实验裂解条件下,葡萄糖裂解形成的脱水糖类物质未充分裂解,因此,未能产生更多的挥发性化合物,这与其裂解时形成的挥发性化合物产生量较少有直接的关系。果糖在裂解时形成的脱水糖类物质含量较低,说明果糖裂解产生的脱水糖类物质得到了较充分的进一步裂解,形成了较多的挥发性有机化合物,而蔗糖裂解形成的挥发性化合物的量介于二者之间。果糖裂解形成的左旋葡聚糖含量非常低,占其所产生的挥发性化合物的0.43%,而且其裂解形成的其他脱水糖类物质的量也非常少,比如,1,4:3,6-二脱水-α-D-吡喃葡萄糖只占挥发性化合物的0.49%,而1,6-脱水-β-D-呋喃葡萄糖则未能检测到,这与Moldoveanu[13]的观点一致。
2.2 脯氨酸的裂解产物[14]
脯氨酸单独裂解形成的主要挥发性化合物如表2所示。从表2 中可以看出,脯氨酸裂解时,其主要产物是环(L-脯氨酸基-L-脯氨酸基)——由两个脯氨酸形成的哌嗪二酮,占挥发性裂解产物的88.61%。这与文献研究报道的结果相一致[15],氨基酸在裂解过程中形成的主要产物为哌嗪二酮,混合氨基酸裂解形成的产物为两个氨基酸相复合的哌嗪二酮,单一氨基酸裂解的产物为两分子氨基酸自身形成的哌嗪二酮。
2.3 葡萄糖、果糖和蔗糖与脯氨酸的共裂解产物
为考察葡萄糖、果糖、蔗糖和脯氨酸分别混合后共裂解与单独裂解时裂解行为的变化及混合比例对裂解产物的影响,将葡萄糖、果糖、蔗糖与脯氨酸分别以5∶1和10∶1 比例混合后进行共裂解,其裂解产生的主要挥发性化合物如表3 所示。由表3 可知,葡萄糖、果糖、蔗糖与脯氨酸共裂解时形成的挥发性化合物与它们单独裂解时所形成的产物相比具有很大的变化。在共裂解时,脯氨酸单独裂解时所产生的主要产物环(L-脯氨酸基-L-脯氨酸基)已经基本不存在,挥发性化合物的总生成量迅速增加,但是一些主要化合物的生成量则有了很大程度的下降,比如,5-羟甲基糠醛、糠醛和左旋葡聚糖。葡萄糖、果糖、蔗糖与脯氨酸在5∶1 和10∶1 两种混合比例下共裂解时,5-羟甲基糠醛的生成量约为3种糖单独裂解时所形成的5-羟甲基糠醛的3.4%,6.0%,20.3%和35.5%,30.0%,81.3%,分别占共裂解时所形成的挥发性 化合物总量的2.85%,10.73%,16.92% 和9.66%,17.01%,29.21%。
对于糠醛而言,与单独裂解相比较,葡萄糖、果糖和蔗糖3 种糖与脯氨酸以5∶1 比例混合后共裂解所形成的糠醛量约为3 种糖单独裂解时糠醛生成量的5.9%,2.0%和6.3%,而且糠醛占总挥发性化合物的比例也有明显下降,分别从单独裂解时的18.38%,35.47%和27.51%下降到共裂解时的3.17%,3.40%和3.88%。但是,当3 种糖分别与脯氨酸以10∶1 比例混合后共裂解时,糠醛的生成量有了较明显的增加,约为3 种糖单独裂解时糠醛生成量的29.9%,11.3%和22.5%。这与各种糖单独裂解时的情况明显不同,3 种糖在单独裂解时,果糖裂解所形成的糠醛量最大,而共裂解时蔗糖/脯氨酸所产生的糠醛量最大。这说明在共裂解时,蔗糖比葡萄糖和果糖更有利于糠醛的形成或累积。此外,当葡萄糖、果糖、蔗糖与脯氨酸的混合比例为10∶1 时,共裂解时所形成的糠醛占总挥发性化合物的相对比例也明显降低,分别从单独裂解时的18.38%,35.47%和27.51%下降到共裂解时的5.22%,6.00%和5.96%。
从表1~表3 可以看出,与3 种糖的单独裂解相比较,葡萄糖、果糖、蔗糖与脯氨酸共裂解会导致左旋葡聚糖生成量的下降,这可能是由于脯氨酸的存在导致了左旋葡聚糖的降解或反应,也有可能是由于在脯氨酸存在时,糖的裂解路径发生了变化,而形成左旋葡聚糖的路径不具有竞争力,从而导致其含量下降。葡萄糖、果糖和蔗糖单独裂解时,左旋葡聚糖的相对含量分别为20.09%,0.98%和8.49%。与脯氨酸在5∶1 和10∶1 两种混合比例下共裂解时,左旋葡聚糖的相对含量分别为0.60%,1.24%,1.64%和2.11%,1.31%,2.20%,约为3 种糖单独裂解时所形成的左旋葡聚糖的1.0%,27.1%,8.7%和11.5%,90.6%,26.9%。
2,3-二 氢-3,5-二羟基-6-甲 基-4H-吡 喃-4-酮(DDMP)是一种具有很强甜感的香味物质,可以增加烟气的甜感。由表1~表3 可知,与5-羟甲基糠醛、糠醛和左旋葡聚糖不同的是,3 种糖分别与脯氨酸共裂解时,DDMP 占总挥发性化合物的相对比例比单独裂解时有明显的增加,尤其是葡萄糖。3 种糖与脯氨酸在5∶1 和10∶1 两种混合比例下共裂解时,生成的DDMP 占总挥发性化合物的比例分别为21.03%,4.24%,1.30%和9.21%,5.21%,1.73%,而在3 种糖单独裂解时,其所占比例仅为0.72%,1.29%和0.85%。然而,对于DDMP 的绝对生成量而言,3 种糖存在较大的差异,当糖与脯氨酸的比例为5∶1 时,葡萄糖/脯氨酸共裂解时DDMP 的生成量是葡萄糖单独裂解DDMP 生成量的10 倍。但是,果糖和蔗糖与葡萄糖的情况明显不同,二者和脯氨酸共裂解时所形成的DDMP 的绝对量有一定程度的下降,果糖/脯氨酸共裂解时所形成的DDMP 约为果糖单独裂解时的70%,蔗糖与脯氨酸共裂解时所形成的DDMP 约为其单独裂解时的68.9%。当糖与脯氨酸的比例为10∶1 时,葡萄糖/脯氨酸共裂解形成的DDMP 约为葡萄糖单独裂解时的13.65 倍。果糖和蔗糖与脯氨酸共裂解时所形成的DDMP 分别比它们单独裂解时增加了171%和111%。

表2 脯氨酸裂解形成的主要挥发性化合物①
?

?
综上所述,脯氨酸的存在,改变了3 种糖的裂解行为,进而改变了其裂解所形成的挥发性化合物组成,但是对3 种糖的影响情况又各不相同。对于葡萄糖而言,脯氨酸的存在,有利于其裂解形成更多的DDMP,一方面大幅增加了DDMP 的绝对生成量,同时又明显提高了DDMP 在裂解所形成的挥发性化合物中的相对含量。对果糖和蔗糖而言,脯氨酸的存在,也有利于提高DDMP 在其裂解所形成的挥发性化合物中的相对含量,但是,当果糖和蔗糖与脯氨酸的比例为5∶1 时,果糖和蔗糖裂解所形成的DDMP 的绝对量约减少30%,但当果糖和蔗糖与脯氨酸的比例为10∶1 时,二者裂解形成的DDMP 的绝对量会迅速增加。
2.4 混合糖与脯氨酸的共裂解产物
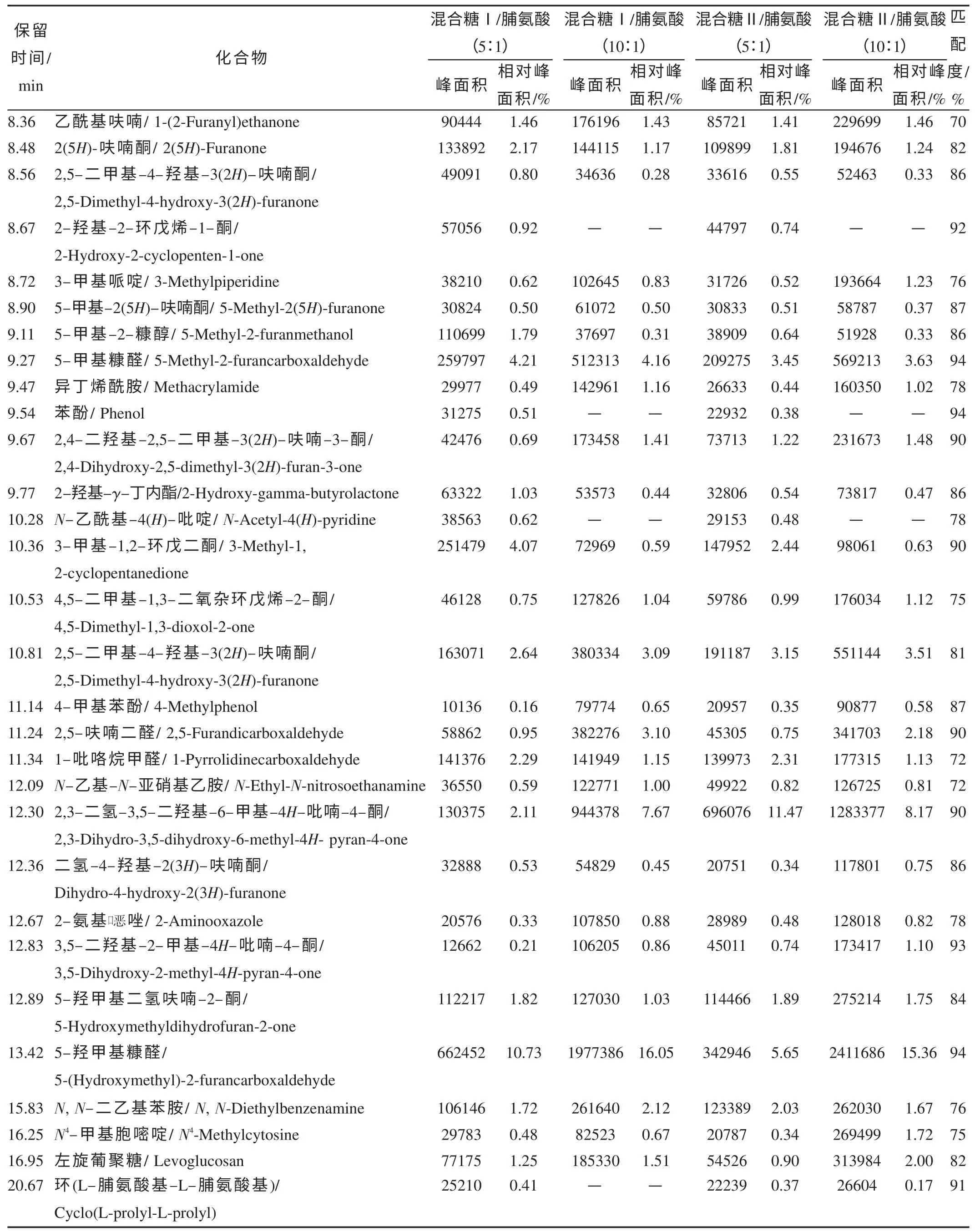
葡萄糖、果糖和蔗糖不是单独地、而是以一定的比例存在于烟叶中,而且即使是同一品种烟叶,产地、气候条件、栽培习惯和调制方式也会影响烟叶中的糖类组成。烟叶中的还原糖和蔗糖的比例约为5∶1~10∶1;还原糖中的葡萄糖和果糖的比例约为1∶1。因此,将葡萄糖、果糖和蔗糖以一定的比例组成混合糖Ⅰ和混合糖Ⅱ,其比例分别为葡萄糖∶果糖∶蔗糖=5∶5∶1 和葡萄糖∶果糖∶蔗糖=5∶5∶2,以模拟烟叶中的糖类组成,从而通过采用裂解技术来模拟研究卷烟抽吸过程中葡萄糖、果糖和蔗糖的行为变化,结果如图1 和表4 所示。由图1 可知,当混合糖与脯氨酸的比例相对较高时,其裂解产物的总离子流图比较相似,而在当混合糖与脯氨酸的比例相对较低时,其裂解产物的总离子流图存在较大差异,说明脯氨酸相对含量高时,对糖类物质的裂解影响会较大,这也可以从表4 中的挥发性化合物的相对比例得到验证。从表4 可以看出,混合糖的组成(葡萄糖、果糖和蔗糖的相对比例)对5-羟甲基糠醛、糠醛、2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮和左旋葡聚糖等主要裂解产物的生成量也有一定的影响。

图1 混合糖与脯氨酸共裂解产物的总离子流图

表4 混合糖与脯氨酸共裂解形成的主要挥发性化合物①
(续表4)
3 结论
(1)单独裂解时,葡萄糖、果糖和蔗糖的主要裂解产物是5-羟甲基糠醛和糠醛。果糖裂解产生的5-羟甲基糠醛和糠醛最多,蔗糖次之,葡萄糖最少。5-羟甲基糠醛分别占3 种糖裂解所形成挥发性化合物的38.39%,37.44%和28.92%,糠醛分别占3 种糖裂解所形成挥发性化合物的35.47%,27.51%和18.38%。
(2)脯氨酸的存在改变了葡萄糖、果糖、蔗糖的单独裂解行为。5-羟甲基糠醛、糠醛和左旋葡聚糖的生成量则显著降低。在糖与脯氨酸的比例为5∶1 时,共裂解所形成的5-羟甲基糠醛量约为单独裂解时的3.4%,6.0%和20.3%,糠醛为单独裂解时的5.9%,2.0%和6.3%,左旋葡聚糖为1.0%,27.1%和8.7%;而当糖与脯氨酸的比例为10∶1 时,葡萄糖、果糖和蔗糖与脯氨酸共裂解所形成的5-羟甲基糠醛约为单独裂解时的35.5%,30.0%和81.3%,糠醛为29.9%,11.3%和22.5%,左旋葡聚糖为11.5%,90.6%和26.9%。
(3)混合糖的组成以及混合糖与脯氨酸的比例对裂解产物的形成也有明显的影响。当脯氨酸的含量相对高时,对糖类物质的裂解影响会更大。
[1]Evans R J,Wang D,Agblevor F A,et al.Mass spectrometric studies of the thermal decomposition of carbohydrates using13C-labeled cellulose and glucose[J].Carbohydrate Research,1996,281(2):219-235.
[2]董宁宁.碳水化合物的热裂解气相色谱-质谱研究[J].质谱学报,2004,25(1):24-28.
[3]王洪波,郭军伟,夏巧玲,等.部分国产烟草样品的热重分析[J].烟草科技,2009(9):47-49.
[4]夏鸣,李金广,乔国宝,等.烤烟的燃烧特性及动力学[J].烟草科技,2012(11):38-41,50.
[5]曹得坡,夏巧玲,郭吉兆,等.卷烟燃吸模拟装置的设计与应用[J].烟草科技,2013(3):54-60.
[6]Baliga V,Sharma R,Miser D,et al.Physical characterization of pyrolyzed tobacco and tobacco components[J].Journal of Analytical and Applied Pyrolysis,2003,66(1/2):191-215.
[7]Leffingwell J C.Chemical constituents of tobacco leaf and differences among tobacco types [J].Leffingwell Reports,2001,1(2):1-56.
[8]Baker R R,Bishop L J.The pyrolysis of tobacco ingredients[J].Journal of Analytical and Applied Pyrolysis,2004,71(1):223-311.
[9]Ponder G R,Richards G N.Pyrolysis of inulin,glucose,and fructose[J].Carbohydrate Research,1993,244(2):341-359.
[10]Sanders E B,Goldsmith A I,Seeman J I.A model that distinguishes the pyrolysis of D-glucose,D-fructose,and sucrose from that of cellulose.Application to the understanding of cigarette smoke formation[J].Journal of Analytical and Applied Pyrolysis,2003,66(1/2):29-50.
[11]Huyghues-Despointes A,Yaylayan V A,Keyhani A.Pyrolysis/GC/MS analysis of 1-[(-carboxy)pyrrolidinyl]-1-deoxy-D-fructose(proline Amadori compound)[J].Journal of Agricultural and Food Chemistry,1994,42(11):2519-2524.
[12]Nagodawithana T W.Savory flavors[M].Milwaukee:Esteekay Associates,Inc.,1995:129-136.
[13]Moldoveanu S C.Analytical pyrolysis of natural organic polymers[M].Amsterdam:Elsevier Science B.V.,1998:220-229.
[14]罗昌荣,谢焰,印黔黔,等.木糖/脯氨酸共裂解过程挥发性化合物形成规律[J].食品与机械,2013,29(2):1-7.
[15]Moens L,Evans R J,Looker M J,et al.A comparison of the Maillard reactivity of proline to other amino acids using pyrolysis-molecular beam mass spectrometry[J].Fuel,2004,83(11/12):1433-1443.

