食管鳞癌组织中miR-148a的表达及其临床意义
李树海 田辉 岳韦名 李林 高存 司立博 胡文思 亓磊 鲁铭 崔京京 陈观卿
食管鳞状细胞癌(esophageal squamous cell cancer,ESCC)是最常见的消化系统恶性肿瘤之一[1]。由于疾病进展、局部复发、远处转移、化疗抵抗等因素,ESCC患者的总体5年生存率仍未得到根本性提高,为10%~40%[2-3]。临床上,患者预后判定和治疗策略的制定主要是根据疾病的病理分期,但即使术后处于同一病理分期的患者,其预后也往往存在着较明显的差异,因此,仅仅依据病理分期来预测患者的预后并制定相应治疗措施的针对性较差[4-5]。随着肿瘤分子生物学研究的不断进展,ESCC的分子预后研究愈加受到重视,发现能够有效预测ESCC进展及患者预后的新分子标志物,结合传统病理分期对术后高危患者进行筛选,优化ESCC患者的个体化治疗,是ESCC治疗的方向之一[6]。
MicroRNA(miRNA)近年来成为生命科学研究领域中的明星分子,是仅有19~25个核苷酸的内源性非编码小分子RNA[7-9]。已有的研究表明:异常表达的miRNA广泛参与人类恶性肿瘤的发生、发展、侵袭、转移及耐药等演进过程[10-12]。miR-148a作为miRNA家族中的一员,是一种高度保守的miRNA,其前体序列定位于人类7号染色体短臂的1区5带[13]。miR-148a主要发挥抑癌基因样作用,抑制恶性肿瘤细胞的迁移、侵袭并促进细胞凋亡,从而逆转肿瘤细胞的恶性表型,越来越受到研究者的重视[14-17]。miR-148a在人类多种恶性肿瘤组织中表达降低,然而,有关ESCC组织中miR-148a的表达及其与患者临床病理指标及预后的相关性,目前国内尚未见相关的研究报道。
本研究采用实时荧光定量PCR(Real-time PCR)法检测ESCC组织中miR-148a的表达水平,并结合患者的临床病理资料和术后随访资料进行相关的统计分析,研究miR-148a表达与患者临床病理指标及预后的相关性,探讨miR-148a在ESCC进展及预后判定中的作用和临床意义。
资料与方法
一、 临床资料
本研究选取2009年1至12月在山东大学齐鲁医院胸外科行食管癌手术治疗的患者,患者纳入标准:(1)行食管癌切除、胃食管吻合及系统性淋巴结清扫术[18];(2)术前的相关辅助检查未发现远处转移病灶;(3)临床病理资料及随访资料均完整;(4)术前未接受放疗或化疗。患者排除标准:①术前行放疗或化疗;②随访资料不完整;③围手术期死亡;④行姑息性切除。共有75例患者符合上述纳入标准,其中男性56例,女性19例;年龄39~75岁。
ESCC的诊断标准参照世界卫生组织2000年的消化道肿瘤组织学分类标准[19],术后病理分期参照国际抗癌联盟2002年的TNM分期标准[20]。
二、 Real-time PCR法检测miR-148a的表达
在八联管中配制以下反应体系(20 μl):模板cDNA 2 μl、SYBR Green反应液10 μl、去离子水6 μl、上游引物1 μl、下游引物1 μl。使用ABI7500 PCR反应仪进行反应,测定miRNA的表达。miR-148a表达水平的检测以U6作为内参照,采用2-ΔΔCt方法计算miR-148a的相对表达量。相对表达量高于测定的平均值定义为miR-148a高表达;相对表达量低于测定的平均值定义为miR-148a低表达。
三、 随访
所有患者均顺利出院,每隔3~6个月随访1次。随访内容包括体格检查、钡餐、化验分析、CT、超声以及必要时行胃镜检查等。记录从手术之日起至患者死亡或随访截止日的时间,计算总生存率。本研究的随访截止时间为2012年12月,中位随访时间为38个月(8~47个月)。
四、 统计学方法
应用SPSS 18.0软件进行统计学分析,将患者的临床病理资料、随访资料及实验数据共同建立数据库。χ2检验比较miR-148a表达与患者临床病理指标之间的关系;Kaplan-Meier法绘制患者的生存曲线;Log-rank检验比较患者的生存差别;Cox多因素回归分析判定独立的预后因素。P<0.05为差异有统计学意义。
结 果
一、 miR-148a表达与患者临床病理指标间的关系
42.7%(32/75)的患者肿瘤组织中检测到miR-148a低表达,χ2检验结果显示miR-148a低表达与肿瘤的浸润深度(T120.0%、T228.0%、T357.5%,χ2=8.149,P=0.017)、淋巴结转移(N030.6%、N153.8%,χ2=4.151,P=0.042)和病理分期(Ⅰ期22.2%、Ⅱ期34.2%、Ⅲ期60.7%,χ2=6.474,P=0.039)显著相关,而与患者的性别(χ2=0.230,P=0.632)、年龄(χ2=0.020,P=0.888)、肿瘤直径(χ2=0.523,P=0.770)及肿瘤分化程度(χ2=0.461,P=0.794)均无显著的相关性(表1)。
二、 单因素和多因素生存分析
75例患者术后3年的总生存率为70.7%(53/75)。单因素生存分析结果显示:肿瘤浸润深度(T1100.0%、T292.0%和T350.0%,χ2=18.288,P<0.001)、淋巴结转移(N091.7%和N151.3%,χ2=14.285,P<0.001)及miR-148a低表达(低表达53.1%和高表达83.7%,χ2=9.136,P=0.003)(图1)均与患者的不良预后显著相关。Cox多因素回归分析结果显示:浸润深度(95%CI为1.015~2.799,P=0.044)和淋巴结转移(95%CI为1.285~4.796,P=0.007)分别是判定患者术后3年总生存率的独立预后因素(表2)。
讨 论
miR-148a作为一种重要的抑癌基因,通过对靶基因的调控来抑制恶性肿瘤细胞的增殖、侵袭、转移及耐药等多种恶性表型,它在人类多种恶性肿瘤(结直肠癌、肝癌、胃癌、胰腺癌、乳腺癌、卵巢癌等)中的表达水平是下降的,并与肿瘤进展及患者不良预后密切相关,已成为研究的热点分子之一,有可能成为指导恶性肿瘤患者临床个体化治疗及预后判定的一个有效标志物[13,17,21-26]。本研究首次检测了ESCC组织中miR-148a的表达水平,并探讨其与患者临床病理指标及预后的相关性。
本研究结果显示:miR-148a在ESCC组织中存在异常低表达,并与肿瘤的浸润深度、淋巴结转移及病理分期显著相关,提示miR-148a可能在ESCC的进展过程中发挥了重要的调控作用。miR-148a表达的降低使ESCC细胞获得更具侵袭性的表型,促进ESCC的侵袭和进展,miR-148a有可能成为潜在的抗ESCC进展治疗的新靶点。然而,恶性肿瘤的侵袭转移是一个极其复杂的动态过程,涉及多种基因、细胞,并受多因子不同层次的调控,miR-148a调控ESCC进展的具体机制还需在分子水平上进行更加深入的研究和探讨。
生存分析结果显示,miR-148a低表达患者的术后3年总生存率显著低于miR-148a高表达患者,表明miR-148a有可能成为ESCC患者术后预后判定的潜在预测指标。然而,Cox回归多因素分析的结果却显示肿瘤浸润深度及淋巴结转移分别是判定患者术后3年总生存率的独立预后因素。本研究中可能由于纳入的患者例数太少、随访时间过短及术后不同的辅助治疗方案等,存在一定的偏倚,导致miR-148a在ESCC预后判定中的价值未得到客观及充分的体现。
总之,本研究首次探讨了ESCC组织中miR-148a表达与患者临床病理指标及预后之间的相关性,结果表明miR-148a在ESCC组织中存在异常低表达,并与肿瘤进展及患者不良预后密切相关,提示miR-148a不仅可以作为一个判定ESCC进展及患者预后的潜在参考指标,并且有可能成为一个有效的抗ESCC治疗的新靶点。
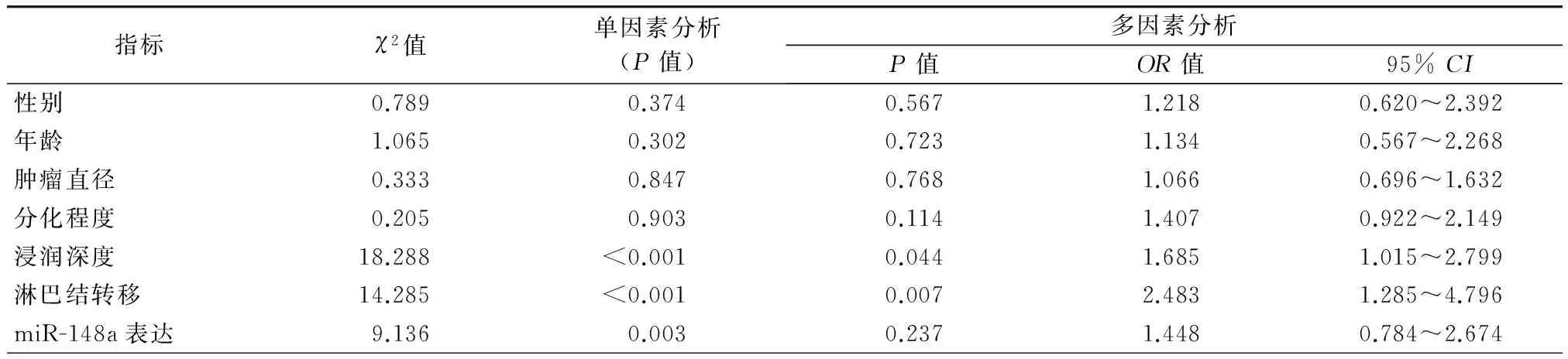
表2 食管癌患者术后单因素和多因素生存分析
1Sano A, Kato H, Sakurai S, et al. CD24 expression is a novel prognostic factor in esophageal squamous cell carcinoma[J]. Ann Surg Oncol, 2009,16(2):506-514.
2Ren Y, Cao B, Law S, et al. Hepatocyte growth factor promotes cancer cell migration and angiogenic factors expression: a prognostic marker of human esophageal squamous cell carcinomas[J]. Clin Cancer Res, 2005,11(17):6190-6197.
3Mariette C, Balon JM, Piessen G, et al. Pattern of recurrence following complete resection of esophageal carcinoma and factors predictive of recurrent disease[J]. Cancer, 2003,97(7):1616-1623.
4Law S, Kwong DL, Kwok KF, et al. Improvement in treatment results and long-term survival of patients with esophageal cancer: impact of chemoradiation and change in treatment strategy[J]. Ann Surg, 2003,238(3):339-347.
5Okawa T, Naomoto Y, Nobuhisa T, et al. Heparanase is involved in angiogenesis in esophageal cancer through induction of cyclooxygenase-2[J]. Clin Cancer Res, 2005;11(22):7995-8005.
6Shih CH, Ozawa S, Ando N, et al. Vascular endothelial growth factor expression predicts outcome and lymph node metastasis in squamous cell carcinoma of the esophagus[J]. Clin Cancer Res, 2000;6(3):1161-1168.
7Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004,116(2):281-297.
8Lim LP, Lau NC, Garrett-Engele P, et al. Microarray analysis shows that some microRNAs down regulate large numbers of target mRNAs[J]. Nature, 2005,433(7027):769-773.
9Dykxhoorn DM. MicroRNAs and metastasis: little RNAs go a long way[J]. Cancer Res, 2010,70(16):6401-6406.
10 Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006,6(11):857-866.
11 Lovat F, Valeri N, Croce CM. Micro-RNAs in the pathogenesis of cancer[J]. Semin Oncol, 2011,38(6):724-733.
12 Chen PS, Su JL, Hung MC. Dysregulation of microRNAs in cancer[J]. J Biomed Sci, 2012,19:90.
13 贾筱琴,缪俊俊,雍军,等.miR-148a对肝癌细胞株侵袭和迁移的抑制作用及机制[J].中国癌症杂志,2014,24(6):412-417.
14 Chen Y, Song Y, Wang Z, et al. Altered expression of MiR-148a and MiR-152 in gastrointestinal cancers and its clinical significance[J]. J Gastrointest Surg, 2010,14(7):1170-1179.
15 Hummel R, Watson DI, Smith C, et al. Mir-148a improves response to chemotherapy in sensitive and resis-tant oesophageal adenocarcinoma and squamous cell carcinoma cells[J]. J Gastrointest Surg, 2011,15(3):429-438.
16 Zhang H, Li Y, Huang Q, et al. MiR-148a promotes apoptosis by targeting Bcl-2 in colorectal cancer[J]. Cell Death Differ, 2011,18(11):1702-1710.
17 Takahashi M, Cuatrecasas M, Balaguer F, et al. The clinical significance of MiR-148a as a predictive biomarker in patients with advanced colorectal cancer[J]. PLoS One, 2012,7(10):e46684.
18 Korst RJ, Rusch VW, Venkatraman E, et al. Proposed revision of the staging classification for esophageal cancer[J]. J Thorac Cardiovasc Surg, 1998;115(3):660- 669.
19 Hamilton SR, Aaltonen LA. Tumours of the digestive system[M]//Pathology and Genetics, World Health Organization Classification of Tumours. Lyon :IARC Press, 2000:10-25.
20 Greene FL, Page DL, Fleming ID, et al. AJCC cancer staging handbook[M]. 6th ed. New York: Springer-Verlag, 2002:91-98.
21 Fujita Y, Kojima K, Ohhashi R, et al. MiR-148a attenuates paclitaxel resistance of hormone-refractory, drug-resistant prostate cancer PC3 cells by regulating MSK1 expression[J]. J Biol Chem, 2010,285(25):19076-19084.
22 Murata T, Takayama K, Katayama S, et al. miR-148a is an androgen-responsive microRNA that promotes LNCaP prostate cell growth by repressing its target CAND1 expression[J]. Prostate Cancer Prostatic Dis, 2010,13(4):356-361.
23 邱光庭,王遂函,李大鹏,等.微小RNA-148a对胃癌细胞MKN45增殖能力的影响及机制研究[J].中华胃肠外科杂志,2014,17(10):1036-1039.
24 Bofill-De Ros X, Gironella M, Fillat C. miR-148a- and miR-216a-regulated oncolytic adenoviruses targeting pancreatic tumors attenuate tissue damage without perturbation of miRNA activity[J]. Mol Ther, 2014,22(9):1665-1677.
25 Tao S, He H, Chen Q, et al. GPER mediated estradiol reduces miR-148a to promote HLA-G expression in breast cancer[J]. Biochem Biophys Res Commun, 2014,451(1):74-78.
26 Zhou X, Zhao F, Wang ZN, et al. Altered expression of miR-152 and miR-148a in ovarian cancer is related to cell proliferation[J]. Oncol Rep, 2012,27(2):447-454.

