小鼠骨髓细胞染色体G带制片技术的探讨
卢洪武, 黎杰强, 邓优美
(华南师范大学 生命科学学院,广东 广州 510631)
0 引 言
越来越多的研究表明,一个物种的染色体组型在很大程度上具有物种的特异性,并能在胞水平上反映物种的分化和形成过程、亲缘关系、演化途径和进化历史。在对染色体的研究过程中,细胞学家期望通过实验技术,导致染色体内部结构的分化染色,以获得更多的具有鉴别特征的信息,即所谓染色体的“解剖学”特征。科学家用各种不同的方法,以及用不同的染料处理染色体标本后,使每条染色体上出现明暗相间,或深浅不同带纹,这种分化染色技术即为染色体显带技术[1]。这些显带图型在发育过程中以及不同组织的细胞间是恒定的[2]。G带是目前被广泛应用的一种带型。因为它主要是被姬姆萨(Giemsa)染料染色后而显带,故称之为G显带技术(G-band exhibition),其所显示的带纹分布在整个中期细胞的染色体上。
G带技术是由Pardue等建立,方法是先用加热或蛋白水解酶处理未染色的中期染色体玻片,然后用Giemsa染料染色,结果染色体呈现清晰、特异的G带。据认为G 显带技术中,DNA 和蛋白质均与染料的麦硫因和伊红成分作用,G 阳性带为富含AT 的DNA区。由于每条染色体都有其较为恒定的带纹特征,经分带技术处理后,在染色体上所呈现的带纹反映了染色体的固有结构,可显示不同物种染色体的差异或同一物种不同染色体的差异,进而较为准确地识别每条染色体,并可发现染色体上较细微的结构畸变[3]。显带技术不仅解决了染色体的识别问题,由于染色体上能区别许多区和带,还为深入研究染色体的异常和基因定位创造了条件,这对染色体结构与功能的研究、染色体畸变及其机制的研究、癌变药物作用机理等研究都有重要意义[2]。小鼠是生物医学研究中使用数量最多的哺乳类实验动物,遗传组成与人类非常相似,这为建立哺乳类动物研究模型提供了有力的依据。更重要的是小鼠遗传资源丰富,已经成功培育478个近交系,通过自发突变、诱发突变和转基因技术等途径培育并保存了2 000多个突变品系[4]。
目前,获得G带的途径只要有两类技术:一类是在浓盐溶液中进行热处理;另一类是用蛋白水解酶消化。后者因操作简易得到广泛应用。从当前研究状况看,大部分动物的染色体都能显示G带,但针对不同的物种,或同一物种的不同品种,要获得良好的G带,其制片处理方法不尽相同。在王俊森等[5-8]对东北鼢鼠、小鼠骨髓细胞、广东白腹巨鼠、近交系豫医无毛小鼠的G带带型分析中,染色体显带处理的实验条件会有较大的差异,这说明G带技术与研究的材料、药品等密切相关。小鼠染色体数目多,且染色体小,要制作出好的染色体G带玻片标本有一定难度。本文主要探讨小鼠骨髓细胞染色体玻片标本制片技术及G带技术,为小鼠的物种与结构功能研究提供参考依据。
1 材料和方法
1.1 材 料
0.1%秋水仙素溶液,2%柠檬酸钠溶液,0.075 mol/L氯化钾溶液,固定液(甲醇∶冰醋酸=3∶1,临用时现配),Giemsa原液,胰蛋白酶(美国Life Technologies公司),磷酸缓冲液(PBS),pH 7.0 GKN液,pH 7.0 ICN液,25 g左右的小白鼠(雌雄均可)。
1.2 方 法
1.2.1低渗法制备染色体标本
小白鼠腹腔注射秋水仙素溶液(3~4 μg/g体重),3~4 h后取出两侧股骨、胫骨,将骨髓冲于2%柠檬酸钠溶液中,用吸管打散细胞团,使骨髓细胞悬浮于柠檬酸钠溶液中,经1 500 r/min离心10 min后弃上清液,加入KCl液5 mL,用吸管吹散均匀后于37 ℃恒温水浴锅低渗20~30 min,1 500 r/min离心10 min后弃上清液,加固定液5 mL,静置10 min,1 500 r/min离心10 min,重复上一固定、离心步骤,弃上清液保留约0.5 mL固定液制成细胞悬液,于预冷载玻片上滴片(滴片高度约15 cm,滴面不重复)[9]。使用电吹风吹干后,转入37 ℃培养箱中备用。
1.2.2G带制片
小白鼠染色体标本片保存时间不超过30 d,处理前将制片放于60 ℃烤箱中加热30 min,或在酒精灯上微微加热后分别浸入用ICN液配置的0.025%、0.05%、0.125%、0.25%不同浓度的胰蛋白酶中,处理时间如表1设置,一定时间后取出玻片,立即放入GKN液中漂洗2次。吹干染色体标本,用37 ℃预热的Giemsa染液(原液1份,pH 6.8的PBS 19份)染色5~10 min。蒸馏水清洗晾干后镜检。

表1 染色体标本胰蛋白酶处理时间
1.2.3观察
在低倍镜下观察,选择染色体分散良好、无重叠的分散中期的细胞,记录好细胞所在玻片位置的坐标;胰蛋白酶处理后根据已记录的细胞坐标,转至高倍镜下仔细辨析,观察染色体形态及G带带纹,并拍片记录。
2 结果与分析
2.1 胰蛋白酶浓度、消化时间与G带的关系
不同胰蛋白酶处理浓度及处理时间,G带显示效果有较大的差异,显带效果如表2所示。它们之间并不呈一种简单的随浓度或时间递增或递减的线性关系,变化较复杂。

表2 不同胰蛋白酶浓度及处理时间染色体的显带效果
2.1.10.025%胰蛋白酶处理染色体的显带效果
用0.025%胰蛋白酶处理染色体标本,60 s消化时间,染色体未显G带(见图1(a)),120 s的消化时间,结果显示染色体仍未显示G带纹(见图1(b))。虽然目前对染色体显带的原理还不清楚,但一般认为蛋白质的不均一丢失是产生G带的主要原因[10]。在胰蛋白酶的作用下,染色体某些区域水解脱落,抽掉一定数量的蛋白质后显示出浅带;而蛋白质丢失少并与DNA牢固结合的区域则染为深带。据此,染色体未显示带纹可能是因为胰蛋白酶的浓度太低,不能充分、有效地消化染色体上的蛋白质,故不能出现明暗相间的横纹。

(a)60s(b)120s
图1 0.025%胰蛋白酶处理效果(×400)
2.1.20.05%胰蛋白酶处理染色体的显带效果
用0.05%胰蛋白酶处理染色体标本(见表2),在60 s内的消化时间中,处理时间小于20 s,未见G带显示(见图2(a)),而处理时间30 s或大于30 s,染色体轮廓均表现出发毛现象(边缘模糊不清)、带纹模糊,即酶处理过度(见图2(b)),推测合适处理时间在20~30 s。
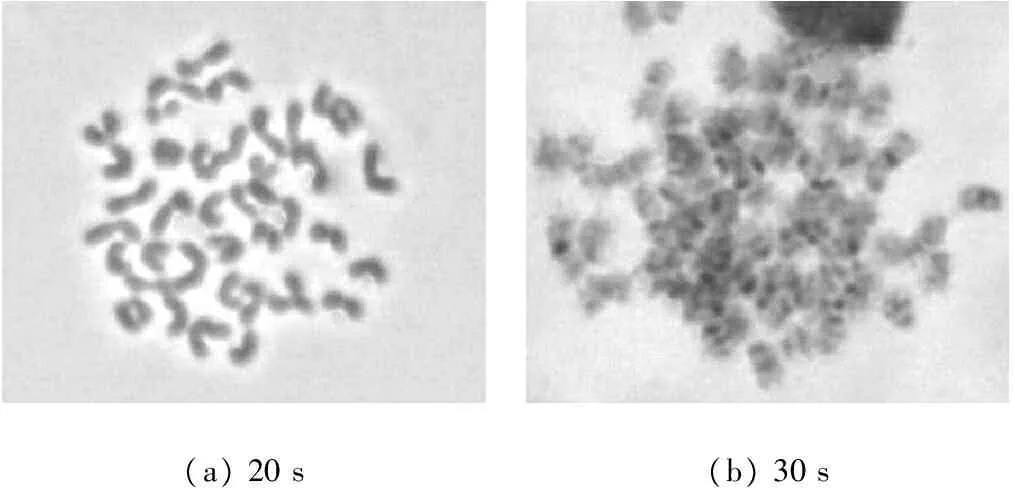
(a)20s(b)30s
图2 0.05%胰蛋白酶处理效果(×1 000)
用0.05%胰蛋白酶按1s的梯度进一步探究20~28 s内染色体的显带效果(见表3)。在21~23 s的消化时间,G带纹从无到有。处理玻片标本21 s,染色体不能显示任何带纹(见图3(a));处理玻片标本22 s,仅有部分染色体显示G带纹(见图3(b));处理玻片标本23 s,染色体出现了较多的G带纹(见图3(c))。

表3 0.05%浓度胰蛋白酶不同处理时间染色体的显带效果

(a)21s(b)22s(c)23s
图3 0.05%胰蛋白酶处理效果(×1 000)
用0.05%胰蛋白酶处理染色体标本,在24~26 s的消化时间中,染色体经胰蛋白酶处理后均能显示清晰的带纹,即出现明暗相间的G带(见图4),并且3个消化时间段的显带效果相近,说明在24~26 s这个消化时间内,对小鼠染色体G带的显示最合适。而21、22 s消化时间未能充分显示G带,23 s消化时间能显示较多的G带,但清淅度稍低。说明在适宜胰蛋白酶浓度下G带显示主要受处理时间的影响。

(a)24s(b)25s(c)26s
图4 0.05%胰蛋白酶处理染色体带纹清晰(×1 000)
玻片标本染色体酶处理前染色均一、形态结构清晰(见图5(a),图6(a)),用0.05%胰蛋白酶处理染色体标本27 s,染色体显示G带纹(少),染色体染色变浅,即开始出现消化过度的现象(见图5(b))。用胰蛋白酶消化染色体标本28 s,染色体显示G带纹(少),染色体边缘发毛、轮廓模糊(见图6(b)),说明胰蛋白酶处理过度的程度加强。增加消化时间,G带纹会变模糊,染色体也变模糊至完全被酶消化而消失。

图5(a) 胰蛋白酶处理前(CK)(×400)图5(b) 0.05%胰蛋白酶处理27s(×1000)图6(a) 胰蛋白酶处理前(CK)(×400)图6(b) 0.05%胰蛋白酶处理28s(×1000)
2.1.30.125%、0.25%胰蛋白酶染色体显带效果
用0.125%、0.25%胰蛋白酶,按5,10,20,30,40,50,60 s处理玻片标本,结果表明:所有处理时间,染色体均表现酶处理过度,未显示G带(见表2),具体表现染色体模糊、轮郭不清、色淡、移位或脱落(见图7)。原因是胰蛋白酶浓度过高,在短时间内将染色体上的蛋白质大部分消化的结果。

图7 0.125%胰蛋白酶处理5 s(×1 000)
2.2 预处理对G带分带的影响
预处理是用秋水仙素于处死小鼠前3~4 h对小鼠骨髓细胞进行中期阻断,原理是秋水仙素可以抑制微管的聚合从而抑制纺锤体的形成,将细胞阻断在有丝分裂中期,从而增加处于分裂中期的染色体的细胞数[11]。此外,秋水仙素对染色体有收缩作用,染色体适当收缩使自身形态清晰,染色体着丝点更明显[12]。
实验中曾尝试加大秋水仙素的预期用量,结果镜检发现,绝大部分染色体都呈收缩状态,部分染色体甚至缩成点状或棒状。由于细胞周期的时间是相对恒定的,秋水仙素用量过大或处理时间过长不仅不会使中期分裂相数目增加,还有可能导致染色体的过分凝缩或着丝点裂解,最终会引起染色体形态不正常,甚至被破坏或溶解[11]。经试验用0.1%秋水仙素以4 μg/g的体重比例经腹腔注射,药物作用3 h的效果最好,制作出的骨髓细胞染色体标本则能获得更多的中期细胞,并且染色体长度适中,二条单体明显,形态清晰。
用胰蛋白酶最佳浓度(0.025%)和最佳时间(25 s)处理小鼠两种形态的染色体:① 预处理过度的染色体(见图8(a)),处理后不能清晰显示G带纹或显示的条数太少(见图8(b));② 预处理合适的染色体体制片(见图9(a)),经胰蛋白酶处理25 s后可清晰显示G带纹,G带数目多(见图9(b))。
2.3 低渗对G带分带的影响
低渗使细胞膨胀,利于染色体分散。低渗过度,如低渗时间长或低渗温度高会使细胞提前破裂(滴片前),制片后则易造成染色体过度分散,不利于判断某些染色体属于哪个细胞;低渗不足,如低渗时间不足或低渗温度过低则会造成细胞吸胀不足,滴片后细胞膜不能破裂,染色体无法散开。有研究发现:低渗能导致染色体某些结构上的不均一性,有助于显带[13]。因此低渗也是控制染色体标本质量的重要步骤,实验中需要控制好低渗时间与温度。实验发现:将细胞材料用预热至37 ℃,0.075 mol/ L氯化钾低渗液中处理25 min,能使骨髓细胞膨胀得更好,滴片时染色体更分散,酶处理后带纹显示更清晰。

图8(a) 高度浓缩的染色体(胰蛋白酶处理前)(×400)图8(b) 高度浓缩的染色体经0.05%浓度胰蛋白酶处理25s(×1000)图9(a) 预处理合适的染色体(胰蛋白酶处理前)(×400)图9(b) 预处理合适的染色体经0.05%浓度胰蛋白酶处理25s(×1000)
3 讨 论
由于G带显示技术具有操作简单、带纹清晰、周期较短等优点被广泛应用于遗传研究中。但该技术受多种因素影响,要获得良好的G带制片亦有较大的难度。本实验的研究表明:骨髓细胞染色体G带显示标本的制作,主要受胰蛋白酶浓度及消化时间,也受秋水仙素预处理浓度时间,低渗等因素的影响。
3.1 胰蛋白酶浓度及消化时间是影响小白鼠染色体G带制片的关键因素
在实验中选用0.025%、0.05%、0.125%、0.25%不同浓度的胰蛋白酶液进行不同消化时间的处理,其中0.05%的胰蛋白酶液在37 ℃下消化24~26 s效果最好,能显示出清晰的带纹(图4);而在0.025%胰蛋白酶液、长达120 s的消化时间下,染色体仍未显示G带带纹;在0.125%、0.25%胰蛋白酶液、低至5 s的消化时间下,染色体均显示出酶处理过度的现象(图7)。因此,胰蛋白酶液浓度过低或过高、消化时间过短或过长都会影响带纹的显示,消化不足带纹不出现,消化过度染色体受破坏,因此必须把握好胰酶处理浓度和消化时间。当然小鼠染色体G带并不呈一种简单的随浓度或时间递增或递减的线性关系,只在合适的浓度才会与处理时间成线性关系。当然,酶本身的活力大小也是影响酶处理的浓度和时间的关键因素,其次实验材料及实验条件不同,也会影响实验的结果,这是不同的研究者在染色体分带技术酶处理上的差异所在[14-15]。
3.2 制片效果对分带的影响
制片质量对分带的效果有决定性的影响。实验分带的制作首先要求玻片上存在大量骨髓细胞,且细胞分布均匀,其次中期分裂相多,最后中期染色体形态清晰,长度适中,无重叠,扭曲或变形。
取材不足或在实验操作过程中造成材料丢失过多是引起细胞数量不足的直接原因,而获得足够数量的细胞是获得更多分裂相的保证。为了尽可能多地获得中期细胞,首先每次实验以2只小鼠为宜,并且用低渗液反复冲洗骨髓腔直至发白为止;其次造成细胞及中期分裂相较少的另外一个原因和低渗后的离心、吹打过程有关,经过低渗的细胞变得膨胀易破,离心、吹打都必须小心。此时离心的转速不能太高,如转速过高则使细胞在此时破裂而丢失[16]。为了收集到足够的细胞同时又能保证低渗后的细胞最大限度保证完整性,选用1 500 r/min离心10 min为宜。另外在离心后细胞的悬浮、制片时细胞悬液的浓度和染色完毕后的冲洗都对制片质量有影响[17]。
中期分裂相的数目还与小鼠的身体状况有关,有研究指出腹腔注射淀粉肉汤、背部剪皮及断尾损伤三种方法都能增加骨髓细胞中期分裂相[18]。实验中尝试对小鼠进行断尾处理,原理是小鼠背部剪皮及断尾都属机械性损伤,损伤部位会有血浆液和白细胞(主要是中性粒细胞及单核细胞)渗出,也会加速骨髓粒细胞及单核细胞的分裂增殖。即该方法对部分骨髓细胞增殖起到了正调控作用,即加速了部分骨髓细胞的分裂增殖,使有丝分裂指数升高。
玻片预冷不足或有油污,则不利于染色体及细胞在玻片上分散开,染色体易聚集、重叠,为了避免影响,实验中采用干净的玻片,预冷处理的玻片以水面刚刚结冰为宜。滴片过程中一度认为离玻片越高越有利于细胞及染色体的分散,事实上滴片高度过高,容易造成细胞聚集成圆状,大量的细胞堆积在一起,不利于染色体的观察,滴片时最佳高度约为15 cm;另外滴片时每张玻片上的悬液最好控制在1滴,一张玻片重复滴片容易造成不同细胞内的染色体重叠。滴片后应注意立即把玻片上的悬液吹散,使其尽可能在玻片上铺展开。
3.3 染色剂对分带效果的影响
在染色体观察时往往会发现染色体呈蓝色,而不是易于观察的玫瑰红色。分析其与染液的配制及染色时间有关,实验中采用Giemsa染液对染色体染色,其浓度过高或染色时间过长会使染色体着色过深,不利于对裂隙、断裂的检出,因此染色时染液浓度要适中,染色时间不能太长。另外实验中所用到的Giemsa 染液是先由Giemsa 干粉研磨制成母液再稀释进行染色,由于研磨不彻底、干粉本身不纯等原因,有可能会在玻片中带入杂质,严重干扰染色体的染色效果。经实验探索发现用45%冰醋酸去色后复染或染色前对Giemsa 染液过滤可有效改善染色效果,这与Hutchison等[19-20]研究发现:冰醋酸还能使DNA 脱尿环,产生缺口或抽掉组蛋白( 特别是组蛋白H1),利于显带的结论相符。因此实验中可利用稀释的冰醋酸去色后复染以获得更好的染色效果,另外也对G带显带起到一定的作用。
4 结 语
骨髓染色体制备技术是细胞遗传学及细胞生物学的核心基本技术之一,通过熟悉实验中所出现的各种问题并掌握正确的解决对策,探索出一种成熟的染色体G带制片技术对日后进一步提高分辨率或者说增加带纹的数目和清晰度,对比度,最终达到多线染色体的水平的目标[21]具有重大的意义。
[1] 比克莫尔 W,克雷格 J.染色体带:基因组的图型[M].房德兴等译.科学出版社,2000:10-22.
[2] 周雪雁,关伟军,马月辉,等.染色体显带技术及其在生物学研究中的意义[J].上海畜牧兽医通讯,2004(5):2-3.
Zhou Xue-yan, Guan Wei-jun, Ma Yue-hui,etal. Chromosome banding technique and its significance in the study of biology[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2004(5):2-3.
[3] 杨 辉,嵇 庆.动物染色体分带技术[J].连云港教育学院学报,1995(1):33-34.
Yang Hui, Ji Qing. Animals chromosomes zoning technologies[J]. Journal of Lianyungang Educational College, 1995(1):33-34.
[4] 刘恩岐,北岛修司,森本正敏.实验小鼠在人类癌症研究中的应用及其进展[J].癌症,2005,24(2):249-254.
Liu En-qi, Shuji Kitajima, Masatoshi Morimoto. Application and recent advanceds of laboratory mouse in human cancer research[J]. Chinese Journal of Cancer, 2005, 24(2):249-254.
[5] 王俊森,张喜祥,邢海林.东北鼢鼠染色体组型和G带带型分析[J].高师理科学刊,1998,18(2):50-55.
Wang Jun-sen, Zhang Xi-xiang, Xing Hai-lin. Analysis of Chromosome Composition and G Band Image of Manchurian Zokor[J]. Journal of Science of Teachers College and University, 1998, 18(2):50-55.
[6] 朱宝芹,邓崇新,刘艳华.小鼠骨髓细胞染色体核G带的分析[J].锦州医学院学报,1994,15(5):23-25.
Zhu Bao-qin, Deng Cong-xin, Liu Yan-hua. Analysis on Chromosome G band of mouse bone marrow cells[J]. Journal of Jinzhou Medical College, 1994,15(5):23-25.
[7] 张锡然,朱红阳,陈宜峰.广东白腹巨鼠的G带核型和银染色[J].遗传,1994,16(1):17-19.
Zhang Xi-ran, Zhu Hong-yan, Chen Yi-feng.The Karyotype g-bands and Ag-NORs of Rattus edwardsi in Guangdong[J]. Hereditas,1994,16(1):17-19.
[8] 王纯耀,宋国英,杜献堂,等.近交系豫医无毛小鼠G显带带型分析及模式图[J].郑州大学学报(医学版),2003,38(2):187-191.
Wang Chun-yao, Song Guo-ying, Du Xian-tang,etal. Analysis on the G -banding pattern of the chromosomes and idiogram in inbred strain Yuyi hai rless mice[J]. Journal of Henan Medical University, 2003,38(2):187-191.
[9] 黎杰强,伍育源,朱碧岩.遗传学实验[M].长沙:湖南科学技术出版社,2006,48.
[10] 黄阜峰.关于胰酶显带问题的探讨[J].湖北师范学院学报,1999,19(2):71-73.
Huang Fu-feng. Discusses the problems about the chromosomes banding by trypsin[J].Journal of Hebei Normal University,1999,19(2):71-73.
[11] 刘涌涛,马全祥,刘慧娟,等.小鼠骨髓细胞染色体标本制备中的失误与对策[J].生物学通报,2003,38(6):53-54.
Liu Yong-tao, Ma Quang-xiang, Liu Hui-juan,etal. Mistakes and countermeasures of mice marrow cell chromosome specimen preparation[J]. Bulletin of Biology, 2003,38(6):53-54.
[12] 徐微蘅,许得新,柳家英,等.医学遗传学基础[M].北京:北京医科大、中国协和医科大学联合出版社,1995:80-125.
[13] Zarsepina O V, Polyakov V Y, Chentsov. Differential decondensation of mitotic chromosomes during hypotonic treatment of living cells as a possible cause of G-band:an ultrastructural strudy[J]. Chromosoma,1989:98-109.
[14] 徐富翠.小鼠精原干细胞染色体G带显示及其影响因素研究[J].泸州医学院学报,2006,29(2):103-105.
Xu Fu-cui. Influential factors for G-band chromosome exhibition in spermatogonial stem cells of mice[J]. Journal of Luzhou Medical College, 2006,29(2):103-105.
[15] 李 栋.小鼠骨髓细胞染色体G 显带制备实验的问题与改进[J].生物学通报,2012,47(9):48-49.
Li Dong. Problems and improvement Preparation of experimental mice marrow cell chromosome G banding[J]. Bulletin of Biology, 2012,47(9):48-49.
[16] 唐慕湘.小鼠染色体制备方法初探[J].解剖学研究,2011,33(2):160.
Tang Mu-xiang. The method of chromosome preparation in mice[J]. Anatomy Research, 2011,33(2):160.
[17] 李标.浅谈成功制作小鼠骨髓细胞染色体标本方法[J].科学教育,2008,4(14):69-70.
Li Biao. Introduction successful method on making chromosome G band of mouse bone marrow cells[J]. Science Education, 2008,4(14):69-70.
[18] 牛新华,李鸿业.小白鼠染色体制备方法的改良[J].滨州医学院学报,1999,22(2):115-116.
Niu Xin-hua, Li Hong-ye. Improvement of Chromosome preparation method of modified mice[J]. Journal of Binzhou Medical College, 1999,(22):115-116.
[19] Hutchison N, Weintraub H. Localization of DNase I-sensitive sequences to specific regions of interphase nuclei. Cell 1985, 43:471-482.
[20] Bukholder G D, Duczek L L.The effect of chromosome banding tecniques on the proteins of isolated chromosomes. Chromosoma, 1982, 87:425-435.
[21] 施立明.染色体分带技术的回顾与展望[J].动物学研究,1984,5(1):7-8.
Shi Li-ming. Retrospect and prospect of chromosome zoning technology[J]. Zoological Research,1984,5(1):7-8.

