异紫堇定碱对人宫颈癌Siha细胞增殖影响的实验研究*
王 芳 王玉欢 刘 斌 梁耀军 张宝平
异紫堇定碱对人宫颈癌Siha细胞增殖影响的实验研究*
王 芳①王玉欢②刘 斌③梁耀军①张宝平④
目的:探讨异紫堇定碱(Isocorydione)对人宫颈癌Siha细胞增殖的影响。方法:以100、200、400、800、1 200 μmol/L浓度的异紫堇定碱对人宫颈癌Siha细胞体外干预,分别作用24、48、72 h后,采用MTT法检测异紫堇定碱对人宫颈癌Siha细胞生长增殖的作用;流式细胞仪检测异紫堇定碱对人宫颈癌Siha细胞周期的影响;结合Hoechst染色观察处理后Siha细胞核微形态的变化;Western Blot法检测异紫堇定碱对人宫颈癌Siha细胞作用后凋亡相关蛋白Bax、Bcl-2、Caspase-3表达的影响。结果:MTT结果显示不同浓度的异紫堇定碱作用于人宫颈癌Siha细胞后具有明显的抑制其增殖的作用,呈剂量-时间依赖关系(P<0.05);流式细胞仪检测结果显示400 μmol/L的异紫堇定碱作用于人宫颈癌Siha细胞后,细胞周期发生明显改变,其中G1和S期细胞比例变化不明显,但G2期细胞明显减少(P<0.05);Hoechst染色结果显示,与对照组比较,400 μmol/L的异紫堇定碱作用于Siha细胞48 h后形态缩小、细胞核固缩,出现核碎裂形成凋亡小体;Western Blot结果显示400 μmol/L的异紫堇定碱分别作用于人宫颈癌Siha细胞24、48、72 h后,其Bax蛋白表达增加,而Bcl-2蛋白表达逐渐减少,Bax/Bcl-2比值增加,Caspase-3蛋白表达逐渐增多。结论:异紫堇定碱对人宫颈癌Siha细胞增殖具有明显的抑制作用,其促使细胞发生凋亡行为可能与线粒体凋亡途径的蛋白有关。
异紫堇定碱 人宫颈癌Siha细胞 生长抑制 凋亡
异紫堇定碱是从罂粟科秃疮花属植物秃疮花(Dicranostigma Leptopodum(Maxim.)Fedde,DLF)又名红茂草(Herba dieranostigmae)中分离得到的一种异喹啉类生物碱单体,已有研究证实,其药理活性成分具有抗肿瘤、抑菌、抗溶血、清除自由基、改善微循环以及提高机体免疫力等作用[1-5]。HPV是人类感染的主要病毒之一,研究证实宫颈癌的发生与HPV感染密切相关,尤其高危型HPV16,18两个亚型。以往传统的治疗手段对于HPV感染宫颈癌患者存在一定缺陷性,因此,在研究宫颈癌临床治疗过程中,寻找特异性的抗HPV药物具有至关重要的意义。且目前有关异紫堇定碱对感染不同亚型HPV的宫颈癌抑制作用方面的研究鲜见报道。本实验将探讨异紫堇定碱对人宫颈癌Siha HPV16(+)细胞增殖的影响,以寻求新型的抗HPV感染的宫颈癌临床治疗药物。
1 材料与方法
1.1 材料
1.1.1 主要试剂 异紫堇定碱单体由中国科学院兰州化学物理所柳军玺研究员惠赠。RPMI-1640培养液、胰蛋白酶(美国Gibico公司),96孔培养板(Nunc);新生胎牛血清(购自杭州四季青生物工程材料有限公司);四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)(美国Sigma公司);细胞周期检测试剂PI(购自Invitrogen公司);RIPA裂解液(Beyotime);Western Blot一抗Bcl-2(1:500),Bax(1:500)(购自Bioworld公司,Caspase-3 CST公司)(1:1 000),山羊抗小鼠以及山羊抗兔二抗均购自北京中杉金桥生物科技有限公司。
1.1.2 仪器设备 Heal Force-Mini型超净工作台,细胞培养箱(日本Sanyo,MC0-18AIC(UV)),倒置荧光显微镜Olymous X-81,流式细胞仪(BD FACS Calibur Cell Sorting System),酶联免疫监测仪(Bio-Rad Model 680),Western Blot实验仪器全为Bio-Rad公司Mini型电泳转印仪器。
1.1.3 细胞株 人宫颈癌Siha细胞HPV16(+)(Cat:TCHu113)购自中国科学院上海细胞所。
1.2 方法
1.2.1 体外细胞培养 人宫颈癌Siha细胞培养于含10%新生胎牛血清+RPMI-1640培养液中,置于5% CO2、37℃、95%饱和湿度的恒温密闭孵箱中进行常规培养,每天观察细胞的生长情况,细胞贴壁80%~90%时传代,约2~3d传代1次。
1.2.2 形态学观察 光学显微镜分别对传2~3代的人宫颈癌Siha细胞以及经不同浓度的异紫堇定碱处理不同时间点的细胞进行形态学观察,通过判定细胞形态、生长方式、细胞折光率以及贴壁率等一系列形态学改变特征判定其产生的直观影响。
1.2.3 MTT法检测细胞生长抑制率 取对数生长期的人宫颈癌Siha细胞,0.25%胰蛋白酶消化,制成单细胞悬液,以5×104个/mL的密度接种于96孔培养板,每孔总体系为200 μL。实验组分别加入浓度为100、200、400、800、1 200 μmol/L用无血清培养基稀释的异紫堇定碱。每个浓度组设6个复孔,用1640培养液200 μL设为调零点,加入不含异紫堇定碱的细胞培养液(细胞液、培养液各为100 μL)为空白对照组,将各组细胞继续培养24、48、72 h后,换无血清培养液,并加入MTT 20 μL继续培养4 h后弃去培养液,每孔加DMSO 150 μL/孔,振荡10 min,置Bio-Rad Model 680酶标仪操作界面下选择波长490 nm测定吸光值(A值),计算各组细胞的生长抑制率,按公式细胞抑制率=(1-实验组A/对照组A×100%),计算细胞抑制率。实验重复3次。
1.2.4 PI染色标记,流式细胞仪检测Siha细胞周期变化 收集经异紫堇定碱作用后的人宫颈癌Siha细胞,按照Invitrogen流式细胞试剂盒的说明书进行样品准备,实验结果由流式细胞仪给出,并分析各组细胞周期变化。
1.2.5 Hoechst 33342染色观察Siha细胞凋亡微形态改变 应用Hoechst 33342荧光染料对异紫堇定碱作用后的人宫颈癌Siha细胞进行染色并观察。将2.5× 106密度细胞接种入24孔板内进行爬片,培养24 h后,刺激细胞发生凋亡后,吸出培养基,加入0.5 mL固定液,4℃过夜固定,弃固定液,PBS清洗3次,每次摇床摇荡5 min,再加入0.5 mL Hoechst 33342染色液,染色5 min,弃染色液,PBS清洗3次,每次5 min,吸尽液体,滴加抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,让细胞接触封片液,在激发波长350 nm左右,发射波长460 nm左右的荧光显微镜下观察细胞核微形态变化。
1.2.6 Western Blot法检测Siha细胞中Bax、Bcl-2、Caspase-3蛋白表达 用RIPA裂解液提取人宫颈癌Siha细胞总蛋白,蛋白定量采用BCA法,以BSA作为标准对照。在570 nm波长处测其吸光度值,计算样品中的蛋白含量。60 μg的总蛋白样品被置于100℃沸水煮7 min进行变性。蛋白电泳用80V跑凝缩胶,100V跑分离胶,转膜采用200mA恒流1~2 h;或者100V电压,冰水浴1 h,具体根据蛋白分子量的大小决定。转完膜后用TBST清洗1次,加入5%脱脂奶粉封闭缓冲溶液,轻轻摇动2 h。弃掉5%封闭缓冲溶液,分别孵育Bax(1:500)、Bcl-2(1:500)、Caspase-3(1:1 000)一抗,4℃过夜。从抗体中取出PVDF膜,用TBST清洗3次,每次摇床摇动10 min,TBS洗2次,每次10 min;将膜放入适量的二抗中。室温轻轻摇动2 h,再用TBST液清洗3次,每次10 min,TBS洗2次,每次10 min。取出膜并轻轻吸取多余水分,按一定的比例加入化学发光液,用ChemiDocTMXRS+System with Image LabTMSoftware成像,蛋白条带判定由预染分子量的Marker提供参考。Western Blot结果用Image-pro plus 6.0软件分析各条带的IOD值。
1.3 统计学分析
数据用SPSS 18.0统计软件分析,采用单因素方差分析进行比较,结果采用±s表示,以P<0.05为差异具有统计学意义。
2 结果
2.1 形态学观察
实验组细胞经异紫堇定碱干预分别作用24、48、72 h后,肉眼均可见有细胞脱落,部分悬浮在培养液中。光镜下见细胞变圆,体积缩小,细胞质内可见较多颗粒,颜色加深,呈深褐色,核颜色也加深,折光性增强;而对照组细胞则贴壁生长良好,形态正常,几乎无脱落,光镜下见细胞长梭形,胞质饱满,相邻细胞生长融合成片(图1)。

图1 光学显微镜观察Siha细胞形态变化(×200)Figure 1 Changes in the morphology of SiHa cells by optical microscopy
2.2 异紫堇定碱对人宫颈癌Siha细胞增殖抑制作用
异紫堇定碱以时间剂量依赖方式抑制细胞的增殖,浓度100、200、400、800、1 200 μmol/L的异紫堇定碱对细胞均有明显的抑制作用,其中24 h抑制率分别为:0、2.13%、10.3%、39.7%、44.5%;48 h抑制率则为:8.6%、11.9%、21.3%、54.1%、60.4%;72 h抑制率为:14.8%、28.9%、47.5%、69.7%、76.4%;且随着培养液中异紫堇定碱浓度的增加和培养时间的延长,抑制作用也逐渐增强,呈现时间与浓度依赖性;此外,细胞的存活能力与异紫堇定碱的浓度也存在依赖关系。与对照组相比较,统计学结果显示不同时间点之间具有显著性差异(P<0.05),不同浓度之间也存在显著性差异(P<0.05,图2)。

图2 MTT检测异紫堇定碱对人宫颈癌Siha细胞增殖抑制作用Figure 2 MTT assay shows the inhibitory action of SiHa human cervical carcinoma cells[HPV(+)]and CHO cells[HPV(-)]after treatment with isocorydine
2.3 PI染色流式细胞仪检测细胞周期的改变
异紫堇定碱对人宫颈癌Siha细胞周期的影响不同浓度的异紫堇定碱作用人宫颈癌Siha细胞24,48,72 h后,细胞周期发生率明显改变,其中G1期和S期细胞比例未见明显变化,而以G2期细胞减少最为显著,且随着异紫堇定碱浓度的增加和作用时间的延长,G2期细胞减少率也明显增强,与对照组相比具有显著性差异(P<0.05)。这说明异紫堇定碱诱导人宫颈癌Siha细胞具有明显的周期依赖性,在同一时间段,随药物浓度的增加细胞周期改变明显,二者呈正相关(P<0.01)。同一浓度不同时间段(24,48,72 h)细胞的G2期减少的幅度率逐渐增强(图3)。

图3 异紫堇定碱对人宫颈癌Siha细胞周期的干预作用Figure 3 Changes in the cell cycle of SiHa human cervical carcinoma cell lines after isocorydione intervention
2.4 Heochst 33342染色观察细胞核微形态的变化
Hoechst染色结果显示:未干预的Siha细胞核形态规则,染色均一,蓝染较淡;经400 μmol/L Isocorydione的处理48 h后,与对照组相比细胞形态缩小、不规则,细胞核固缩或碎裂为小核,形成凋亡小体(图4)。
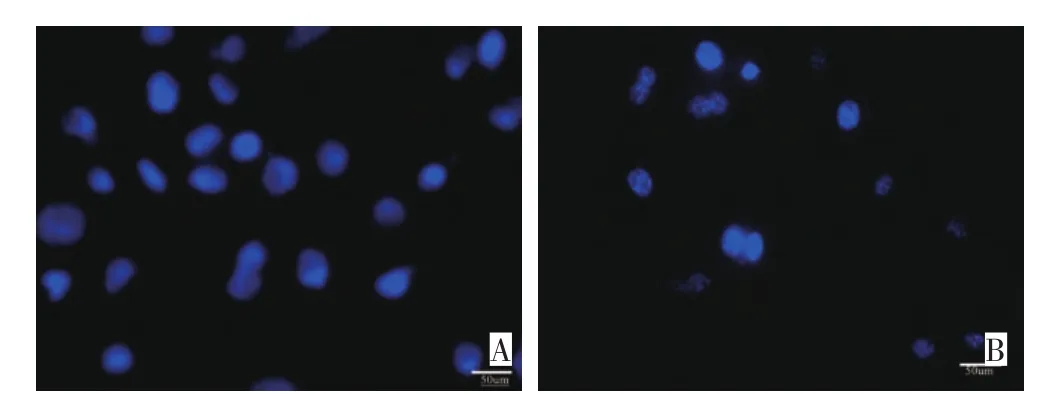
图4 异紫堇定碱对人宫颈癌Siha细胞微形态的影响(×400)Figure 4 Micromorphologic effects of SiHa human cervical carcinoma cell lines after isocorydione treatment
2.5 Western Blot检测Bcl-2、Bax、Caspase-3的蛋白表达
以400 μmol/L的异紫堇定碱作用24,48,72 h Siha细胞后,凋亡相关蛋白Bax、Caspase-3蛋白表达均增加,Bcl-2蛋白表达则减少,而Bax/Bcl-2的比值增加(图5)。

图5 异紫堇定碱对人宫颈癌Siha细胞中凋亡相关蛋白表达的影响Figure 5 Expression of apoptosis-related proteins in SiHa human cervical carcinoma cell lines after isocorydione intervention
3 讨论
宫颈癌的发病与HPV感染密切相关[1-2,6-11],研究表明,70%的宫颈癌是由HPV16和HPV18引起[12-13]。而HPV16、HPV18及其亚型,也被称为宫颈癌发生的高危亚型。但目前临床仍然没有针对HPV阳性宫颈癌治疗有效的靶向药物,由于传统中草药物所具有抗HPV感染及抗肿瘤的药理活性[14-15],这为宫颈癌临床药物治疗提供了一种可供选择的途径。有诸多研究报道[1,3-5],异紫堇定碱具有抗肝癌、抑菌、抗溶血、清除自由基、改善心肌微循环以及提高荷瘤小鼠免疫力等作用,鉴于异紫堇定碱上述的药理活性作用以及在抗HPV感染及人宫颈癌作用机理等方面研究报道的不明确。
本实验采用HPV16阳性人宫颈癌Siha细胞,探讨异紫堇定碱对人宫颈癌Siha细胞增殖的作用。形态学结果显示异紫堇定碱能使人宫颈癌Siha细胞变圆,体积缩小,部分脱落,细胞质内可见较多颗粒,颜色加深,呈深褐色,核颜色也加深;MTT检测结果显示:异紫堇定碱对人宫颈Siha细胞具有明显的抑制作用,且呈现时间-效应依赖关系;细胞周期检测结果显示:异紫堇定碱作用人宫颈癌Siha细胞后,细胞周期发生率明显改变,其中G2期细胞比例明显减少,且随着异紫堇定碱浓度的增大和作用时间的延长,其细胞比例也明显减少;Western Blot法检测结果显示:异紫堇定碱作用人宫颈癌Siha细胞24,48,72 h,Bax蛋白表达增加,而Bcl-2蛋白表达减少,Bax/Bcl-2的比值增加,Caspase-3蛋白表达增加;且随着时间和药物剂量的增加,Bax蛋白也表达增加,而Bcl-2蛋白表达减少,Bax/Bcl-2的比值增加,Caspase-3蛋白表达增加。Yazan等[16]研究发现,从茴香花里提取的百里醌通过下调Bcl-2基因凋亡使得Siha细胞发生凋亡。Kniazhanski等[17]研究显示,茉莉酸甲酯通过多途径诱导宫颈癌细胞死亡。Xu等[18]发现,血根碱能诱导宫颈癌HeLa和Siha的细胞的凋亡,引起Bcl-2蛋白表达的下调,Bax蛋白表达增加,从而抑制宫颈癌细胞的生长。上述文献的报道与本研究结果相类似。
通过本实验结果表明,异紫堇定碱作用于人宫颈癌Siha细胞后,可使Bcl-2蛋白表达明显下调,而与其相反的Bax蛋白表达明显上调;随着时间和药物剂量的增加,Bax/Bcl-2蛋白表达比值增加,而凋亡指数升高,凋亡执行者Caspase-3表达增加。这表明Bax/Bcl-2参与介导人宫颈癌Siha细胞的凋亡;并且还可以通过激活下游的Caspase-3,引起一系列的酶联激活反应,从而诱导细胞发生凋亡。因此,本研究可初步推断异紫堇定碱促使HPV16阳性的人宫颈癌Siha细胞发生凋亡的过程可能与线粒体途径的凋亡相关蛋白有关,而本研究对于其他诸如死亡受体通路、内质网通路的凋亡途径未涉及,考虑到临床中目前依然没有特别有效地针对感染不同亚型HPV的靶向抗肿瘤药物,后期可以随着研究的深入将异紫堇定碱研发为新型具有靶向特性的抗HPV感染的抗肿瘤临床药物。
1 Sun H,Hou H,Lu Zhang L,et al.Isocorydine inhibits cell proliferation in hepatocellular carcinoma cell lines by inducing G2/M cell cycle arrest and apoptosis[J].PLoS One,2012,7(5):e36808.
2 Lu P,Sun H,Zhang L,et al.Isocorydine targets the drug resistant cellular side population through PDCD4-related apoptosis in hepatocellular carcinoma[J].Molecular Med,2012,18(1):1136-1146.
3 Gong Y,Miao R,Wang T,et al.Effects of Herba dicranostigmae on immune function of mice bearing tumor[J].Journal of Lanzhou University(Medical Sciences),2008,34(3):55-57.[龚艳妮,苗瑞东,王廷璞,等.红茂草对荷瘤小鼠免疫功能的影响[J].兰州大学学报(医学版),2008,34(3):48-52.]
4 Zhao Q,Wang T,Yu S,et al.Determination of antibacterial activities of Dicranostigma leptodum(Maxim)Fedde's alkaloid[J].Chinese Veterinary Science,2008,38(12):1098-1101.[赵 强,王廷璞,余四九,等.红茂草生物碱抑菌活性的测定[J].中国兽医科学,2008,38 (12):1098-1101.]
5 Chen Z,Wang Q,Wang T,et al.Influences of Dicranostigma Leptopodum(Maxim)Fedde(DLF)on the immune functions of murine peritoneal macrophages(PM)[J].Shanghai Journal of Immunology,2001,21(4):216-218.[陈正山,王 勤,王廷璞,等.秃疮花注射液对小鼠腹腔巨噬细胞免疫功能的影响[J].上海免疫学杂志,2001,21 (4):216-218.]
6 Patel A,Galaal K,Burnley C,et al.Cervical cancer incidence in young women:a historical and geographic controlled UK regional population study[J].Br J Cancer,2012,106(11):1753-1759.
7 Dickson EL,Vogel RI,Bliss RL,et al.Multiple-type human papillomavirus(HPV)infections:A cross-sectional analysis of the prevalence of specific types in 309,000 women referred for HPV testing at the time of cervical cytology[J].Int J Gynecological Cancer,2013, 23(7):1295-1302.
8 Cecchini G,Paganini G,D'Amico M,et al.Cervical cancer screening programs in low-income communities.Experiences from ecuador.Low cost detection of HPV infection in a developing country [J].Pathologica,2009,101(2):76-79.
9 Teitelman AM,Stringer M,Averbuch T,et al.Human papillomavirus,current vaccines,and cervical cancer prevention[J].Obstet,Gynecol Neonatal Nurs,2009,38(1):69-80.
10 Zhang HY,Tiggelaar SM,Sahasrabuddhe VV,et al.HPV prevalence and cervical intraepithelial neoplasia among HIV-infected women in Yunnan Province,China:a pilot study[J].Asian Pac J Cancer Prev,2012,13(1):91-96.
11 Guan P,Clifford GM,Franceschi S.Human papillomavirus types in glandular lesions of the cervix:A meta-analysis of published studies[J].Int J Cancer,2013,132(1):248-250.
12 Tjalma WA,Fiander A,Reich O,et al.Differences in human papillomavirus type distribution in high-grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe[J].Int J Cancer, 2013,132(4):854-867.
13 Sow PS,Watson-Jones D,Kiviat N,et al.Safety and Immunogenicity of human papillomavirus-16/18 AS04-adjuvanted vaccine:A randomized trial in 10-25-year-old HIV seronegative African girls and young women[J].J Infect Dis,2013,207(11):1753-1763.
14 Wu Z,Wu LJ,Tashiro SI,et al.Shikonin induce HeLa cell apoptosis via a caspase-dependent mechanism[J].Chinese Pharmacological Bulletin,2004,20(5):540-544.[吴 振,吴立军,田代真一,等.紫草素诱导HeLa细胞凋亡经过caspase激活的机制[J].中国药理学通报,2004,20(5):540-544.]
15 Jin Z,Song AW,Li RJ.Clinical study on treatment of cervical human papilloma viral infection by Qingdu suppository[J].Chinese Journal of Integrated Traditional and Western Medicine,2002,10 (10):735-737.[金 哲,宋爱武,李仁杰.清毒栓治疗宫颈人乳头瘤病毒感染的临床研究[J].中国中西医结合杂志,2002,10(10):735-737.]
16 Yazan LS,Ismil M.Thymoquinone from Nigella sativa was more potent than cisplatin in eliminating of Siha cells via apoptosis with down-regulation of Bcl-2 protein[J].Toxicol in Vitro,2011,25(7): 1392-1398.
17 Kniazhanski T,Jackman A,Heyfets A,et al.Methyl jasmonate induces cell death with mixed characteristics of apoptosis and necrosis in cervical cancer cells[J].Cancer Lett,2008,271(1):24-46.
18 Xu JY,Meng QH,Chong Y,et al.Sanguinarine inhibits growth of human cervical cancer cells through the induction of apoptosis[J]. Oncol Rep,2012,28(6):2264-2270.
(2013-06-12收稿)
(2013-09-18修回)(本文编辑:贾树明)
Effects of isocorydione on cell proliferation in SiHa human cervical carcinoma cell lines
Fang WANG1,Yuhuan WANG2,Bin LIU3,Yaojun LIANG1,Baoping ZHANG4
Bin LIU;E-mail:2638541021@qq.com
1The Second Hospital of Lanzhou University,Lanzhou 730030,China;2Graduate School of Gansu University of Traditional Chinese Medicine,Lanzhou 730000,China;3Lanzhou University College of Stomatology and4Biomechanics Institute of the School of Civil Engineering and Mechanics,Lanzhou 730000,China
Objective:This paper aimed to investigate the effects of isocorydinone on cell proliferation in SiHa human cervical carcinoma cell lines.Methods:Different concentrations of isocorydione(100,200,400,800,and 1200µmol/L)were used to treat SiHa human cervical carcinoma cells in vitro for 24,48,and 72 h.Methyl thiazolyl tetrazolium(MTT)assays were conducted to determine the inhibitory action of isocorydione.Flow cytometry was performed to detect the cell cycle in SiHa human cervical carcinoma cells after treatment with 400µmol/L isocorydione.Hoechst 33342 staining was used to observe the micro-morphological changes of SiHa cell nucleus after the treatment.The expression of Bcl-2,Bax,and caspase-3 proteins in cervical carcinoma SiHa cell lines was determined using western blot analysis.Results:MTT assays showed that isocorydione inhibits the proliferation of SiHa cells in a dose-and time-dependent manner(P<0.05).The flow cytometry results showed that SiHa cervical carcinoma cells treated with different concentrations of isocorydione exhibited increased cell cycle.Compared with the control group,Hoechst 33342 staining showed that SiHa cells became narrow,with nuclear pyknosis and fragmentation,and formed an apoptotic body after treatment with 400µmol/L isocorydione for 48 h.Furthermore,western blot analysis proved that isocorydione significantly inhibited the proliferation of SiHa cell lines, and the expression of Bax protein was increased.By contrast,the expression of Bcl-2 protein decreased gradually.Consequently,the ratio of Bax/Bcl-2 increased,as well as the expression of caspase-3 protein.Conclusion:Isocorydione exhibited an overt inhibitory ac-tion on SiHa cells.Isocorydione promoted the occurrence of cell apoptosis,which may be associated with related proteins of mitochondrial apoptotic pathway.
isocorydione,human cervical carcinoma SiHa cell line,growth inhibition,apoptosis
10.3969/j.issn.1000-8179.20130928
①兰州大学第二医院(兰州市730000);②甘肃省中医学院研究生院;③兰州大学;④兰州大学生物力学所
*本文课题受国家重点研究发展计划973项目基金(编号:2010CB834202)、国家自然科学青年科学基金项目(编号:30770639)、甘肃省自然科学基金(编号:0702NKDA045,0801NKDA001)和甘肃省科技支撑项目(编号:090NKCA125)资助
刘斌 2638541021@qq.com
This study was supported by the State Key Basic Research Development Program of China(973 Program;No.2010CB834202), National Natural Science Foundation of China(Key program)(No.30770639),Natural Science Foundation of Gansu Province (No.0702N KDA045;No.0801NKDA001),and Scientific and Technologic Support Program of Gansu Province(No.090NKCA125)

王芳 医学博士,副主任医师。研究方向为妇科肿瘤临床治疗、宫颈癌早期筛查、抗宫颈癌药物筛选及生殖内分泌的相关基础研究。
E-mail:wangfang@lzu.edu.cn

