小剂量激素合甲氨蝶呤治疗早期类风湿性关节炎疗效观察
华 丽 吴红华 杜红卫 浙江省金华市中心医院风湿免疫科 金华 321000
·论 著·
小剂量激素合甲氨蝶呤治疗早期类风湿性关节炎疗效观察
华 丽 吴红华 杜红卫 浙江省金华市中心医院风湿免疫科 金华 321000
目的 观察小剂量激素泼尼松(PDN)联合甲氨蝶呤(MTX)治疗早期类风湿性关节炎(RA)的疗效及安全性。方法 未接受过治疗的早期RA患者60例,随机分为观察组30例,予PDN联合MTX治疗(PDN 10~15mg/d,MTX7.5~20mg/w),对照组30例,予MTX(7.5~20mg/w)加安慰剂治疗,疗程均12周。治疗0、4、8、12周评估两组疗效及安全性。以美国风湿病学会(ACR)疗效评价指标ACR20、DAS28-ESR指标、疼痛目视模拟测试表(VAS)评分、患者对病情活动的总体VAS评分、医生对病情活动的总体VAS评分、压痛关节数、肿胀关节数、健康评估问卷(HAQ-DI)评分、晨僵持续时间、CRP和ESR作为疗效指标。结果 治疗第4周和第8周,观察组达到ACR20改善者分别为43.3%、66.7%,对照组分别为16.7%、30.0%,两组比较差异均有统计学意义(P均<0.05)。治疗第12周,观察组83.3%(25例)达到ACR20的改善,对照组为43.3%(13例)(P=0.001)。第4周起,观察组DAS28-ESR评分均持续低于对照组(P均<0.05,P<0.01)。治疗12周,除关节压痛数、晨僵时间和CRP,观察组其它各项临床和实验室炎症指标改善均优于对照组(P<0.05,P<0.01)。观察组RA病程与12周DAS28-ESR评分存在显著正相关(r=0.643,P=0.000)。结论 小剂量GC联合MTX治疗能显著改善ERA症状、体征和实验室炎性指标,疗效优于单用MTX。两者联合治疗安全耐受性良好。关键词 早期类风湿性关节炎;小剂量激素;甲氨蝶呤;疗效;安全性
类风湿性关节炎(rheumatoid arthritis,RA)是一种以对称性多关节炎为主要表现的慢性、进行性、侵蚀性自身免疫性疾病。糖皮质激素(glucocorticoids,GC)能迅速控制RA患者的临床症状,但长期使用GC可产生诸多不良反应,因此对于GC治疗RA颇有争议。最近,国外有报道小剂量激素联合改变病情抗风湿药(disease-modifying antirheumatic drugs,DMRADs)能使RA患者获得更好的临床和放射学转归[1-4]。国内亦有学者提出需重新评估GC在RA治疗中的作用和地位[5-6]。RA早期治疗对于病情缓解和预后非常重要[7]。本研究采用随机单盲临床试验方法,观察小剂量激素联合甲氨蝶呤对初治的早期RA患者的疗效和安全性。
1 临床资料
1.1 一般资料 选取2013年1月—4月本院风湿科就诊RA患者60例,均未接受过任何药物治疗,且病程<12个月[8]。采用随机单盲原则,以1:1比例,将60例分为观察组30例,男6例,女24例,平均年龄(49.1±12.3)岁,平均病程(6.1±3.0个)月,平均关节压痛数(12.8±6.2)个,平均关节肿胀数(10.3±5.4)个;对照组30例,男5例,女25例,平均年龄(51.2± 12.0)岁,平均病程(5.9±2.9个)月,平均关节压痛数(12.0±5.9)个,平均关节肿胀数(10.8±5.5)个。两组基线资料及临床指标比较差异无统计学意义(P均>0.05)。以DAS28-ESR>5.1为高活动性标准,两组各有2例受试者未达该标准,表明参与本次试验的受试者大多数为高度活动RA患者。本研究获得本院临床研究伦理委员会的批准。所有受试者自愿参加临床试验研究,并签署知情同意书。
1.2 诊断标准 均符合2009年美国风湿病学会(ACR)和欧洲抗风湿病联盟(EULAR)提出的新RA分类标准[9]。排除:伴有禁止激素治疗疾病(例如糖尿病、易致脆性骨折的骨质疏松)患者;入组前2个月有较严重的感染(如肝炎、肺炎和肾盂肾炎等)史者;孕妇、哺乳期妇女;结核病患者;肿瘤、多发性硬化、中枢性神经脱髓鞘病变和充血性心力衰竭等疾病者;有其它严重心、肝、肾等重要脏器和血液、内分泌系统疾病或病史者。
2 方法
2.1 治疗方法 观察组予甲氨蝶呤(MTX)+泼尼松(PDN),MTX初始剂量7.5mg/w,如患者能耐受,逐渐加量至15~20mg/w,PDN剂量≤15mg/d。对照组予甲氨蝶呤(MTX)+安慰剂,MTX治疗方案同观察组,安慰剂采用相同外包装的维生素B2片。采用羟氯喹0.2g,1天1次,作为3个月后的补救用药。为预防骨质疏松、消化道反应等,两组开始治疗时均加用质子泵抑制剂、钙片、活性维生素D。
2.2 观察指标 两组治疗前及治疗第4、8、12周后评估下列指标:晨僵、关节肿胀数及肿胀指数、关节压痛数及压痛指数、疼痛的视觉模拟评定量表(VAS)评分、疾病活动医生VAS评分、疾病活动患者VAS评分、健康评价问卷(HAQ-DI)评分。实验室指标:包括血、尿常规、血生化、乙肝、丙肝、ESR、CRP等,并按规定进行肺CT、B超(肝胆脾胰、泌尿系、心脏)及心电图检查。不良反应:包括感染、胃肠道症状、骨髓抑制、肝肾功能。
2.3 统计学方法 应用SPSS16.0统计分析软件。计量资料以(±s)表示,采用成组t检验进行推断统计分析。两组ACR20和DAS28缓解评定采用卡方检验。两组治疗前后疗效评估采用配对t检验方法。采用斯皮尔曼积差相关的方法分析RA病程与GC治疗疗效的关联。所有统计检验采用双侧检验,显著性水平α取0.05。
3 治疗结果
3.1 疗效标准 采用美国风湿病学会所制定的ACR20和欧洲抗风湿病联盟制定的DAS28-ESR标准评定[10]。ACR20改善:患者压痛及肿胀关节数有20%的改善,且下列5项中至少3项有20%的改善:疼痛VAS评分、疾病活动医生VAS评分、疾病活动患者VAS评分、HAQ评分、ESR或CRP。DAS28-ESR评定<2.6分为缓解(DAS28-ESR包括人体28个关节的压痛数、肿胀数、ESR的水平以及患者自身综合评估四个项目,应用公式加以运算后得出分数,以评估类风湿性关节炎的疾病活动性)。
3.2 两组ACR20结果比较 治疗第12周,观察组83.3%(25例)患者达到ACR20改善,对照组43.3%(13例)达到ACR20。观察组达标比例显著高于对照组(χ2=10.335,P=0.001)。治疗第4、8周,观察组达到ACR20者分别为43.3%、66.7%,均显著高于对照组的16.7%、30%(P均<0.05)。见图1。
3.3 两组DAS28评分比较 自第4周起,观察组DAS28-ESR评分均分均显著低于对照组(P<0.05,P<0.01)。配对样本t检验结果显示,两组患者接受治疗后,DAS28-ESR评分均显著下降(P<0.01,P<0.01),表明两种治疗方案均产生显著疗效。以DAS28-ESR<2.6分为缓解标准,对两组12周达到缓解标准的患者比例进行统计,观察组达到缓解标准者8例(26.7%),对照组达到缓解标准者2例(6.7%),两组差异有统计学意义(χ2=4.577,P=0.032)。见图2,表1。
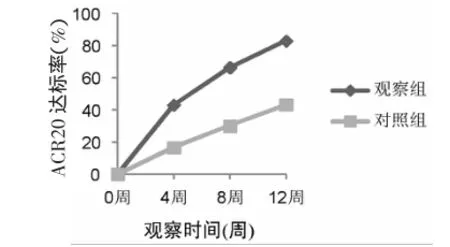
图1 两组各时间点达到ACR20患者比例

图2 两组各时间点DAS28-ESR评分
表1 两组各时间点 DAS28-ESR评分及缓解数比较(±s)
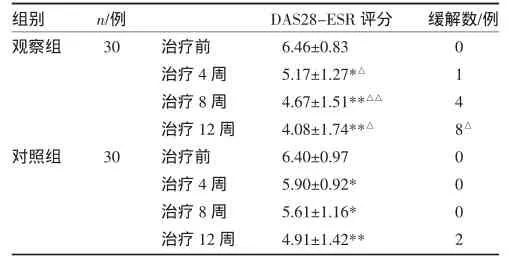
表1 两组各时间点 DAS28-ESR评分及缓解数比较(±s)
注:与对照组比较,△P<0.05,△△P<0.01;与治疗前比较,*P<0.05,**P<0.01
组别观察组n/例30缓解数/例对照组30治疗前治疗4周治疗8周治疗12周治疗前治疗4周治疗8周治疗12周DAS28-ESR评分6.46±0.83 5.17±1.27*△4.67±1.51**△△4.08±1.74**△6.40±0.97 5.90±0.92* 5.61±1.16* 4.91±1.42** 0 1 4 8△ 0 0 0 2
3.4 两组临床指标及实验室指标比较 治疗第4周起,观察组多项临床指标及实验室指标改善情况即优于对照组。治疗结束(12周)后,除关节压痛数、晨僵时间和CRP外,观察组各指标均优于对照组,差异有统计学意义(Ps<0.05,P<0.01)。配对样本t检验结果显示,两组患者治疗后,除晨僵指标之外,其余临床及实验室指标均得到显著改善(P<0.05,P<0.01),见表2。
表2 两组各时间点临床观察指标比较(±s)

表2 两组各时间点临床观察指标比较(±s)
注:与对照组比较,△P<0.05,△△P<0.01;与治疗前比较,*P<0.05,*P<0.01
组别观察组n/例30对照组30观察时间治疗前治疗4周治疗8周治疗12周治疗前治疗4周治疗8周治疗12周关节压痛/个12.8±6.2 8.8±6.7* 6.6±6.3* 5.2±6.2** 12.0±5.9 10.1±5.2 8.6±5.5* 6.8±5.6**关节肿胀/个10.3±5.4 6.4±5.3** 4.9±4.8**△3.4±4.2**△10.8±5.5 8.7±5.2* 7.4±5.3* 5.8±5.3** VAS/分6.4±1.5 3.2±1.3**△△2.6±1.8**△△1.9±1.9**△△6.1±1.7 4.8±1.7* 4.4±1.9* 3.4±2.2*患者VAS/分6.8±1.2 4.5±1.5**△△4.0±1.9**△△3.5±2.1**△△6.9±1.3 6.2±1.5 5.9±1.5* 5.5±2.0*医生VAS/分7.2±1.2 5.0±1.2**△△4.4±1.8**△△3.7±2.1**△△6.9±1.2 6.2±1.3 5.9±1.5 5.5±2.0* HAQ-DI 1.6±0.5 1.2±0.6* 1.1±0.6*△1.0±0.6**△△1.6±0.6 1.4±0.5 1.4±0.4 1.3±0.4*晨僵时间/min 109.7±87.6 68.5±57.0 62.7±49.5△80.7±62.1 114.3±75.3 94.7±79.2 96.3±66.0 109.7±74.0 CRP/(mg/L)22.9±36.3 16.6±32.6* 11.9±23.0* 8.74±20.9* 23.2±27.2 19.7±23.8* 19.3±21.7* 17.6±21.7* ESR/(mm/h)68.2±25.8 45.7±22.7* 38.9±23.2** 26.0±17.2**△64.4±24.4 57.0±22.3* 50.0±24.4* 41.3±26.5**
3.5 RA病程与DAS28-ESR评分相关性 观察组RA病程与12周DAS28-ESR评分的相关系数为0.643(P=0.000),表明RA病程与DAS28-ESR评分呈显著正相关,RA病程越短,治疗效果越佳。
3.6 药物安全性评估 观察组治疗第4周时出现胃肠道反应1例,但能忍受,加强护胃后缓解;肝功能损害1例,肝酶轻度升高,加用护肝药后恢复正常。对照组治疗第1周发生胃肠道反应1例,表现为轻度恶心,加用胃药后缓解;血白细胞轻度减少2例,未予特别处理。两组不良反应事件发生率差异无统计学意义(P>0.05)。
4 讨论
RA是有多种细胞(包括巨噬细胞、T细胞、B细胞、成纤维细胞、软骨细胞和树突状细胞)参与发病的复杂疾病。该病主要累及滑膜,侵犯并破坏关节软骨、软骨下骨、肌腱和韧带。GC治疗RA能够抑制疾病活动度,并具有改善病情的作用[11-12],但其长期使用可能带来的副作用[13],限制了临床应用[14]。而DMARDs在临床治疗RA起效慢且疗效不稳定。研究认为[14],使用DMARDs治疗后,仍有很大一部分RA患者无法达到临床缓解或是达到低疾病活动度。因此,近年来,小剂量GC联合DMRADs用于早期RA治疗受到广泛关注。2010年欧洲抗风湿联盟一专题组在系统复习文献的基础上,发表了“以GC处理RA的当代证据”[15],主要内容包括:GC能够迅速减轻疾病活动度,有助于改善预后,并且可以在DMRADs起始治疗或是更换时起桥治疗作用[16];针对早期RA患者,以小剂量GC加DMARDs能够有效改善临床症状及功能,尤其是放射学进展[4,17]。GC加单一或几种DMARDs产生的临床疗效和抑制X线进展的作用可延续数年[18]。国内亦有学者[5-6]倡导重新认识GC和再评价GC联合DMARDs在早期RA治疗中的作用,认为GC联合DMARDs的治疗应作为RA治疗的金标准。
本研究结果显示,与MTX单药治疗相比,小剂量GC联合MTX能更有效地改善RA患者的各项症状、体征和实验室炎性活动指标;改善患者的躯体运动功能—生活质量(HAQ-DI评分)。自第4周起,观察组达到ACR20改善程度的患者比例即显著高于对照组,DAS28-ERS评分则显著低于对照组(P<0.05,P<0.01)。并且整个研究中,观察组维持着这种疗效上的优势。两组患者不良反应事件相似(P>0.05)。该结果表明相对于MTX单药治疗,小剂量GC联合MTX治疗RA早期即显著缓解RA患者症状,这与国外相关研究结果基本一致[2,17,19]。Bakker等[2]对236例病程<1年的早期RA患者进行小剂量GC联合MTX与MTX单药治疗的随机试验,结果发现,2年后小剂量GC联合MTX组比单用MTX组能更有效减少疾病活动及机体残疾,关节破坏的影像学评分显著低于非联合组,更能达到长期缓解,减少生物制剂的使用,而不良事件发生率两组相似。
本研究还发现RA病程与DAS28-ESR评分存在显著相关关系(P<0.01),RA病程越短,治疗效果越佳。提示RA早期治疗具有重要意义。自1989年Wilske和Healey提出“倒金字塔”(降阶梯概念)的开创性理论[20]以来,对RA早期和积极治疗的观念已成为主导范例。这一理论牵涉到“机遇窗”[7]的概念,它提示类似于早期癌,RA越早期,病变细胞越少,及时治疗反应性越好。抓住“机遇窗”采取有效的治疗措施,可以事半功倍。
本研究存在以下几点不足:第一,参加试验的受试者例数较少,这可能导致研究结论的推广性受到限制;第二,试验的临床观察时间仅有3个月,时间较短,这导致无法评估小剂量GC对于早期RA患者疗效的持续性以及X线的保护作用,而这可能是早期RA患者治疗更为重要的一个方面,即:小剂量GC的使用是否能够在早期RA患者未出现骨损坏的情况下给予保护;第三,治疗方案较为单一,本研究仅涉及小剂量GC联合MTX的治疗,而未包含更多的治疗方案,例如小剂量GC联合MTX及羟氯喹(hydroxychloroquine;HCQ)的治疗方案。近年发现HCQ有降低RA患者血脂、血糖及糖尿病风险,有助于预防骨质疏松、预防严重感染的作用,临床应用广泛。故GC联合HCQ的治疗方案或比联合MTX方案具有更佳的疗效。
[1]Kirwan JR.Combination therapy including glucocorticoids:The new gold standard for early treatment in rheumatoid arthritis[J].Ann Intern Med,2012,156(5):390-391.
[2]Bakker MF,Jacobs JW,Welsing PM,et al.Low-Dose Prednisone Inclusion in a Methotrexate-Based,Tight Control Strategy for Early Rheumatoid ArthritisA Randomized Trial[J].Ann Intern Med,2012,156(5):329-339.
[3]Kirwan JR,Bijlsma J,Boers M,et al.Effects of glucocorticoids on radiological progression in rheumatoid arthritis[J]. Cochrane Database Syst Rev,2007,CD006356.
[4]Svensson B,Boonen A,Albertsson K,et al.Low-dose prednisolone in addition to the initial disease-modifying antirheumatic drug in patients with early active rheumatoid arthritis reduces jointdestruction and increases the remission rate:A two-year randomized trial[J].Arthritis Rheum,2005,52(11):3360-3370.
[5]施桂英.糖皮质激素联合改变病情抗风湿药物对早期类风湿关节炎治疗作用的再评价[J].中华风湿病学杂志,2013,17(1):1-4.
[6]李鸿斌.重新认识糖皮质激素在类风湿关节炎治疗中的地位[J].中华风湿病学杂志,2013,17(2):73-75.
[7]Boers M.Understanding the window of opportunity concept in early rheumatoid arthritis[J].Arthritis Rheum,2003,48(7):1771-1774.
[8]鲍春德,黄烽,赵岩.依那西普治疗类风湿关节炎和强直性脊柱炎的专家建议[J].中华内科杂志,2013,6(49):546-546.
[9]Aletaha D,Neogi T,Silman AJ,et al.2010 rheumatoid arthritis classification criteria:An American College of Rheumatology/European League Against Rheumatism collaborative initiative[J].Arthritis Rheum,2010,62(9):2569-2581.
[1 0]Pincus T,Strand V,Koch G,et al.An index of the three core data set patient questionnaire measures distinguishes efficacy of active treatment from that of placebo as effectively as the American College of Rheumatology 20% response criteria(ACR20)or the Disease Activity Score(DAS)in a rheumatoid arthritis clinical trial[J].Arthritis Rheum,2003,48(3):625-630.
[1 1]Kirwan JR.The effect of glucocorticoids on joint destruction in rheumatoid arthritis[J].N Engl J Med,1995,333(3):142-147.
[1 2]van Everdingen AA,Jacobs JW,van Reesema DRS,et al. Low-dose prednisone therapy for patients with early active rheumatoid arthritis:Clinical efficacy,disease-modifying properties,and side effects:A randomized,double-blind,placebo-controlled clinical trial[J].Ann Intern Med,2002,136(1):1-12.
[1 3]Hoes J,Jacobs J,Verstappen S,et al.Adverse events of lowto medium-dose oral glucocorticoids in inflammatory diseases:A meta-analysis[J].Ann Rheum Dis,2009,68(12):1833-1838.
[1 4]Wood AJ,Cash JM,Klippel JH.Second-line drug therapy for rheumatoid arthritis[J].N Engl J Med,1994,330(19):1368-1375.
[1 5]Gorter S,Bijlsma JW,Cutolo M,et al.Current evidence for the management of rheumatoid arthritis with glucocorticoids:A systematic literature review informing the EULAR recommendationsforthe managementofrheumatoid arthritis[J].Ann Rheum Dis,2010,69(6):1010-1014.
[1 6]Gotzsche P,Johansen H.Short-term low-dose corticosteroids vs placebo and nonsteroidal antiinflammatory drugs in rheumatoid arthritis[J].Cochrane Database Syst Rev,2005,CD000189.
[1 7]Wassenberg S,Rau R,Steinfeld P,et al.Very low-dose prednisolone in early rheumatoid arthritis retards radiographic progression over two years:A multicenter,double-blind,placebo-controlled trial[J].Arthritis Rheum,2005,52(11):3371-3380.
[1 8]Jacobs JW,Everdingen AAV,Verstappen SM,et al.Followup radiographic data on patients with rheumatoid arthritis who participated in a two-year trial of prednisone therapy or placebo[J].Arthritis Rheum,2006,54(5):1422-1428.
[1 9]Montecucco C,Todoerti M,Sakellariou G,et al.Low-dose oral prednisone improves clinical and ultrasonographic remission rates in early rheumatoid arthritis:Results of a 12-month open-label randomised study[J].Arthritis Res Ther,2012,14(3):R112.
[2 0]Wilske K,Healey L.Remodeling the pyramid:A concept whose time has come[J].J Rheumatol,1989,16(5):565-567.
Efficacy and Safety of Low-dose Prednisone and Methotrexate in Treatment of Early Rheumatoid Arthritis
HUA Li,Wu Honghua,Du Hongwei.Department of Rheumatology,Zhejiang Jinhua Municipal Central Hospital, Jinhua(321000),China
ObjectiveTo investigate the clinical efficacy and safety of low-dose prednisone(PDN)combined with methotrexate(MTX)for previously untreated patients with early rheumatoid arthritis(ERA).MethodsIn a randomized,single-blinded,controlled study,60 patients with ERA were randomly assigned to receive low-dose PDN(<15 mg/d)plus MTX(7.5-20mg/w)or placebo plus MTX(7.5-20mg/w)for 12 weeks.Clinical variables were assessed at baseline and every 4 weeks.Adverse effects were documented every 4 weeks.The primary outcomes were the pro portion of patients meeting the American College of Rheumatology 20%improvement criteria(achieving an ACR20 response)and Disease Activity Score in 28 joints using the erythrocyte sedimentation rate(DAS28-ESR)at week 4, 8 and 12.The change from baseline in duration of pain,patient's global assessment,physician's global assessment, tender joint count,swollen joint count,health assessment questionnaire(HAQ),ESR and CRP were also evaluated.ResultsAt week 4,8,and 12,the ACR20 was achieved in 43.3%,66.7%,and 83.3%of patients receiving lowdose PDN plus MTX,compared with 16.7%,30.3%,and 43.3%of patients receicing placebo plus MTX(P<0.05,P<0.05,P=0.001).Significant differences in DAS28-ESR were noted between two groups at week 4,8 and 12(Ps<0.05).At week 12,other clinical variables improved better in low-dose PDN plus MTX group than in placebo plus MTX group(Ps<0.05)and the duration of RA before therapy was correlated with DAS28-ESR(r=0.643,P=0.000).ConclusionLow-dose PDN plus MTX can effectively reduce the signs and symptom of RA and is generally well tolerated by patients without significant increase in the rate of adverse events compared with MTX monotherapy.
early rheumatoid arthritis;low-dose prednisone;methotrexate;efficacy;safety
杜红卫,E-mail:229776872@qq.com
2013-12-05
2014-01-18

