多发性硬化患者血清尿酸水平
刘晓冰 赵 腾 李 敏 周春奎 刘晶瑶
(国土资源航空物探遥感中心卫生所,北京 100083)
多发性硬化(MS)是一种免疫介导的中枢神经系统脱髓鞘疾病,病变晚期轴索亦可受到破坏,其病因和发病机制尚不十分明确,复发率及致残率高。尿酸(UA)是嘌呤核苷酸代谢的终产物,是内源性的抗氧化剂和过氧化亚硝酸阴离子的天然清除剂。临床研究证实MS患者血清UA水平较低,同时给予UA治疗可抑制其病情发展〔1〕。本文探讨血清UA水平在MS发病中的作用机制。
1 资料与方法
1.1一般资料 ①MS组:根据Poster的MS诊断标准,选取2012年1月至2013年12月在我院神经内科住院的36例MS患者,男13例,女23例,年龄23~58岁,平均(34.7±7.2)岁;病前6个月未应用激素治疗。②正常对照组:30名健康体检者,男12例,女18例;年龄20~45岁,平均(32.2±8.7)岁。在性别和年龄方面MS组与对照组比较无统计学意义(P>0.05)。③排除标准:所有患者均无痛风、糖尿病、肾病、癫痫等合并疾病,近1个月无发热、感染史,未服用影响UA代谢的药物,如皮质醇、乙酰水杨酸、噻嗪类利尿剂等。
1.2方法 MS患者入院次日晨空腹采集外周静脉血2 ml,静置1 h后以4 000 r/min离心15 min,分离血清。采用酶定量分析法检测血清UA水平。正常血清UA值为210~430 μmol/L。所有患者给予甲泼尼龙500 mg/d,静注3 d,减量至250 mg/d,静注3 d;再减量至125 mg/d,静注3 d;后改为泼尼松60 mg/d,顿服;此后每周减5 mg,直至停服,其间激素治疗8 w时复查血清UA。
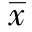
2 结 果
MS组UA值〔(216.45±51.36)μmol/L〕明显低于正常对照组〔(327.14±76.87)μmol/L〕(P<0.05),MS激素治疗8 w后血清UA升高至(248.06±49.37)μmol/L(P<0.05)。
3 讨 论
MS 是一种多因素相互作用共同致病的自身免疫性疾病,病因涉及遗传、环境及病毒感染等方面。近年来发现过氧化物是其病理机制中一个重要因素,其中过氧化氮是导致MS 的关键成分,可导致严重的髓鞘空泡形成和脱髓鞘现象,同时在斑块周围有硝基酪氨酸的形成〔2〕。UA是嘌呤核苷酸代谢的终产物,是内源性的抗氧化剂和过氧化亚硝酸阴离子(ONOO-)的天然清除剂。ONOO-具有极强的氧化性可直接损害神经组织,使得脑和脊髓髓鞘肿胀、脱髓鞘中的磷脂氧化丢失酪氨酸和半胱氨酸残基硝化作用增强,DNA断裂,破坏核酸、蛋白的体内的重要生物活性物质,促使细胞死亡,实验性自身免疫性脑脊髓炎研究证实,ONOO-可引起脱髓鞘和轴突损害〔3〕。正常机体UA水平处于一种稳定状态,ONOO-的清除主要依赖于UA。尿酸的保护机制〔4〕主要有以下几方面:(1) 尿酸可保护血脑屏障。MS的发病过程中血-脑脊液屏障的破坏是发病过程中的一个重要病理机制,炎性细胞在MS患者的脑组织病灶中主要存在于微血管周围,表明它们是从外周循环系统透过血脑屏障侵入中枢神经系统。由于血-脑脊液屏障的破坏,致敏的淋巴细胞可到达脑组织并诱发炎症反应。通常情况尿酸不易透过血-脑屏障,但在MS及EAE发病过程中由于血-脑屏障通透性增加,使尿酸易于到达损害部位并沉积。有学者研究〔5〕尿酸对脑组织炎症的影响发现,在EAE模型发病前使用尿酸治疗,尿酸可阻止免疫细胞进入脑内;对已发病的EAE模型使用尿酸治疗,尿酸可透过血-脑脊液屏障到达炎症区域,通过阻断ONOO-介导的自由基反应促进病变改善。(2)尿酸是过氧化亚硝酸盐的清除剂,可直接阻断其硝基化作用以及中和其氧化作用,减少细胞凋亡。
董艳玲等〔3〕学者研究认为尿酸水平与UA病程呈负相关,MS患者经激素治疗后随着血清UA水平的升高,神经功能缺损评分也随着降低;并推测血清UA水平与MS的病情活动或者与MS的分期有明确的关系,并且这种变化与激素的疗效也成正相关。但也有研究〔6〕认为MS的过氧化反应主要发生在中枢神经系统内,MS患者血清UA水平降低可能是MS的病理生理过程之一。头部磁共振成像(MRI)定量分析是评价MS患者病情变化最客观和最有效的手段〔7〕。赵红如等〔8〕对MS患者急性期、缓解期进行头部MRI及增强扫描结果进行分析发现,MS缓解期强化病灶数目显著减少,且强化病灶数目的变化与血清UA水平呈正相关。本研究认为UA对MS患者的中枢神经系统具有保护作用,可反映患者病情的活动性。 近年来,有关UA与中枢神经系统特发性炎性脱髓鞘疾病的相关研究颇多〔9〕。Toncev等〔10〕对63例MS病人进行多元回归分析提示,血清UA水平与疾病活动性、病程及EDSS评分有显著相关性。并认为UA有望成为MS活动性和预后的指标。而另有学者〔11〕认为UA水平与神经伤残程度之间的相关性不显著。
4 参考文献
1Hooper DC,Spitsin S,Kean RB,etal.Uric acid,a natural scavenger of peroxynitrite,in experimental allergic encephalomyelitis and multiple sclerosis〔J〕.Proc Natl Acad Sci USA,1998;95:675-80.
2惠红霞,陈 秀.尿酸与多发性硬化〔J〕.国外医学·神经病学神经外科学分册,2004;31(3):258-9.
3董艳玲,李吕力,李瑶宣,等.多发性硬化患者甲基强的松龙鞘内注射治疗前后血清尿酸水平变化及临床意义〔J〕.中国临床新医学,2011;4(1):14-6.
4李海峰,梁 兵,丛志强.多发性硬化和尿酸〔J〕.中国现代神经疾病杂志,2005;2(5):51-2.
5Hooper DC,Scott GS,Zborek A,etal.Uric acid,a peroxynitrite scavenger,inhibits CNS inflammation,blood-CNS barrier permeability changes,and tissue damage in a mouse model of multiple sclerosis〔J〕.FASEB,2000;14(5):691-8.
6Massa J,O’Reilly E,Munger KL,etal.Serum uric acid and risk of multiple sclerosis〔J〕.J Neurol,2009;256(10):1643-8.
7张 华,许贤豪,乔立艳,等.MRI定量分析及其在多发性硬化研究中的应用〔J〕.中国神经免疫学和神经病学杂志,2000;7(3):161-4.
8赵红如,董万利,方 琪,等.多发性硬化患者血清尿酸水平的变化及意义〔J〕.中国全科医学,2006;9(6):496-7.
9邱 菊,杜 静,朱 雷,等.中枢神经系统特发性炎性脱髓鞘疾病患者血清尿酸改变的临床分析〔J〕.中国临床神经科学,2013;21(5):543-7.
10Toncev G,Milicic B,Toncev S,etal.High-dose methylprednisolone therapy in multiple sclerosis increases serum uric acid levels〔J〕.Clin Chem Lab Med,2002;40(5):505-8.
11Drulovt J,Dujmovt I,Stojsavljevi N,etal.Uric acid levels in sera from patients with multiple sclerosis〔J〕.J Neurol,2001;248(2):121-6.

