解磷微生物的分离与筛选
钟传青,曹广祥,黄为一
(1.山东建筑大学市政与环境工程学院,山东 济南250101;2.山东省医药生物技术研究中心,山东 济南250062;3.南京农业大学 生命科学学院,江苏 南京210095)
0 引言
磷作为植物体内有机化合物的主要成分,有利于硝态氮的转化与利用,为生物固氮所必需,同时能促进植物体内碳水化合物的运输和淀粉的转化,因此,磷元素对于植物的光合作用、呼吸作用、脂肪代谢、氮代谢等都是不可缺少的[1]。然而我国耕地土壤中全磷的质量分数在0.2~1.1 g/kg土之间变动[2],许多土壤磷素严重供应不足,大部分磷以难溶态存在,不能被植物直接吸收利用。
微生物广泛存在于自然界比如土壤、空气和水等环境中,有的微生物能够分解或者富集土壤中的有毒物质,如石油烃、农药、重金属等[3-6];有的能够降解土壤中的纤维素、木质素等[7];少数微生物能够固定空气中的游离氮素[8],为植物提供营养;或者分泌生长素、激素等刺激植物生长的物质[9-11]。解磷微生物也是众多土壤微生物中的一种,该类微生物可以分泌磷酸酶及有机酸来促进土壤难溶磷向有效磷的转化[12-14],以促进植物的生长发育,缩短开花期,提高作物产量。
相关试验表明,施用解磷微生物肥料的土壤,其有效磷含量均有所增加[15]。解磷微生物的分离与筛选工作量大,因此建立简单、有效的筛选模型显得尤为重要。文中研究从全国部分省份、不同地区采样,采样地点涵盖山东、江苏、安徽、福建、江西、四川、陕西等省份,同一地区根据土壤类型、植被种类等选取不同地点进行采样,以从中分离和筛选能够转化难溶磷为有效磷的解磷微生物。研究结果表明在解磷微生物分离过程中,选用无机磷固体平板作为初筛模型,根据其溶磷圈有无及直径大小确定是否具有解磷作用,操作简便,成本低;然后进一步利用磷矿粉液体发酵试验为复筛模型确定具有较强解磷效果的菌株,为将其制成微生物菌剂提供了丰富的解磷微生物资源,同时为微生物磷肥的研究与开发奠定基础。
1 材料与方法
1.1 样品来源
从全国部分省份不同类型土壤中采样,共采集24个样品;同时选用不同植物种子,以其种皮作为分离解磷微生物的样品来源。
1.2 培养基
(1)培养基A采用0.25 g的七水合硫酸镁,10.00 g的葡萄糖,0.10 g的氯化钙,2.00 g的酵母膏,1000 mL的蒸馏水,15~20 g的琼脂,105℃灭菌30 min。另外将已灭菌的1 mL 10%的磷酸二氢钾溶液与10 mL 10%的氯化钙溶液混合,待出现大量白色沉淀后加入50 mL已灭菌的培养基A,并用0.1 mol/L的氢氧化钠溶液调节 pH值至 7.0,最后倒平板。
(2)培养基B采用0.30 g的七水合硫酸镁,0.03 g的七水合硫酸亚铁,0.03 g的一水合硫酸锰,5.00 g的磷酸钙,1000 mL的蒸馏水,pH值为7.0~7.5,20 g的琼脂,105℃灭菌30 min。
(3)培养基 C采用10.00 g的蛋白胨,5.00 g的牛肉膏,5.00 g的氯化钠,1000 mL的蒸馏水,pH值为7.2~7.4。121℃灭菌20 min。
(4)培养基 D采用10.00 g的葡萄糖,0.50 g的硫酸铵,0.30 g的氯化钠,0.30 g的氯化钾,0.30 g的七水合硫酸镁,0.03 g的 七水合硫酸亚铁,0.03 g的一水合硫酸锰,1000 mL的蒸馏水,5.00 g的磷矿粉,pH值为7.0~7.5,105℃灭菌30 min。
1.3 方法
1.3.1 解磷微生物的分离与初筛
称取10.00 g的待测土样,在超净工作台内将称好的土样放入装有90 mL无菌水的三角瓶中,28℃、200 rpm条件下振荡30 min后进行梯度稀释,在培养基 A固体平板涂布后28℃倒置培养48 h。将其中生长较快的微生物单菌落划线在培养基B固体平板上,镜检观察菌体形态是否一致,同时记录各菌株的生长状况、菌体形态以及对无机磷的利用情况。
1.3.2 解磷微生物的复筛
(1)种子液制备
将初筛时生长较快、溶磷圈较大的菌株进行活化,经镜检合格后将其接入装有50 mL培养基C的三角瓶中,28℃、200 rpm培养48 h后备用。
(2)磷矿粉液体发酵
按照10%接种量重新接入含有50 mL培养基D的三角瓶中。分别设空白(接入空白培养基D)、接灭活菌(接入含有等量菌体的灭菌发酵液)、接活菌三个处理,每个处理再设三个重复。将各三角瓶放于200 rpm的摇床上28℃下培养7 d。
(3)发酵液中可溶性磷含量的测定
发酵结束后将所有锥形瓶121℃灭菌40 min,加两滴6%H2O2后放入60℃水浴锅中水浴48 h,定量滤纸过滤后将其定容至55 mL。吸取15 mL滤液,4000 rpm离心10 min,吸5~10 mL上清于50 mL容量瓶中,同时另取容量瓶,吸取不同体积的标准溶液,将样品及标准溶液加水至30 mL。滴加两滴二硝基酚指示剂于上述容量瓶中,再加4 N氢氧化钠溶液至溶液变黄后滴加2 N硫酸1~2滴使其刚刚褪色。加5 mL钼锑抗试剂后加水定容,混匀。25~30℃显色0.5 h,用分光光度计700 nm进行比色,计算并记录有效磷的含量。
2 结果与分析
2.1 解磷微生物的分离
从微生物分离结果来看(见表1),在采集的土样中,解磷微生物数量较多,以细菌为主,其次为霉菌与酵母,解磷微生物种类丰富。菜园土与种子表面所含解磷微生物种类较多,可能是因为菜园土有机质丰富,能够给解磷微生物提供碳氮源及其他营养成分。不同类型、不同省份来源的土壤样品中解磷微生物种类与数量均不同,究其原因可能是土壤类型不同,然而样品有效磷总量与解磷微生物数量不呈正相关。为能够从中筛选出高效解磷微生物,满足植物对磷的需求,还需从以上微生物中筛选出解磷能力较强的微生物,制成微生物菌剂,用于农业生产。
2.2 解磷微生物的初筛与鉴定
将分离出的解磷菌株在培养基B上划线,根据其生长速度、溶磷圈大小等筛选出生长较快、解磷效果较好的菌株。在平板上生长48 h的部分微生物菌落特征如图1所示,括号内是根据菌株形态学与生理生化特征研究进行初步鉴定,将菌株鉴定到属的结果。结果表明:由模型分离出的解磷微生物有细菌、霉菌、酵母等,这些微生物能够溶解培养基中的难溶磷,使平板产生透明溶磷圈。溶磷圈是解磷微生物的特征之一,有溶磷圈的微生物能够溶解培养基中的难溶磷,从而产生透明圈;溶磷圈的大小与其生物量有关。培养基A能够产生磷酸三钙、磷酸氢钙、磷酸二氢钙,以及少量的氢氧化钙,因此如果能够在培养基A上产生透明圈,说明该微生物能够溶解其中的沉淀,具有解磷能力。
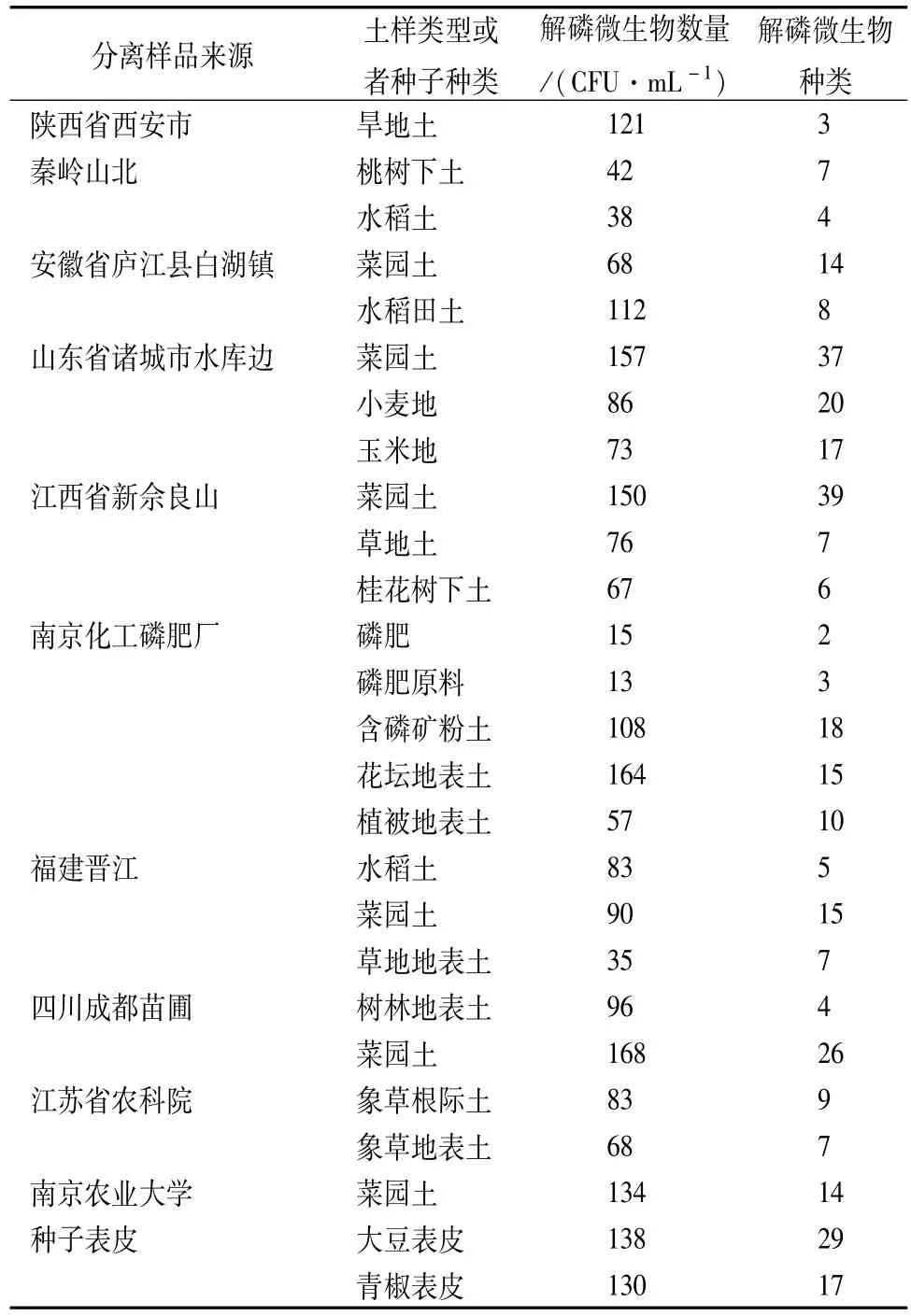
表1 不同来源解磷微生物的数量和种类分布
2.3 解磷微生物的复筛
部分溶磷微生物的复筛结果见表2。微生物的解磷能力需要通过复筛试验进一步确定其对难溶磷的溶解能力,初筛得到的解磷微生物,能够溶解培养基A产生的磷酸三钙、磷酸氢钙等,如果微生物能够分泌酸,也会产生透明圈;另一方面,有的解磷微生物虽然不能溶解磷酸三钙,也有可能对其他难溶磷比如磷酸铁、磷酸铝等有溶解效果,因此需要进一步通过复筛试验确认其解磷效果。接灭活菌是为了排除因接菌处理带入的微生物量磷及其代谢产物引起难溶磷的溶解,接菌处理有效磷含量与接培养基对照的比值反应了该微生物的溶磷效果。经分析可知,P17、Y3、P10、P103、F4等菌株溶磷效果均较好。培养基D中的磷矿粉,可以更换为其他难溶性磷源,从而确认待测微生物对不同难溶磷的溶解效果。
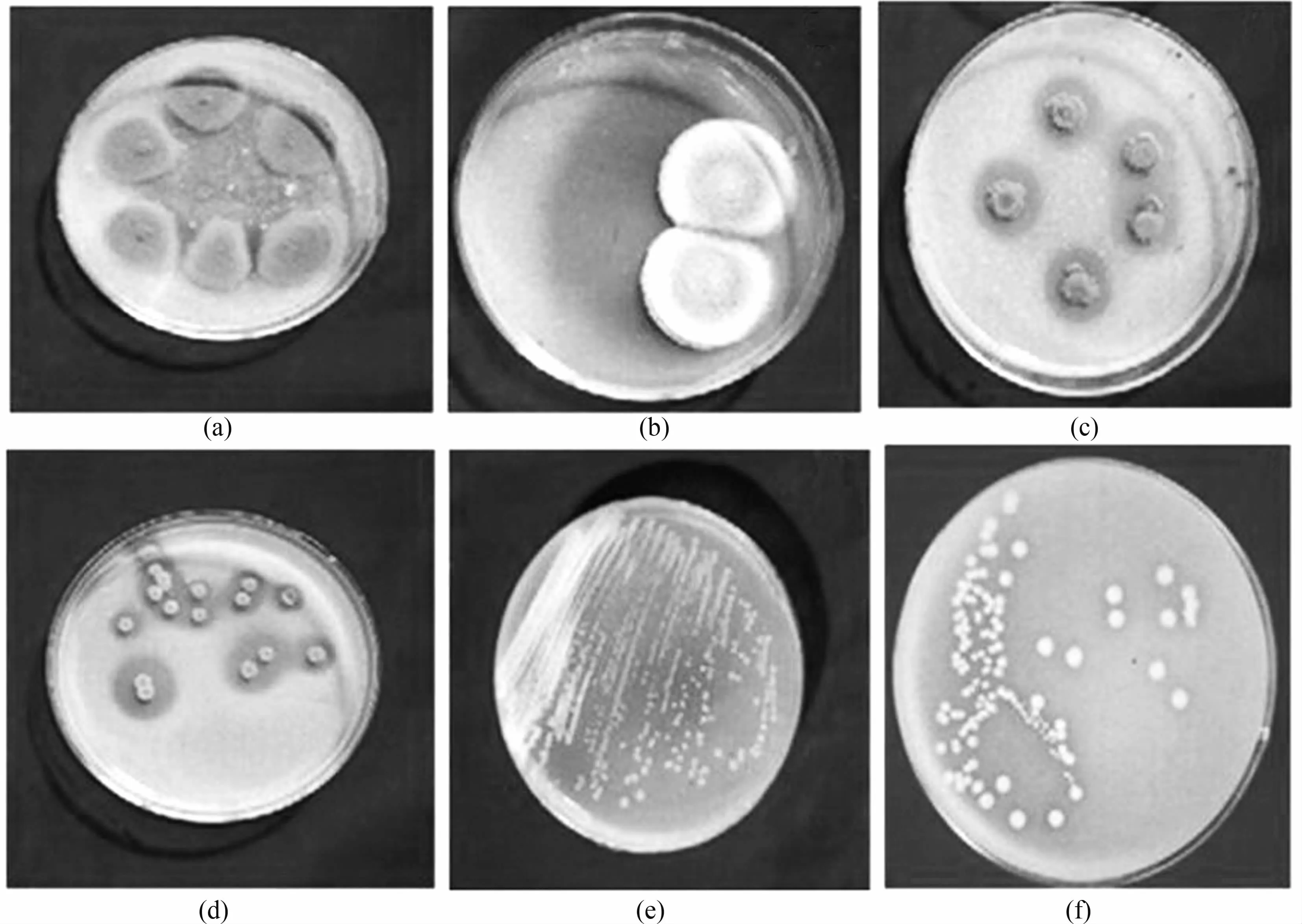
图1 样品中分离出的解磷微生物(a)霉菌 P103(木霉属);(b)霉菌 P128(曲霉属);(c)霉菌 F4(青霉属);(d)酵母Y3(红酵母属);(e)细菌P10(短杆菌属);(f)细菌P17(芽孢杆菌属)
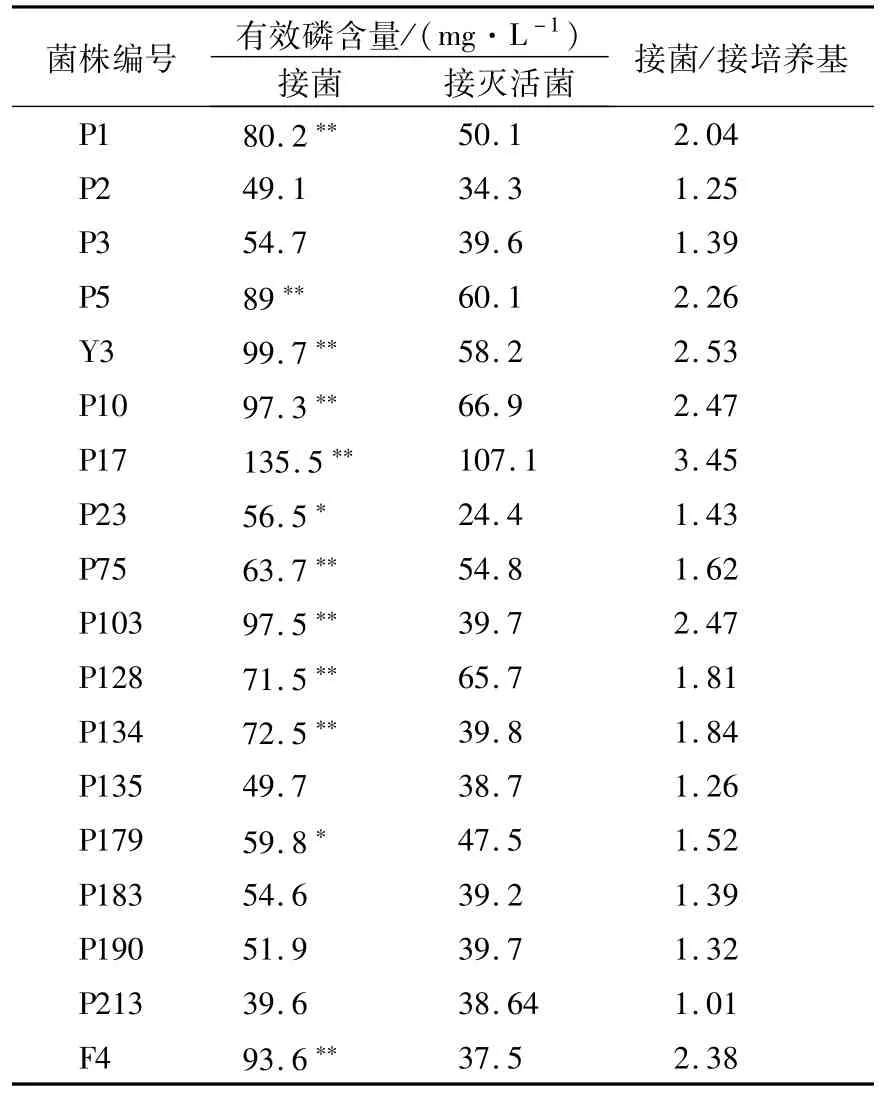
表2 溶磷微生物的复筛结果
3 结论
文章从来自全国各地26个样品中分离出2000多株解磷微生物,确立了能够有效分离解磷微生物的筛选模型。这些解磷微生物包括细菌、霉菌和酵母等,其中菜园土中有机质含量高,解磷微生物数量较多,四川苗圃菜园土中解磷微生物高达168 CFU/mL;种子表皮如大豆表皮中解磷微生物数量高达138 CFU/mL。不同省份、不同类型的土壤样品中解磷微生物种类和数量存在显著差异。通过解磷微生物的初筛和复筛模型分别筛选到木霉P103、曲霉P128、青霉F4、短杆菌P10、红酵母Y3和芽孢杆菌P17等多株高效解磷微生物,对于溶磷效果较好的微生物,需要进一步研究其是否具有植物病原性,以及是否能够分泌促进植物生长的代谢产物与激素等,为将其用于实际农业生产奠定理论基础。
[1] Zhao J.,Wang F.,Li J.,et al.Effects of experimental nitrogen and/or phophorus additions on soil nematode communities in asecondary tropical forest[J].Soil Biology and Biochemistry,2014,75:1-10.
[2] GilesC.D.,Hsu P.,Richardson A.E.,etal.Plantassimilation of phosphorus from an insoluble organic form is improved by addition of an organic anion producing Pseudomonas sp.[J].Soil Biology and Biochemistry,2014,68:263-269.
[3] Zhang G.L.,Wu Y.T.,Qian X.P.,et al.Biodegradation of crude oil by Pseudomonas aeruginosa in the presence of rhamnolipids[J].Journal of Zhejiang University,2005,6B(8):725-730.
[4] Okerentugba P.O.,Ezeronye O.U.Petroleum degrading potentials of singleandmixedmicrobial cultures isolated from riversand refinery effluent in Nigeria[J].African Journal of Biotechnology,2003,2(9):288-292.
[5] Augustine C.A.,Malay C..Degradation of pesticides chlorpyrifos,cypermethrin and chlorothalonil in aqueous solution by TiO2photocatalysis[J].Journal of Environmental Management,2013,130(30):160-165.
[6] 孔进,李哿,刘连光.固定藻技术在污水处理领域的研究进展[J].山东建筑大学学报,2010,25(1):79-84.
[7] Daisuke S.,Masahiko M.,Kengo S.,et al.Acceleration of cellulose degradation and shift of product via methanogenic coculture of a cellulolytic bacterium with a hydrogenotrophic methanogen[J].Journal of Bioscience and Bioengineering,2012,114(4):435-439.
[8] Sushma G.,Parab S.G.,Matondkar P.Primary productivity and nitrogen fixation by Trichodesmium spp.in the Arabian Sea[J].Journal of Marine Systems,2012,105:82-95.
[9] 朱丽霞,章家恩,刘文高.根系分泌物与根际微生物相互作用研究综述[J].生态环境,2003,12(1):102-105.
[10] Agarwal M.K..Receptors for mammalian steroid hormones in microbes and plants[J].FEBS Letters,1993,322(3):207-210.
[11] Li Y.,Huang F.,Lu Y.,et al.Mechanism of plant-microbe interaction and its utilization in disease-resistance breeding for modern agriculture[J]. Physiological and Molecular Plant Pathology,2013,83:51-58.
[12]钟传青,黄为一.P17菌株产生磷酸酶的影响因素及其定域研究[J].山东建筑大学学报,2012,27(1):32-35.
[13]钟传青,黄为一.提高磷矿粉肥效的生物学途径[J].化肥工业,2002,29(2):15-17.
[14]Rodriguez H.,Fraga R.G..Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria[J].Plant and Soil,2006,287:15-21.
[15]金术超,杜春梅,平文祥,等.解磷微生物的研究进展[J].微生物学杂志,2006,26(2):73-78.

