饲料中添加益生菌或植物提取物对凡纳滨对虾生长、免疫力及抗病力的影响
■刘泓宇 李 正 孙武卫 谭北平 董晓慧 迟淑艳 杨奇慧
(1.广东海洋大学水产学院,广东湛江524088;2.建明工业(珠海)有限公司,广东珠海519040)
凡纳滨对虾(Litopenaeus vannamei)又名南美白对虾,是中国重要的养殖品种,也是中国出口创汇的主要种类之一。近年来由于高密度养殖、水体污染和种苗体质脆弱等因素导致虾病爆发造成产量下降。为了提高虾的成活率和产量,养殖户不得不大量使用药物,特别是抗生素和其他违禁药物的使用,最终导致药物残留,不但影响了对虾产业持续健康稳定发展,也不利于中国生态农业的建设与发展。寻找一种有利于水产动物健康生长,而又不危害食品安全是解决当前水产动物生长与食品安全之间矛盾的重要途径。目前,已有学者做了相关方面的研究[1-9],发现益生菌和植物提取物不但能促进水产动物存活和生长[10-11],也能提高水产动物免疫力[9,12-13],在动物体内无残留,也不产生抗药性。益生菌替代抗生素已经成为当前研究热点[14-15]。
益生菌(Probiotics)是一种有取代或平衡生态系统中一种或多种菌系作用的微生物添加物,即通过补充动物消化道内的有益微生物,改善消化道菌群平衡而对动物产生有益作用,迅速提高机体的抗病能力、代谢能力和对饲料的消化吸收能力,达到防治消化道疾病和促进生长双重作用的微生物饲料添加剂[16]。近几年,益生菌的生产和使用量飞速增长[14],益生菌的使用可减少抗生素的用量,有利于生态平衡。其作用机理是为动物生长提供营养、增强免疫功能,预防水产动物疾病发生、分解有机物,净化水质,改善养殖生态环境和生物夺氧[17-18]。植物提取物系从植物中提取,活性成分明确,可测定,含量稳定,对动物和人类没有任何毒副作用,并已通过动物试验证明,可改善动物生产性能的饲料添加剂的统称,可长期使用。植物提取物中的化学活性物质还可抗菌、杀菌、抗氧化,保证动物肠道健康、提高自身免疫机能[19],其在水产动物上的应用和研究较少。为提高中国凡纳滨对虾产量,防治病害的发生,减少抗生素的使用,我们从凡纳滨对虾肠道分离出了益生菌菌株S12,经鉴定为枯草芽孢杆菌(Bacillus subtilis),对副溶血弧菌(Vibrio Parahaemolyticus)、溶藻弧菌(Vibiro alginolyticus)等多种致病性弧菌均具有较强的抑制效果,同时运用了植物提取物(RapXOL,经过特殊工艺包被的植物精油,主要成分包括牛至油、肉桂醛等)对沙门氏菌(Salmonella)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphyloccocus aureus Rosenbach)等致病菌具有显著的抑制效果。本试验研究了凡纳滨对虾饲料中添加益生菌S12和植物提取物对凡纳滨对虾的生长、免疫力和抗病力的影响,以期为益生菌和植物提取物产品在凡纳滨对虾健康养殖中的推广应用和对虾配合饲料开发提供参考。
1 材料与方法
1.1 试验饲料
在基础饲料(表1)中分别添加0.3%抗生素(氟苯尼考Florfenicol,抗生素对照组)、200 mg/kg植物提取物 (RapXOL)、益生菌S12(PS1:5×109cfu/kg;PS2:5×1010cfu/kg;PS3:5×1011cfu/kg)共配制6种等氮等能饲料,各种大宗原料过筛(80目),按照配方准确称取原料,混匀,用双螺杆压条机挤压出直径分别为1.0 mm和1.5 mm两种粒径的饲料,90℃熟化30 min后,自然风干。风干后的饲料贮存于-20℃的冰柜中。

表1 基础饲料配方及营养成分(%)
1.2 试验分组与饲养管理
养殖试验在广东海洋大学东海岛海洋生物研究基地进行。试验用虾为湛江东海岛国联育苗场第一代SPF虾苗。共设6个处理组,每个处理组4个重复,每个重复放40尾[(0.4±0.01)g/尾],前3周投喂1.0 mm粒径的饲料,后5周投喂1.5 mm粒径的饲料。每天投喂4次。试验期间盐度维持在30,水温维持在(22±3)℃,连续充气,换水次数随虾的大小而变化,养殖前期换水次数少,后期每天换水一次。每天观察对虾蜕壳、生长情况,每周随机抽取1个养殖桶虾称重,作为调整投饲量的依据。试验为期8周。
1.3 攻毒试验
此试验共攻毒2次,中期在试验进行到第4周,每桶随机抽取8尾虾,末期试验结束后,每桶随机抽取10尾虾。病原菌为哈维氏弧菌(Vibrio harveyi)(广东海洋大学广东省水产经济动物病原生物学和流行病学重点实验室提供),在对虾第2、第3腹节间肌肉注射。根据攻毒前预试验结果,中期攻毒哈维氏弧菌浓度为5.0×107cells/ml,每尾虾注射20 μl,后期哈维氏弧菌浓度为3.4×107cells/ml,每尾虾注射30 μl。攻毒后继续投喂饲料,统计每日的死亡率,持续2周,并计算累计死亡率和免疫保护率。
免疫保护率(%)=100×(1-免疫组累计死亡率/对照组累计死亡率)。
1.4 采样与分析
试验结束前1 d停止投喂饲料,称取质量并计数,随机抽取10尾用于攻毒外其余用于取血,取完血的虾分装好用于虾体成分分析。饲料常规分析和虾体成分分析参照《饲料分析与检测》[20]。同时计算成活率、增重率(WG)、特定生长率(SGR)和饲料系数(FCR)。
WG(%)=(Wf-Wi)/Wi×100;
SGR(%/d)=[(lnWf-lnWi)/T]×100;
FCR=Wt/(Wf-Wi)。
式中:Wf—— 表示平均终体质量(g);
Wi——平均初体质量(g);
T——饲养时间(d);
Wt——试验期间投入饲料量(g)。
1.5 免疫指标的测定
抽取对虾血淋巴后加ACD抗凝剂,用于血细胞计数和吞噬活性测定,同时另外抽取血淋巴不加入抗凝剂,用于血清免疫指标测定,不加抗凝剂血淋巴4℃静置过夜,以8 000 r/min离心10 min,取上清,-20℃下保存备用。
血细胞计数(THC)测定采用谭北平等[21]等的方法。在试验条件下,以每毫升血淋巴中的血细胞数定义。
吞噬率采用刘慧杰等[22]的方法。在试验条件下,以100个总血细胞中吞噬菌的细胞与100个总血细胞比值定义。
酚氧化酶(PO)活力测定采用王雷等[23]的方法。在试验条件下,以每分钟增加0.001定义为一个酶活单位。
抗菌活力的测定以哈维氏弧菌为底物,采用王雷等[23]的方法。
溶菌酶(LSZ)活力的测定以溶壁微球菌(Micrococus lysoleikticus)冻干粉为底物,采用Jorgensen等[24]的方法。
超氧化物歧化酶(SOD)活力使用南京建成试剂盒测定。血清中SOD酶活力单位定义为每毫升血清中SOD抑制率达到50%所对应的SOD量为1个酶活性单位。
1.6 数据统计
试验数据以“平均值±标准差(x±SD)”表示,试验结果用SPSS软件包(版本16.0)进行单因素方差分析(ANOVA分析),当单因素方差分析处理之间差异显著(P<0.05)时,用Tukey's检验进行多重比较分析。
2 结果
2.1 对凡纳滨对虾生长性能的影响(见表2)

表2 凡纳滨对虾成活率、增重率、特定生长率和饲料系数
由表2可知,对虾成活率介于94.4%~98.9%。与空白对照组相比,添加植物提取物和益生菌可不同程度地提高对虾成活率,其中PS1和PS3组的成活率显著提高(P<0.05);对虾增重率为1 342.47%~1 434.07%,其中抗生素组显著高于空白对照组(P<0.05);特定生长率为4.77%/d~4.87%/d,同样为抗生素组显著高于空白对照组(P<0.05);饲料系数为1.10~1.12,抗生素组显著低于空白对照组(P<0.05),但各试验组之间无显著差异(P>0.05)。
2.2 虾体成分(见表3)

表3 添加植物提取物和益生菌对凡纳滨对虾营养成分的影响(%)
PS1组虾的水分质量分数显著低于空白对照组(P<0.05);添加植物提取物显著提高对虾体蛋白(P<0.05),而添加益生菌对虾体蛋白质含量的影响不显著;添加益生菌显著降低虾体脂肪(P<0.05);各试验组之间虾体灰分无显著差异(P>0.05)。
2.3 免疫指标(见表4)

表4 添加植物提取物和益生菌对凡纳滨对虾免疫功能的影响
添加抗生素、植物提取物和益生菌对凡纳滨对虾血细胞数,溶菌酶、酚氧化酶、SOD活力和抗菌活力均有一定提升作用(表4)。抗生素对照组中血细胞数显著高于其他试验组(P<0.05),其他试验组之间无显著差异。空白对照组吞噬率显著低于其他试验组(P<0.05),PS2和PS3组与抗生素对照组相比差异不显著。空白对照组溶菌酶活力显著低于其他试验组(P<0.05)。添加植物提取物和益生菌显著提高虾SOD活性(P<0.05)。除PS1组外,空白对照组抗菌活力显著低于其他试验组(P<0.05),PS3组显著高于抗生素对照组(P<0.05)。除PS1组外,空白对照组酚氧化酶活力显著低于其他试验组(P<0.05),其他各试验组间差异不显著(P>0.05)。
2.4 免疫力(见表5及图1)

表5 饲料中添加植物提取物和益生菌对凡纳滨对虾感染哈维氏弧菌相对免疫保护率的影响
在第4周和第8周分别进行了1次攻毒试验以分析生长期内益生菌的效价。统计了对虾感染哈维氏弧菌14 d后的累积死亡率。中期攻毒结果显示,至攻毒后第14 d,空白对照组对虾累积死亡率为45.8%,显著高于其他试验组(除植物提取物组和PS1组)(P<0.05),而其他组间差异不显著。计算了相对于空白对照的各组相对免疫保护率,以抗生素对照组免疫保护率最高,显著高于其他试验组(P<0.05),植物提取物组最低,显著低于其他实验组(P<0.05)。PS组间免疫保护率差异不显著。
末期攻毒试验结果显示,至攻毒后第14 d,空白对照组累积死亡率为83.3%,显著高于其他组(P<0.05)。植物提取物组累积死亡率显著高于抗生素对照组和益生菌组(P<0.05),抗生素对照组与益生菌组相比差异不显著。计算了相对于空白对照组的各组相对免疫保护率,以植物提取物组免疫保护率最低,显著低于其他试验组(P<0.05),其他各组间差异不显著。
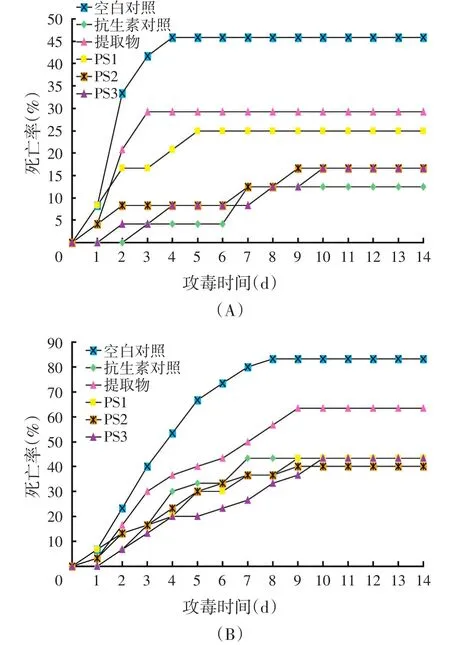
图1 凡纳滨对虾4周(A)和8周(B)时感染哈维氏弧菌累积死亡率
3 讨论与结论
在此研究中,饲料添加植物提取物和益生菌可不同程度提高对虾的成活率、增重率和特定生长率,饲料中添加益生菌S12可显著提高凡纳滨对虾的成活率,与斑点叉尾鮰(Ictalurus punctatus)[25]、凡纳滨对虾(L.vannamei)[26,6]、暗纹东方鲀(Fugu obscurus)[27]和鲤鱼(Cyprinus carpio)[9]中的研究结果相似。植物提取物和益生菌对凡纳滨对虾的促生长机理,可能是由于植物提取物和益生菌能提高对虾肠道消化酶活性和改善肠道菌群[6,26-27],从而提高凡纳滨对虾对饲料的摄食和消化能力;同时益生菌在其生长和繁殖过程中,能自身合成VC、VB1、VB2和VB6以及氨基酸等营养物质,为动物提供营养物质[25],最终促进凡纳滨对虾成活率的提高和生长率加快。芽孢杆菌菌株因为能够形成孢子,对环境物理和化学因子作用具有较强抗性,因而被广泛用作益生菌。通常芽孢杆菌菌株能够产生胞外酶,在很大程度上与海洋环境相关联。例如,芽孢杆菌可从甲壳动物和双壳类动物的肠道分离得到。本试验结果与胡毅等的研究结果一致[6]。芽孢杆菌属益生菌,对多种鱼类病原体可表现出较强的抑制活性;同时益生菌能够产生消化酶和生长所需的营养物质如维生素和氨基酸,从而可改善饲料的吸收,进而促进动物的生长。
水分、蛋白质、脂肪、矿物元素是机体组分,其含量体现了机体的营养价值。王彦波[28]添加益生菌B.coagμlans显著降低罗非鱼肌肉脂肪含量,但对粗蛋白、灰分和水分无显著影响。仇明等[25]添加枯草芽孢杆菌显著降低斑点叉尾鮰肌肉灰分含量,但对粗蛋白、水分无显著影响。此研究中,添加益生菌S12显著降低对虾的全虾脂肪和PS1组全虾水分,对蛋白质、灰分无显著影响。与空白对照组相比,添加200 mg/kg植物提取物显著提高全虾蛋白质的含量,对水分、脂肪和灰分的含量无显著影响;益生菌S12显著降低对虾全虾脂肪可能是在益生菌的作用下,通过一系列的酶反应,导致机体的脂肪代谢加强,脂肪酸合成速度被抑制,最终降低了体脂沉积[28]。植物提取物显著提高全虾蛋白质可能是其抑制有害菌活性,改善了机体对营养素的消化吸收,减少了营养物质损耗,最终提高了体蛋白质沉积。
甲壳动物的免疫机制属于非特异性免疫,主要由血细胞以及存在于血细胞或从血细胞释放到血淋巴中的活性因子形成的,以抵御病原体侵入。血细胞数(THC)、溶菌酶(LSZ)、酚氧化酶(PO)、超氧化物歧化酶(SOD)活力和抗菌活力是衡量对虾免疫能力的重要指标,在对虾免疫过程中发挥重要作用。在此研究中,添加植物提取物和益生菌能不同程度地提高对虾血细胞数、吞噬率、溶菌酶、酚氧化酶、SOD和抗菌活力活性。PS2和PS3组的SOD、PS3组抗菌活力显著高于抗生素对照组,植物提取物组除溶菌酶和抗菌活力外都低于抗生素组,推测其含量可能未达到应有的水平,致使未能达到与抗生素相似的效果。攻毒结果显示,与空白对照组相比,添加益生菌第4周(除PS1组外)和第8周时显著降低感染哈维氏弧菌的对虾累积死亡率,添加植物提取物第8周时显著降低感染哈维氏弧菌的对虾累积死亡率;在末期(第8期)攻毒试验中抗生素组和益生菌对感染哈维氏弧菌的对虾的累积死亡率和免疫保护率都无显著性差异。Rengpipat等添加芽孢杆菌提高了斑节对虾酚氧化酶和抗菌活力[8];Kim等[12]添加益生菌能促进了虹鳟(Oncorhynchus mykiss)特异性免疫能力;Salinas等[29]添加益生菌提高了乌颊鱼(Gilthead Seabream)的特异性免疫能力;缪凌鸿等[9]添加植物提取物提高了鲤(Cyprinus carpio)的抗病能力。本试验中,与抗生素对照组相比,第4周试验组各组的累积死亡率无显著性差异,但试验组均高于抗生素对照组;第8周益生菌各处理组累积死亡率与抗生素对照组无显著性差异,且小于或等于抗生素对照组。说明益生菌在凡纳滨对虾体内定植并发挥免疫激活功能具有时间积累效应,充分的投喂周期可保证益生菌在凡纳滨对虾体内发挥免疫激活作用。综上研究表明,植物提取物和益生菌可作为良好的免疫激活剂,通过激发机体的体液免疫和细胞免疫以增强机体免疫机能[6]。
在本试验条件下,添加植物提取物显著提高全虾蛋白质含量,添加益生菌显著降低饲料中脂肪含量。添加植物提取物和益生菌显著提高了凡纳滨对虾免疫能力,可作为良好的免疫增强剂。以存活率、免疫指标和免疫保护率为指标,饲料中益生菌S12最适添加量为5×1010cfu/kg,至于饲料中植物提取物的最适添加量,尚待进一步研究。

