饲料中添加抗菌脂肽对吉富罗非鱼生长性能和肠道消化酶活性的影响
■史庆超 卢俊姣 陆 鹏 郭清雄 翟少伟
(1.集美大学农业部东海海水健康养殖重点实验室,福建厦门361021;2.福建正源饲料有限公司,福建莆田351100)
近年来,水产养殖病害频发,使用抗生素的种类增多,剂量越来越大,造成动物肠道菌群破坏,体内药物残留和耐药性菌株产生,各个国家对抗生素等药物的限制日趋严格。
因此,研发安全环保、促生长且无残留的抗生素替代品迫在眉睫。来自动、植物和微生物的抗菌肽因具有分子量小、水溶性好、耐热性强、无免疫原性、无毒副作用、无残留且不易产生耐药性等优点[1],被认为是最佳抗生素替代品。但是动物源抗菌肽的抗菌谱较窄,通常大多抑制革兰氏阳性菌[2],且多为基因重组后所得,应用于水产动物中可能存在饲料安全问题。抗菌脂肽(antimicrobial lipopeptides,AMI)是由枯草芽孢杆菌(Bacillus subtilis)天然发酵产生的一种微生物源抗菌肽,与动物源抗菌肽相比,抗菌谱更广,对抗细菌[3]、真菌[4]、病毒[5]、原虫[6]、支原体[7]和肿瘤[8]均有抑制作用。都海明等[9-10]研究发现,AMI还可以提高AA肉鸡和断奶仔猪的生产性能。目前已报道的应用于水产动物饲料中的抗菌肽主要有天蚕素抗菌肽[11]、家蝇抗菌肽[12]、对虾抗菌肽[13]。关于AMI在水产动物饲料中的应用研究未见报道。本试验以吉富罗非鱼(genetic improvement of farmed Tilapia,GIFT,Oreochromis niloticus)为研究对象,探讨AMI对吉富罗非鱼生长性能和肠道消化酶活性的影响,为AMI作为新型抗生素替代品的应用提供参考依据。
1 材料与方法
1.1 试验动物与试验设计
试验用吉富罗非鱼购于福建省漳州市水产开发中心。暂养2周后,将320尾健康无病、规格均匀、平均体重为(9.39±0.03)g的吉富罗非鱼随机分为4个处理组(每个处理组4个重复,每个重复20尾鱼),分别投喂在基础饲料中添加 0(对照组)、12.5、25 mg/kg和50 mg/kg AMI(由福建正源饲料有限公司提供)的试验饲料。试验在福建正源饲料鱼类养殖试验场进行,试验期为7周。
1.2 基础饲料与饲养管理
基础饲料根据SC/T 1025—2004《罗非鱼配合饲料》配制,其组成及营养水平见表1。所有饲料原料粉碎过40目筛,混合均匀后挤压成直径为3 mm的颗粒料,自然风干后置于自封袋中,-20℃冷冻保存。
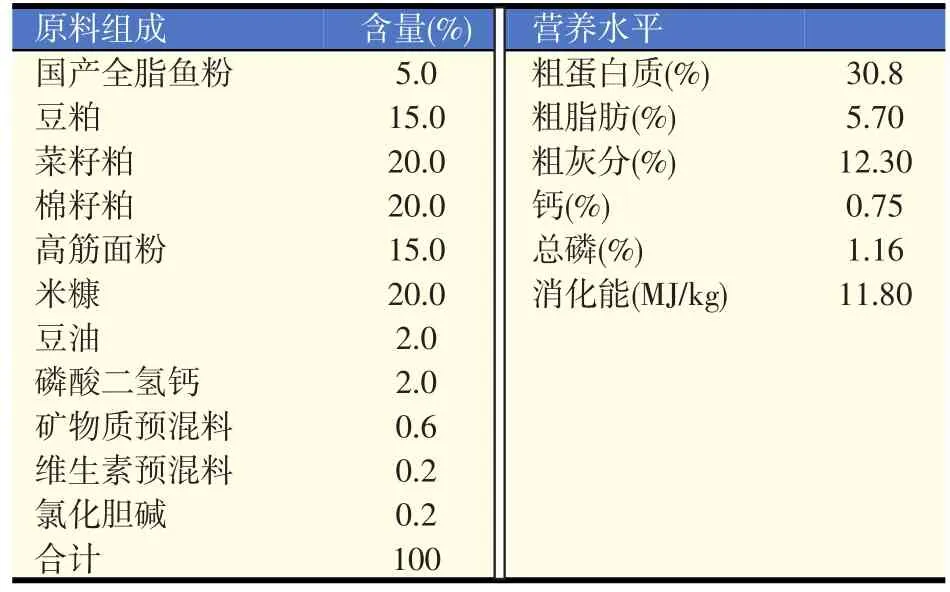
表1 基础饲料组成及营养水平(风干基础)
试验鱼以重复为单位饲养于120 cm×60 cm×70 cm的水族箱中,实际水体积约为100 L,开循环水系统,24 h充气。日投饵量为鱼体重的3.0%~5.0%,每日投喂3次(08:00、13:00和18:00),每次饱食投喂,饲料基本无浪费。投喂30 min后吸取残饵和粪便,日换水量为30%。试验用水为曝气自来水,光照为自然光源,增氧机持续增氧。每天监测水质状况。试验期间水温22~28 ℃,pH值7.5±0.3,溶氧浓度>7.0 mg/l,氨氮浓度<0.2 mg/l。
1.3 样品采集与组织匀浆的制备
试验结束后,禁食24 h,捞取每个水箱中所有试验鱼称总重;每缸随机选择6尾规格一致的试验鱼,麻醉后尾静脉取血,采集后立即离心(3 000 r/min,10 min),取血清保存于-80℃冰箱。采血后的试验鱼解剖,取肠道,液氮速冻后-80℃冷冻保存。去除内脏团后的部分放入自封袋,于-20℃下保存,用于测定鱼体成分。
将保存于-80℃的肠道组织样品在冰上解冻,取组织块1~3 g在0.86%冰冷生理盐水中漂洗,除去血液,滤纸拭干,称重,放入匀浆玻璃管中,按比例(1 g样品∶10 ml生理盐水)加入0.86%冰冻生理盐水,用玻璃匀浆机匀浆(10 s/次,间隙30 s,连续3~5次)。将制备好的10%组织匀浆在4℃下3 000 r/min离心10 min,取上清液分到1.5 ml离心管中。
1.4 测定指标与方法
1.4.1 生长指标
日摄食量(DFI,g/尾)=F/t;
增重率(WGR,%)=100×(Wt-W0)/W0;
特定生长率(SGR,%/d)=100×(lnWt-lnW0)/t;
饲料系数(FCR)=F/(Wt-W0);
日摄食率(FR,%)=100×F/[(W0+Wt)/2]/t。
式中:W0——初始体重(IBW,g/尾);
Wt——终末体重(FBW,g/尾);
F——平均每尾鱼摄食饲料总量(风干样重)(g);
t——饲喂天数(d)。
1.4.2 肠道消化酶活性
肠道蛋白酶活性的测定采用福林-酚试剂法,以磷酸二氢钠-磷酸氢二钠缓冲液调节pH值,680 nm处测吸光值。肠道脂肪酶和淀粉酶活性采用南京建成生物工程研究所提供的试剂盒进行测定。
1.5 统计与分析
所有试验数据均以“平均值±标准差(mean±SD)”表示,用SPSS 17.0分析软件进行单因素方差分析(one-way ANOVA),若存在显著的差异,则采用Duncan's法进行多重比较,P<0.05表示差异显著。
2 结果
2.1 饲料中添加AMI对吉富罗非鱼生长性能的影响(见表2)
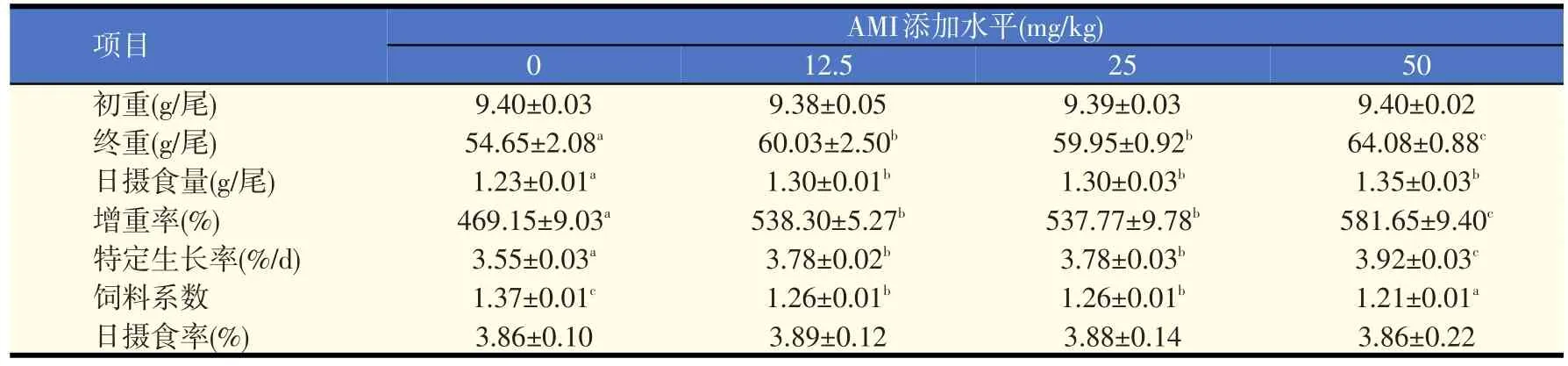
表2 饲料中添加AMI对罗非鱼生长性能的影响
由表2可知,各AMI添加组的FBW(终末体重)、WGR、SGR和DFI均显著高于对照组(P<0.05),FCR显著低于对照组(P<0.05),50 mg/kg添加组的FBW、WGR和SGR显著高于12.5 mg/kg和25 mg/kg添加组(P<0.05),FCR显著低于12.5 mg/kg和25 mg/kg添加组(P<0.05),12.5 mg/kg和25 mg/kg添加组间的FBW、WGR、SGR和FCR无显著差异(P>0.05),各AMI添加组间DFI无显著差异(P>0.05)。各试验组间FR无显著差异(P>0.05)。
2.2 饲料中添加AMI对吉富罗非鱼肠道消化酶活性的影响(见表3)
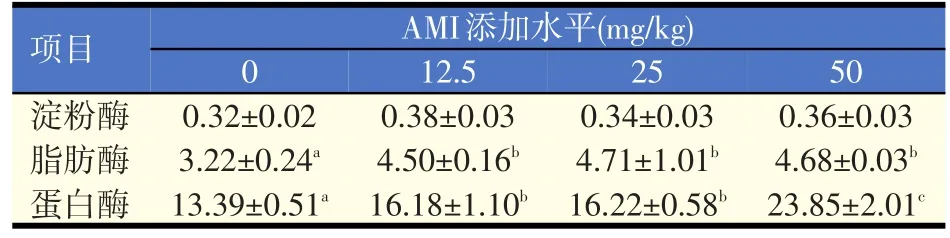
表3 饲料中添加AMI对罗非鱼肠道消化酶活性的影响(U/mg prot)
由表3可知,各AMI添加组脂肪酶和蛋白酶活性显著高于对照组(P<0.05),各AMI添加组间脂肪酶活性无显著差异(P>0.05),50 mg/kg添加组蛋白酶活性显著高于12.5 mg/kg和25 mg/kg添加组(P<0.05),12.5 mg/kg和25 mg/kg添加组间蛋白酶活性无显著差异(P>0.05);各试验组间淀粉酶活性无显著差异(P>0.05)。
3 讨论
本研究结果显示,饲料中添加12.5~50 mg/kg AMI可显著提高吉富罗非鱼的WGR和SGR,并显著降低FCR,表明饲料中添加AMI能够促进吉富罗非鱼的生长,提高饲料利用率。目前,微生物源抗菌肽在鱼类饲料中的应用研究鲜见报道,而动物源抗菌肽在鱼类饲料中应用较多。姜珊等[14]研究表明,在饲料中添加5~10 mg/kg对虾抗菌肽可以提高吉富罗非鱼幼鱼WGR;Zhou等[15]报道,饲料中添加15~30 mg/kg蜜蜂抗菌肽可以显著提高鲤鱼WGR,并显著降低FCR;林鑫等[16]在饲料中添加150 mg/kg天蚕素抗菌肽有利于提高锦鲤的SGR;陈冰等[12]在凡纳滨对虾饲料中添加3 000 mg/kg家蝇抗菌肽,WGR得到显著提高。可见,饲料中添加适量的抗菌肽对水产动物均具有促生长作用。关于AMI对吉富罗非鱼的促生长机理尚不明确,可能与其他抗菌肽类似,通过以下途径提高动物的生长性能:①通过作用靶点,即嗜水气单胞菌和大肠杆菌等有害菌的细胞膜上穿孔形成孔道使其通透性变大,造成细胞膜结构破坏引起细胞内物质泄漏,使靶细胞死亡而达到抑菌的效果[17-19],从而调节动物肠道菌群的平衡,改善肠道内环境;②通过增加改善肠道生理结构,从而直接或间接提高肠道消化酶活性[20-21],肠道消化酶活性的提高可以增强动物对营养物质的吸收利用[22];③通过受体依赖机制刺激先天性免疫细胞释放趋化因子和细胞因子而发挥间接趋化作用,调节机体内淋巴细胞、中性粒细胞数目,改善机体的免疫性能和抗病力来促进动物生长[23-24]。
鱼类消化酶活性不仅反映基本的消化生理特征,而且可以作为衡量鱼类对饲料营养成分消化、吸收和利用的重要指标[25],消化酶活性升高有利于营养物质在体内的消化、吸收和利用[26]。本试验发现,随着饲料中AMI添加水平的升高,低剂量AMI即可显著提高肠道脂肪酶水平,而高剂量的AMI对肠道脂肪酶活性与低剂量相比无显著影响,肠道蛋白酶活性则随着添加量的升高而升高,说明低剂量AMI促进肠道对脂类的吸收,而高剂量AMI对蛋白质类的促进作用更为明显。抗菌肽类物质提高鱼类消化酶活性的机理可能与其对消化道的生长发育的促进作用及其具有的广谱抗菌活性有关,研究表明,抗菌肽能促进肠道的发育,增加肠道成熟细胞数量及肠绒毛高度,而肠道成熟细胞数量与肠道消化酶活性成正相关,肠道成熟细胞增加能提高消化酶活性[20-21];并且抗菌肽具有广谱抗菌活性,可以促进肠道有益菌群增殖,抑制有害菌群的增殖,调节肠道菌群的平衡[27],间接提高肠道消化酶活性[28]。
4 结论
饲料中添加AMI可提高吉富罗非鱼的生长性能和肠道消化酶活性,本试验条件下AMI最适添加量为50 mg/kg。

