响应面法优化梅花鹿胎盘多肽超声波杀菌工艺
皮钰珍,关楚谕,孙文华,岳喜庆
(沈阳农业大学食品学院,辽宁 沈阳 110086)
响应面法优化梅花鹿胎盘多肽超声波杀菌工艺
皮钰珍,关楚谕,孙文华,岳喜庆
(沈阳农业大学食品学院,辽宁 沈阳 110086)
以酶解获得的梅花鹿胎盘多肽为原料,进行超声波杀菌,研究超声功率、超声时间和脉冲时间对多肽杀菌率的影响。利用响应面分析法确定了超声波杀菌的最佳工艺参数为:超声功率850 W、超声时间4.6 min、脉冲时间7 s,此时梅花鹿胎盘多肽的损失率为20.2%,多肽的杀菌率为87.5%,其中细菌总数为68 CFU/mL,大肠杆菌最大可能数为零,均符合国家标准。在最佳杀菌工艺条件下获得的梅花鹿胎盘多肽,对超氧阴离子自由基的清除率比未经杀菌处理的多肽仅降低了3.3%,对羟自由基的清除率降低了1.1%,对DPPH自由基的清除率降低了1.7%。这说明超声波杀菌后的梅花鹿胎盘多肽既达到了商业无菌的标准,又有效地保持了其生物活性。
梅花鹿胎盘多肽;超声波杀菌;杀菌率
梅花鹿胎盘具有免疫、抗氧化、延缓衰老、补气养血、温经散寒等功效[1-2]。将梅花鹿胎盘蛋白水解可制成具有生物活性的多肽,在生物医药、优质保健食品、活性肽类功能食品的研发等方面具有广阔的应用前景[3-4]。为实现其商品化销售,保证活性多肽的食用安全性及产品贮藏性,需对其进行杀菌处理。传统的热杀菌中,低温加热不能保证杀灭多肽中的全部微生物,高温加热又会破坏多肽的生物活性,因此超声波作为一种“冷杀菌”技术而日益受到关注。超声波能够在极短的时间内产生微射流和局部高热高压来杀灭微生物,延长多肽保鲜期的同时,又保证了多肽的生物活性,已经成为相关领域研究应用的热点[5-7]。
本实验以梅花鹿胎盘多肽为原料,进行超声波杀菌处理,利用响应面分析法,确定超声波杀菌的最佳工艺条件。同时根据鹿胎盘多肽具有清除超氧阴离子自由基(O2-·)、羟自由基(·OH)、1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picryl-hydrazyl-hydrate,DPPH)自由基这一特性,比较杀菌前后多肽清除自由基的能力和多肽损失率,进而为超声波技术应用于梅花鹿胎盘多肽的杀菌提供理论依据。
1 材料与方法
1.1 材料与试剂
梅花鹿胎盘 吉林伊通满族自治县吉云鹿业发展有限公司。
邻菲罗啉、焦性没食子酸等(均为分析纯) 国药集团化学试剂有限公司;DPPH 上海楷洋生物技术有限公司;胰蛋白酶(酶活力≥250 U/mg)、木瓜蛋白酶(酶活力≥400 U/mg) 北京鼎国昌盛生物技术有限责任公司;BCA蛋白定量试剂盒 上海博谷生物科技有限公司。
1.2 仪器与设备
BSA224S电子天平 赛多利斯科学仪器(北京)有限公司;S-25型pH精密酸度计 上海理达仪器厂;TMTD-8222电热恒温水浴锅 上海精宏试验设备有限公司;CT14RD冷冻离心机 上海天美科学仪器有限公司;UV-2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;FD5-3美国SIM冻干机 上海龙捷仪器设备有限公司;JY92-2D超声波细胞粉碎仪 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 工艺流程
新鲜梅花鹿胎盘→洗净→去除筋膜、血管→剪碎→高速组织匀浆(加入胎盘质量2倍的生理盐水)→双酶水解→终止反应→调pH值至7.0→离心→收集上清液→冷冻干燥得固体多肽粉末→超声波杀菌→成品[8]
在此过程中,由于超声波探头具有聚能作用,处理液的温度容易升高,因此在超声波杀菌过程中将处理液置于冰浴烧杯中,使其温度保持在0 ℃左右,从而避免多肽变性[9]。
1.3.2 双酶水解
称取梅花鹿胎盘匀浆,加热至52 ℃,恒温,用l mol/L的NaOH或1 mol/L的HCl溶液调pH值至7.0,加入一定量的木瓜蛋白酶与胰蛋白酶(酶活性比1∶1),底物体积分数10%,开始水解,并不断地搅拌。同时维持溶液的pH值恒定。反应3 h后将水解液升温到90 ℃,保持10 min灭酶活,冷却至室温后,调溶液pH值至7.0,8 000 r/min离心15 min,取上清液即得梅花鹿胎盘多肽溶液[10]。
1.3.3 单因素试验
称取冷冻干燥后的梅花鹿胎盘多肽粉末10 mg置于50 mL小烧杯中,加入30 mL无菌水溶解,充分搅匀,使多肽液质量浓度大于200 øg/mL[8]。进行超声波杀菌时,确保超声波探头完全浸没于被处理的多肽溶液中;杀菌完成后,迅速用无菌保鲜膜将小烧杯封口,置于无菌操作台上用于微生物检测。
固定条件:超声功率800 W、超声时间4.0 min、超声脉冲时间6 s,分别进行超声功率600、700、800、900、1 000 W;超声时间3.0、3.5、4.0、4.5、5.0 min;超声脉冲时间4、5、6、7、8 s的单因素试验,以杀菌率、多肽损失率、对O2-·、·OH、DPPH自由基的清除率作为评定指标,应用SPSS软件对数据进行方差分析,分别考察了超声功率、超声时间和超声脉冲时间3个因素对梅花鹿胎盘多肽杀菌工艺的影响[11-12]。
1.3.4 响应面试验设计
根据单因素试验确定各因素的取值水平范围,结合Box-Behnken试验设计原理,分别选取超声功率(X1)、超声时间(X2)、脉冲时间(X3)作为自变量,以胎盘多肽的杀菌率作为响应值设计响应面试验[13]。
1.3.5 指标测定
1.3.5.1 微生物测定
依据国家标准GB 4789.2—2010《食品微生物学检验:菌落总数测定方法标准》进行测定,检测项目为细菌总数和大肠杆菌总数。
1.3.5.2 抗氧化活性测定
O2-·清除作用:邻苯三酚氧化法测定[14];·OH清除作用:邻二氮菲法测定[15];DPPH自由基清除能力:DPPH法测定[16]。
1.3.5.3 多肽含量的测定
采用BCA蛋白浓度测定试剂盒来测定组分中多肽的含量,该法的线性范围为50~2 000 øg/mL。
1.3.6 杀菌率和多肽损失率的计算公式

2 结果与分析
2.1 单因素试验
2.1.1 超声功率对梅花鹿胎盘多肽杀菌效果的影响
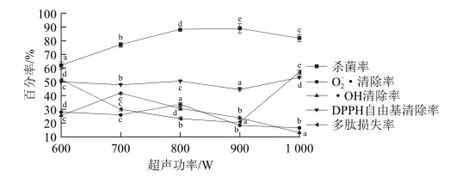
图1 超声功率对梅花鹿胎盘多肽杀菌率?DDPPPPHH自由基清除率及多肽损失率的影响Fig.1 Influence of ultrasonic intensity on sterilization efficiency and free radical scavenging activity of sika deer placenta polypeptides
由图1可知,随着超声功率增加,对梅花鹿胎盘多肽的杀菌率呈现上升趋势,在超声功率为600 W时,杀菌率只有62%;在900 W时,超声处理对多肽的杀菌率可以达到89%。这是由于超声功率越大,产生的空化作用越强烈,对微生物的致死作用越强。在超声功率达到1 000 W时,超声功率的增加对杀菌率变化影响减小,甚至趋于下降。方差分析表明,不同的超声波功率对多肽的杀菌率存在明显差异。并且杀菌率并不是随功率的增加一直增加下去,而是存在一个最佳值。此现象可以从超声空化的角度解释,声强是影响超声空化的重要参量。当声强超过空化域值后,提高声强会使超声空化增强,但提高声强有一定的界限,超过了这个界限,空化泡在超声波的膨胀相内可能增长过大,以致它在声波的压缩相内来不及发生崩溃,从而造成瞬态空化减弱效应,使杀菌效果反而下降。而且声强增大,超声空化增强也会使声散射衰减增大;声强增大,非线性引起的附加衰减也随之增大,这都不利于声能量的传播[17-18]。此外加大声强也会增加能量的损耗,增大成本,产生刺耳噪声。
同时发现多肽对O2-·的清除率随功率的增大而减小;多肽对O2-·和DPPH自由基的清除率在800 W时最大。而且功率在700~900 W时,多肽的损失率相对较小;因此综合考虑最终杀菌功率选为800 W。
2.1.2 超声时间对梅花鹿胎盘多肽杀菌效果的影响
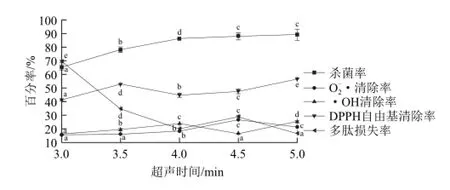
图2 超声时间对梅花鹿胎盘多肽杀菌率、和DPPH自由基清除率及多肽损失率的影响Fig.2 Influence of ultrasonic treatment time on sterilization efficiency and free radical scavenging activity of sika deer placenta polypeptides
由图2所示,随着超声波作用时间的延长,对梅花鹿胎盘多肽的杀菌率也呈现逐渐上升的趋势。当超声处理3 min时,超声处理对多肽的杀菌率只有65%,而超声处理5 min后,梅花鹿胎盘多肽的杀菌率为89%。当时间超过4 min后,虽然杀菌率继续增加,但是趋势变缓。且由方差分析表明,4.5~5 min之间,杀菌率无显著性差异。多肽的损失率随超声时间的延长而减小。当超声时间在4.5~5 min之间时,多肽对O2-·的清除率无显著差异且较高,对DPPH自由基的清除率也较高。但考虑到随着超声作用时间延长,多肽的温度会升高,对多肽的生物活性会产生影响,因此将超声时间定为4.5 min。
2.1.3 超声脉冲时间对梅花鹿胎盘多肽杀菌效果的影响如图3所示,随着脉冲时间的延长,对梅花鹿胎盘多肽的杀菌率也有所增加。脉冲时间和间隔时间的良好循环,能够调节空化作用,充分作用于多肽中的微生物[19]。在脉冲时间为6 s时,脉冲时间的延长对杀菌率变化影响减小,杀菌率趋于平缓,且根据方差分析,在7~8 s之间杀菌率无显著性差异。多肽对O2-·的清除率在5 s时最大,脉冲时间对·OH的清除率在4、5 s和7 s时均无显著性差异。虽然脉冲时间在6~7 s之间多肽对DPPH自由基清除率无显著性差异,但多肽损失率在5 s和7 s时最小,因此综合考虑将超声波脉冲时间定为7 s。

图3 超声波脉冲时间对梅花鹿胎盘多肽杀菌率、和DPPH自由基清除率及多肽损失率的影响Fig.3 Influence of ultrasonic impulse time on sterilizing efficiency and free radical scavenging activity of sika deer placenta polypeptides
2.2 响应面法优化试验设计
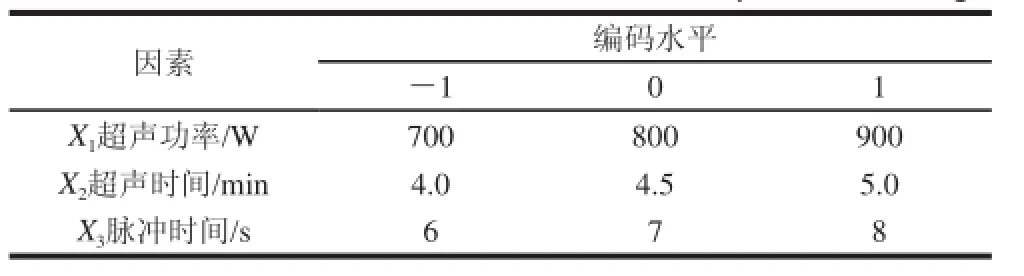
表1 Box-Behnken试验因素与水平设计Table1 Factors and levels used in Box-Behnken experimental design

表2 响应面优化试验设计和试验结果Table 2 Experimental design and results for response surface optimization
以梅花鹿胎盘多肽的杀菌率为响应值,在单因素试验的基础上,根据Box-Behnken试验设计原理,选取超声功率、超声时间、脉冲时间进行三因素三水平的响应面分析试验。Box-Behnken试验设计的水平及编码见表1,响应面优化试验结果见表2。
超声波作用于梅花鹿胎盘多肽,不仅会对微生物有杀灭作用,同时对多肽的抗氧化活性也有会产生影响。梅花鹿胎盘多肽对O2-·、·OH、DPPH自由基的清除能力越大,其抗氧化活性也就越大[20-21]。应用Minitab软件对表2中所得数据进行多元回归拟合分析,结果如表3所示。
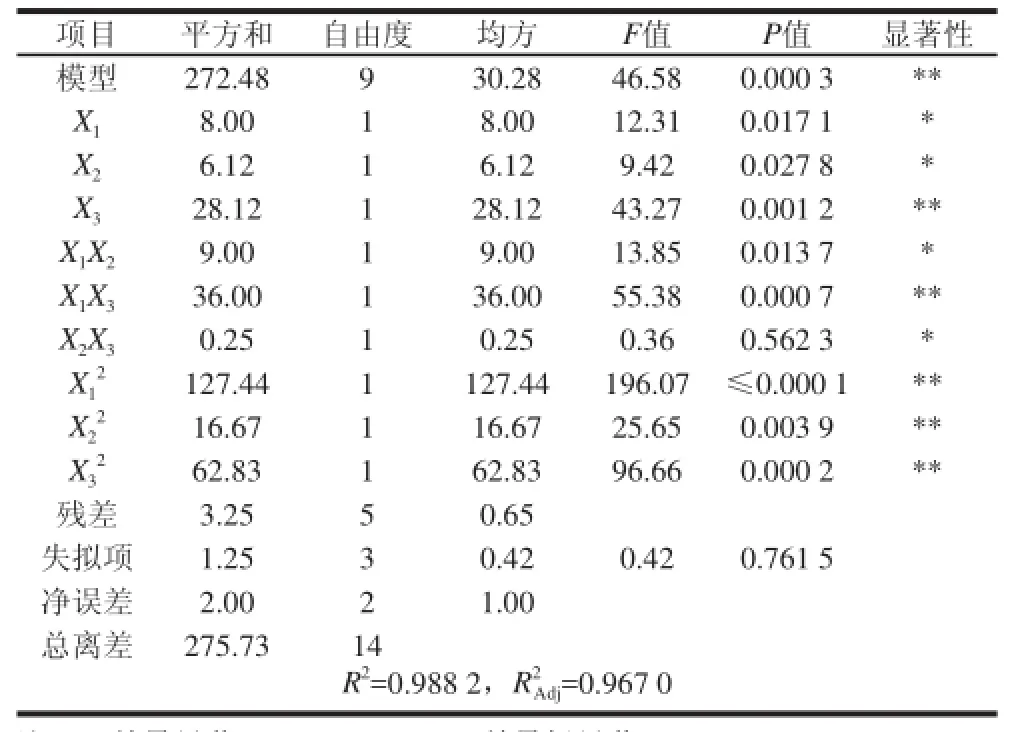
表3 多肽杀菌率的回归分析结果Table 3 Results of regression analysis for polypeptide sterilization efficiency
由表3可知,该模型极显著(P<0.01);失拟项不显著,和分别为0.988 2和0.967 0,说明该模型与实际拟合程度良好;自变量与响应值之间的线性关系显著,可以用于梅花鹿胎盘多肽超声波杀菌工艺实验的预测。各因素经过回归拟合后,得到杀菌率对功率、超声时间、脉冲时间的二次多项回归方程为:Y=87.00+1.00X+0.875X+1.875X-5.875X2-2.125X2-4.125X2+1.50X1X2+3.00X1X3+0.25X2X3。
方差分析结果还表明,方程的一次项中X1、X2对响应值的影响显著,X3对响应值的影响极显著;二次项对响应值的影响极显著;交互项X1X2、X2X3项对响应值的影响显著,X1X3项对响应值的影响极显著。由此可知,各具体试验因素对响应值的影响并非是简单的线性关系。
各因素的影响程度分析,各因素的F值可以反映出各因素对试验指标的重要性,F值越大,表明对试验指标的影响越大,即重要性越大[19-20]。结合方差分析表,对梅花鹿胎盘多肽杀菌率影响程度的大小顺序为:脉冲时间>超声功率>超声时间。根据回归方程,做出响应面图(图4、5),列出的图为对杀菌率影响显著的图,考察所拟合的响应曲面的形状,分析各因素对杀菌率的影响。比较图4和图5可知,超声功率与脉冲时间对杀菌率的影响表现为极显著,显示为曲线较陡;而脉冲时间与杀菌时间的影响相比次之,表现为曲线较为平滑,这也与回归方程各项方差分析的结果相一致。为了进一步确定最佳点的值,通过对二次多项式数学模型的解逆矩阵,得出梅花鹿胎盘多肽最佳杀菌工艺理论值为超声功率821 W、超声时间4.6 min、脉冲时间7.31s,预测杀菌率为87.8%。
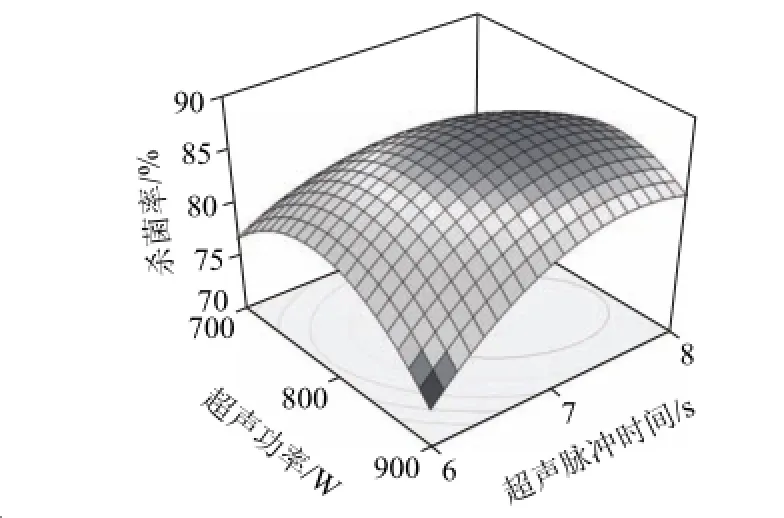
图4 超声脉冲时间和超声功率交互作用对多肽杀菌率的响应面Fig.4 Response surface curve for Y= f (X1, X3)
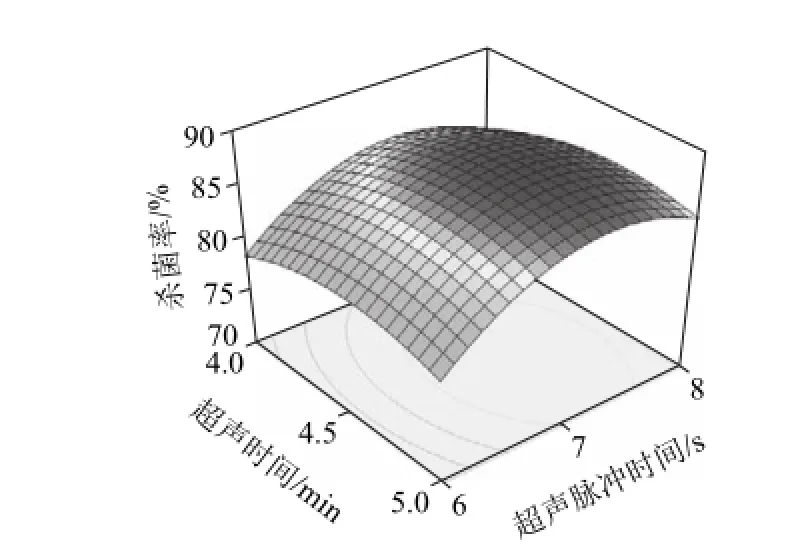
图5 超声脉冲时间和超声时间交互作用对多肽杀菌率的响应面Fig.5 Response surface curve for Y = f (X2, X3)
2.3 模型验证
考虑到实际操作性,将最优杀菌工艺条件调整为功率850 W、超声时间4.6 min、超声脉冲时间7 s,进行验证实验,得到实测杀菌率为87.5%,重复性好,与预测值87.8%接近。说明该响应面法得到的多肽最佳杀菌工艺条件准确可靠,具有一定的实际指导意义。同时本研究又比较了杀菌前后多肽清除自由基的能力。由表2可知,未经杀菌处理的多肽,对O2-·、·OH和DPPH自由基的清除率分别为34.8%、47.3%和65.2%;应用实际最佳超声波杀菌工艺条件(功率850 W、超声时间4.6 min、脉冲时间7 s)下得到的多肽,对O2-·、·OH和DPPH自由基的清除率分别为31.5%、46.2%和63.5%,与未经杀菌处理的多肽相比,清除率分别降低了3.3%、1.1%和1.7%,多肽的损失率为20.2%。同时检测到细菌总数为68 CFU/mL,大肠杆菌最大可能数为零。这说明超声波杀菌处理后的梅花鹿胎盘多肽,既达到了商业无菌的标准,又有效地保持了生物活性。
3 结3 论
本研究以超声波为杀菌方法,应用SPSS和Minitab软件,确定出梅花鹿胎盘多肽超声波杀菌的最佳工艺条件:超声功率850 W、超声时间4.6 min、脉冲时间7 s,此时实测梅花鹿胎盘多肽的损失率为20.2%,多肽的杀菌率为87.5%,其中细菌总数和大肠杆菌数均符合国家标准。与未经杀菌处理的多肽相比,最佳超声波杀菌工艺条件下获得的多肽对O2-·、·OH和DPPH自由基的清除率分别降低了3.3%、1.1%和1.7%。与传统的热杀菌相比较,超声波杀菌技术在保证梅花鹿胎盘多肽的生物活性方面有着一定的优势,为确保其食用安全性、促进优质保健食品的研发和活性肽类功能食品的市场发展提供科学依据。
[1] 杨桂芹, 邹兴淮. 胎盘及其提取物的化学成分、药理作用及临床应用研究进展[J]. 沈阳农业大学学报, 2003, 34(2): 150-154.
[2] 巴达马其其格, 吴晓东, 侯霞, 等. 梅花鹿胎盘生物活性多肽的制备及其药理作用研究[J]. 内蒙古农业大学学报, 2008, 29(3): 4-8.
[3] 陈锦瑶, 张立实. 生物活性肽的安全性评价研究进展[J]. 毒理学杂志, 2013, 27(2): 142-146.
[4] 邹吉利, 徐南平. 中药活性多肽研究进展[J]. 湖北中医药大学学报, 2012, 14(4): 66-67.
[5] 钟赛意, 王善荣, 刘寿春. 超声波技术在动物性食品中的应用[J]. 肉类研究, 2006, 20(11): 33-37.
[6] 冷雪娇, 章林, 黄明. 超声波技术在肉品加工中的应用[J]. 食品工业科技, 2012, 33(10): 394-397.
[7] CHANDRAPALA J, OLIVER C, KENTISH S, et al. Ultrasonics in food processing-food quality assurance and food safety[J]. Trends in Food Science & Technology, 2012, 26(15): 88-98.
[8] 付丽莎, 岳喜庆, 皮钰珍, 等. 梅花鹿胎盘多肽体外抗氧自由基及抗油脂氧化性能的研究[J]. 食品工业科技, 2008, 29(6): 159-161.
[9] 皮钰珍, 刘长江, 岳喜庆, 等. 鹿胎盘多肽稳定性的研究[J]. 食品研究与开发, 2007, 28(1): 33-36.
[10] 皮钰珍, 刘长江, 王淑琴, 等. 双酶水解法制备梅花鹿胎盘活性多肽[J]. 食品与发酵工业, 2006, 32(9): 168-171.
[11] 栗星, 包海蓉. 超声波对橙汁的杀菌特性研究[J]. 食品科学, 2008, 29(8): 346-350.
[12] 王文宗, 李冰, 田应娟, 等. 超声波对胡萝卜汁杀菌效果的研究[J].食品科学, 2009, 30(22): 58-60.
[13] CAO Shifeng, HU Zhichao, PANG Bin. Optimization of postharvest ultrasonic treatment of strawberry fruit[J]. Postharvest Biology and Technology, 2010, 55(32): 150-153.
[14] 赵宝洪, 高洪, 屈长林, 等. 自由基检测方法[J]. 动物医学进展, 2007, 28(7): 107-110.
[15] 郭亚力, 李聪, 欧灵澄, 等. 三种分光光度法对天然抗氧化物质抗自由基性能的分析检测[J]. 分析试验室, 2004(10): 43-47.
[16] 李春阳, 许时婴, 王璋. DPPH法测定葡萄籽原花青素清除自由基的能力[J]. 食品与生物技术学报, 2006(2): 102-106.
[17] 闫坤, 吕加平, 刘鹭, 等. 超声波对液态奶中枯草芽孢杆菌的杀菌作用[J]. 中国乳品工业, 2010, 38(2): 4-6.
[18] AWAD T S, MOHARRAM H A, SHALTOUT O E, et al. Applications of ultrasound in analysis, processing and quality control of food: a review[J]. Food Research International, 2012, 48 (19): 410-427.
[19] CHEMAT F, HUMA Z, KHAN M K. Applications of ultrasound in food technology: processing, preservation and extraction[J]. Ultrasonics Sonochemistry, 2011, 18(10): 813-835.
[20] 郑淋, 游丽君, 赵谋明. 不同杀菌工艺对泥鳅多肽抗氧化活性的影响[J]. 食品与发酵工业, 2011, 37(3): 109-112.
[21] DONNELL C P O, TIWARI B K, BOURKE P, et al. Effect of ultrasonic processing on food enzymes of industrial importance[J]. Trends in Food Science & Technology, 2010, 21(11): 358-367.
Optimization of Ultrasonic Sterilization Process of Sika Deer Placenta Polypeptides by Response Surface Methodology
PI Yu-zhen, GUAN Chu-yu, SUN Wen-hua, YUE Xi-qing
(College of Food Science, Shenyang Agricultural University, Shenyang 110086, China)
In this experiment, polypeptides obtained from enzymatic hydrolysis of sika deer placenta were sterilized by ultrasonic radiation. The effects of ultrasonic intensity, treatment time and impulse time on sterilization efficiency were investigated. The optimal parameters were determined by response surface methodology as follows: 850 W of ultrasonic intensity, 4.6 min of ultrasonic treatment time and 7 s of ultrasonic impulse time. The results showed that the polypeptide loss rate was 20.2% and the sterilization efficiency was 87.5% under these conditions. In addition, the total bacterial count was 68 CFU/mL and the most probable number (MPN) of Escherichia coli was zero. All these parameters complied with the national standards. The free radical scavenging activity of sterilized sika deer placenta polypeptides against superoxide anion, hydrolxyl and DPPH radicals was decreased by only 3.3%, 1.1% and 1.7% as compared to the unsterilized counterpart. These results indicate that sterilized sika deer placenta polypeptides reach the requirements of commercial sterilization while maintaining their bioactivity.
sika deer placenta polypeptides; ultrasonic sterilization; sterilization efficiency
TS251.95
A
1002-6630(2014)04-0039-05
10.7506/spkx1002-6630-201404009
2013-06-17
沈阳市科学技术计划项目(F12-120-3-00)
皮钰珍(1974—),女,副教授,博士,研究方向为动物性食品加工。E-mail:1014436061@qq.com

