碎囊毛霉产β-1,3-1,4-葡聚糖酶的分离纯化及其酶学性质
丁叶梅,贠建民*,魏 龙,陈 芳,艾对元,张紊玮
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
碎囊毛霉产β-1,3-1,4-葡聚糖酶的分离纯化及其酶学性质
丁叶梅,贠建民*,魏 龙,陈 芳,艾对元,张紊玮
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
基于碎囊毛霉M-28固态发酵方式,采用单因素试验对其所产β-1,3-1,4-葡聚糖酶进行提取纯化条件优化,并开展部分酶学性质研究。结果表明:用 pH 5.5的乙酸-乙酸钠缓冲溶液在200 r/min浸提固态发酵基质30 min, 所得粗酶液经饱和度80%硫酸铵盐析、24 h透析浓缩、Sephadex G-100柱层析分离后,经紫外分光光度计检测,得到2 个蛋白峰,酶活力测定发现有一个峰具有酶活性,收集该酶活组分并采用聚乙二醇高度吸附浓缩,再用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法进行纯度检验,纯化酶蛋白呈单一谱带,分子质量约为17.2 kD,酶比活力达到225.02 U/mg,纯度较粗酶液提高了2.48 倍。酶的最适反应温度为55 ℃、在40~50 ℃时相对稳定,其最适pH值为5.5、酶活力在pH 4.5~5.5条件下相对稳定。Fe3+和Al3+对该酶具有明显抑制作用,Fe2+对其有激活作用,其他金属离子影响不大。
碎囊毛霉;β-1,3-1,4-葡聚糖酶;分离纯化;酶学性质
β-1,3-1,4-葡聚糖酶是β-葡聚糖水解酶系家族之一[1]。该酶广泛存在于植物如大麦、燕麦、小麦、稻谷等作物,以及微生物[2-3]如细菌、真菌、瘤胃微生物和动 物中。
在食品和饲料工业等领域有广泛使用[4],如在饲料中添 加有利动物对营养物质的消化和吸收,从而提高生长性能和粮食的转化率;将β-葡聚糖酶应用于啤酒生产与制糖工业中可以提高产品品质和出品率。传统上工业使用的β-1,3-1,4-葡聚糖酶的来源常以动植物提取为主,动植物来源的β-葡聚糖酶因其含量低,提取成本较高,不适于规模生产,而微生物酶具有不受生产季节和原料限制、生产周期短、便于工业化生产等特点,已逐步受到关注和青睐[5]。近年来,随着高产酶菌株的获得,采用微生物发酵法生产β-葡聚糖酶的研究已成为目前该领域的热点[6-7]。已研究报道过的菌株,主要集中在芽孢杆菌属(Bacillus)细菌及曲霉属(Aspergillus)霉菌中,而有关毛霉属(Mucor)真菌产β-葡聚糖酶菌株较为少见,对其酶学性质方面研究及应用于啤酒麦芽制造尚未见到相关报道。本研究室的赵志超等[8]从大麦表皮分离得到1株产β-葡聚糖酶的碎囊毛霉(Mucor petrinsularis)M-28菌株,已证明该菌株在微生物制麦方面具有良好的应用前景和开发价值。因此,本实验拟采用碎囊毛霉为发酵菌株,以其固态培养基质作为提取β-1,3-1,4-葡聚糖酶的原料,对其分离提取和纯化工艺开展研究,并对该酶的部分酶学性质进行研究,旨在探索出一套碎囊毛霉发酵法生产提取β-葡聚糖酶的工艺及参数,为其在微生物制麦工业中的开发应用提供理论参考。
1 材料与方法
1.1 材料与培养基
1.1.1 菌株与材料
碎囊毛霉M-28(Mucor petrinsularis),甘肃农业大学食品科学与工程学院微生物研究室分离保藏,分离于大麦表面[8]。
β-1,3-1,4-葡聚糖 美国Sigma公司;大麦 甘肃省武威市长城麦芽厂;麸皮 市售;Sephadex G-100 上海源叶生物技术有限公司;其他试剂均为国产分析纯。
1.1.2 培养基
斜面培养基:PDA培养基。
固体产酶培养基[9]:大麦粉33%、麸皮67%、料水质量比1∶1.2。
1.2 仪器与设备
VU756CRT型紫外-可见分光光度计、THZ-82台式恒温振荡器 上海佑科仪器仪表有限公司;电热恒温培养箱 北京科伟永兴仪器有限公司;SW-CJ-1FD洁净工作台 苏州安泰空气技术有限公司;TGL-10MC台式高速冷冻离心机 长沙平凡仪器仪表有限公司;DYY-11型葡聚糖凝胶电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 β-1,3-1,4-葡聚糖酶浸提条件优化
设定初始浸提条件为加入pH值5.5的乙酸-乙酸钠(HAc-NaAc)缓冲液100 mL,移入振荡器中200 r/min振荡20 min,6 559×g离心10 min[9]。
1.3.1.1 不同pH值缓冲液对酶浸提的影响
将HAc-NaAc缓冲溶液分别配制为pH值3~7,加入固体产酶培养基中再移入振荡器中200 r/min进行抽提测定酶活力,以最高酶活力为100%,确定其最佳pH值缓冲液。
1.3.1.2 浸提时间对酶浸提的影响
在固体培养基中加入HAc-NaAc缓冲液,移入振荡器中200 r/min分别振荡10、20、30、40、50、60 min,测定酶活力,以最高酶活力为100%,确定最佳浸提时间。
1.3.2 碎囊毛霉M-28产β-1,3-1,4-葡聚糖酶的分离纯化
1.3.2.1 粗酶液的提取
将碎囊毛霉接入PDA培养基中培养至长出孢子,用无菌水制备孢子悬浊液,调整孢子浓度107个/mL,接10%的孢子悬浊液于大麦粉和麸皮的培养基中26 ℃培养4 d,准确量取100 mL pH 5.5值HAc-NaAc缓冲液倒入以发酵完毕的固态产酶培养基中,移入振荡器中200 r/min振荡30 min,再6 559×g离心10 min,所得上清液即为粗酶液。
1.3.2.2 酶活力测定
用pH 5.5的HAc-NaAc缓冲溶液将待测酶液稀释适当倍数,取25 mL具塞刻度试管分别加入经40℃ 预热的酶稀释液1.0 mL和经40 ℃预热的质量浓度为1.0 g/100 mL的β-葡聚糖溶液1.0 mL,混匀,于40 ℃恒温水浴准确反应10.0 min,后加入蒸馏水1.0 mL和DNS试剂3.0 mL,摇匀,置于沸水中准确反应5 min,取出并立即置于冰水浴中降至室温,补水至25 mL混匀,以空白试管调零,在540 nm处比色,记录其吸光度[10-12]。空白对照制作:吸取已稀释酶液1.0 mL先加入DNS试剂3 mL,再加入蒸馏水1.0 mL和1.0 g/100 mL β-葡聚糖溶液1.0 mL,其他步骤同上。以葡萄糖标准品制作标准曲线,获得回归方程Y= 2.868x-0.292 2(R2=0.999 8)。
酶活力定义:在40 ℃、pH 5.5条件下,每分钟分解大麦β-葡聚糖产生1 μmol还原糖为1 个酶活力单位,以1 U/mL表示。

式中:x为540 nm波长处吸光度;n为酶液稀释倍数;t为反应时间/min。
1.3.2.3 蛋白质浓度测定
考马斯亮蓝法:标准蛋白质溶液:称取牛血清白蛋白25 mg,加水溶解定容至100 mL,吸取上述溶液40 mL,用蒸馏水稀释至100mL即可。考马斯亮蓝试剂:考马斯亮蓝G-50 100mg溶于50 mL 95%乙醇,加入100 mL 85% H3PO4,用蒸馏水稀释至1 000 mL,滤纸过滤备用。
取6 支试管,将试管分别编号成0、1、2、3、4、5,分别使6 支试管中的牛血清白蛋白含量达到0、20、40、60、80、100 μg,以0 号试管为空白在595 mn波长处测定各浓度的吸光度,以A595nm为纵坐标,标准蛋白含量为横坐标绘制标准曲线,获得回归方程y=0.005 1x+0.195 2(R2=0.999 3)。
1.3.2.4 酶分子质量的测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)法。
1.3.2.5 硫酸铵盐析实验
取8 份100 mL粗酶液,边搅拌边加入相应质量的硫酸铵,使其饱和度分别达到20%、30%、40%、50%、60%、70%、80%和90%。于4℃冰箱中静置过夜,8300×g离心25 min。所得沉淀溶于20 mL pH5.5的HAc-NaAc缓冲溶液中,透析24 h后分别测定蛋白含量与酶活力[13-14]。
1.3.2.6 Sephadex G-100层析实验
取经透析至无SO42-、用聚乙二醇浓缩的酶液10mL上Sephadex G-100柱进行分离,收集酶活力组分。
1.3.2.7 酶纯度检验
采用SDS-PAGE方法[15]。
1.3.3 β-1,3-1,4-葡聚糖酶的酶学性质
1.3.3.1 最适温度的确定
将纯化后的纯酶液稀释至适当的倍数,加入相同浓度的底物,将酶反应体系混合均匀后分别置于20~80 ℃的恒温水浴锅中反应一段时间,以5 ℃为梯度,测定反应液相对酶活力,以最高酶活力为100%[16]。
1.3.3.2 热稳定性的确定
将纯化后的酶液稀释至适当倍数后分别置于40、45、50、55、60℃的恒温水浴锅中保温,每隔10 min取样,取出的样品立即置于冰水浴中,于40 ℃反应,测定相对酶活力,以最高酶活力为100%。
1.3.3.3 最适pH值的确定
将相同克数的底物溶解于pH3.0~8.0的HAc-NaAc缓冲液中,配制成不同pH值、相同浓度的底物溶液,在40 ℃反应,测定相对酶活力,以最高酶活力为100%。
1.3.3.4 酸碱稳定性的确定
用pH 3.0~8.0的HAc-NaAc缓冲液将纯化后的酶液稀释至适当倍数,混合均匀后,在40 ℃的恒温水浴锅中保温1 h,立即取出后冰浴,测定相对酶活力,以最高酶活力为100%。
1.3.3.5 金属离子对酶活力的影响
取纯化后的酶液0.1 mL,加入0.4 mL不同浓度的金属离子溶液和0.5 mL相同浓度的底物,使各金属离子的最终浓度分别为1.0、10.0 mmol/L,然后于40 ℃反应,测定相对酶活力,以不加任何金属离子的反应体系中酶活力为100%[17]。
2 结果与分析
2.1 β-1,3-1,4-葡聚糖酶浸提条件优化
2.1.1 不同pH值缓冲液对酶浸提的影响
将配制成不同pH值的缓冲液加入发酵好的固态产酶培养基质进行浸提,结果如图1所示。
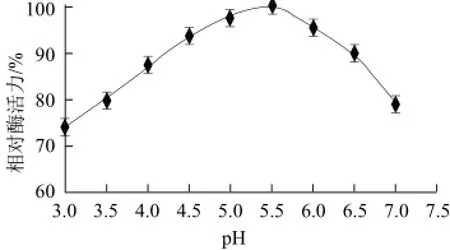
图1 不同pH值缓冲液对酶浸提的影响Fig.1 Effect of buffer pH on the recovery of the enzyme activity
由图1可知,随着缓冲液pH值的升高酶活力呈先上升后下降的趋势,HAc-NaAc缓冲溶液在pH5.5时浸提β-1,3-1,4-葡聚糖酶得到的活力最高。说明碎囊毛霉M-28菌株产β-1,3-1,4-葡聚糖酶的最适pH值为5.5,所以采用pH5.5的HAc-NaAc缓冲溶液作为最佳浸提液。
2.1.2 浸提时间对酶浸提的影响
在200r/min的振荡器上浸提不同时间,结果如图2所示。

图2 浸提时间对酶浸提的影响Fig.2 Effect of extraction time on the recovery of the enzyme activity
由图2可知,在10~30 min时,随着时间的延长,酶活力呈增加趋势,酶得率升高;当浸提时间超过30 min时其酶活力基本保持不变,说明酶已被完全提出,延长时间后并不能提高酶活,所以酶的最佳抽提时间确定为30 min。
综合图1、2可知,碎囊毛霉M-28产β-1,3-1,4-葡聚糖酶的最佳浸提条件为pH值5.5的HAc-NaAc缓冲液,200 r/min振荡30 min,最终所得粗酶酶活力9.041 U/mL、蛋白质含量为0.140 mg、酶比活力为64.583 U/mg。
2.2 碎囊毛霉M-28产β-1,3-1,4-葡聚糖酶的分离纯化
2.2.1 硫酸铵饱和度对β-1,3-1,4-葡聚糖酶纯化效果的影响
采用硫酸铵饱和度为20%~90%,以10%为梯度,对碎囊毛霉M-28产β-1,3-1,4-葡聚糖酶进行盐析实验,结果如表1所示。随着硫酸铵饱和度的增加,其沉淀中的酶活力也逐渐增大,当饱和度达到80%时,其酶活力收率达到最大,进一步提高硫酸铵饱和度时,其蛋白质收率与酶活力收率均有下降,可能是硫酸铵饱和度过高使部分蛋白质变性造成的。因此,确定盐析纯化碎囊毛霉M-28产β-1,3-1,4-葡聚糖酶的最适硫酸铵饱和度为80%。

表1 硫酸铵饱和度对β-1,3-1,4-葡聚糖酶纯化效果的影响Table1 Effect of ammonium sulfate saturation on the purification of β-1,3-1,4-glueaannaassee
2.2.2 Sephadex G-100层析对β-1,3-1,4-葡聚糖酶的纯化效果
将盐析沉淀的酶用pH 5.5的HAc-NaAc缓冲液溶解,再用透析袋透析24h,用聚乙二醇浓缩,取浓缩后的酶液10mL上Sephadex G-100层析柱,每隔5min收集1管,测定酶活力和可溶性蛋白,结果如图3所示。

图3 Sephadex G-100层析纯化β-1,3-1,4-葡聚糖酶层析图谱Fig.3 Chromatography of β-1,3-1,4- glueanase on Sephadex G-100 column
由图3可知,洗脱液出现了2个蛋白峰,经检测第1个峰无酶活,为杂蛋白峰,第2个峰有酶活,为酶活峰。因此,需对该部分蛋白组分进行纯度检测和酶学性质研究。
2.2.3 SDS-PAGE测定β-1,3-1,4-葡聚糖酶分子质量
收集经Sephadex G-100层析分离纯化的酶活力组分(13~18管),浓缩后采用SDS-PAGE进行纯度鉴定并测定酶蛋白的分子质量,如图4所示。

图4 纯化β-1,3-1,4-葡聚糖酶的SDS-PAGE电泳图谱Fig.4 SDS-PAGE of purified β-1,3-1,4-glucanase
由图4可知,经过Sephadex G-100凝胶过滤所得含酶组分在SDS-PAGE上呈单一条带,说明经以上步骤的纯化,得到了电泳纯的β-1,3-1,4-葡聚糖酶样。由迁移率(x)与lgMr(y)的标准曲线方程y=-1.0076x+5.1523(R2=0.996)计算,样品的迁移率为0.91,其分子质量近似为17.2kD。
2.3 β-1,3-1,4-葡聚糖酶的酶学性质研究
2.3.1 最适反应温度的确定
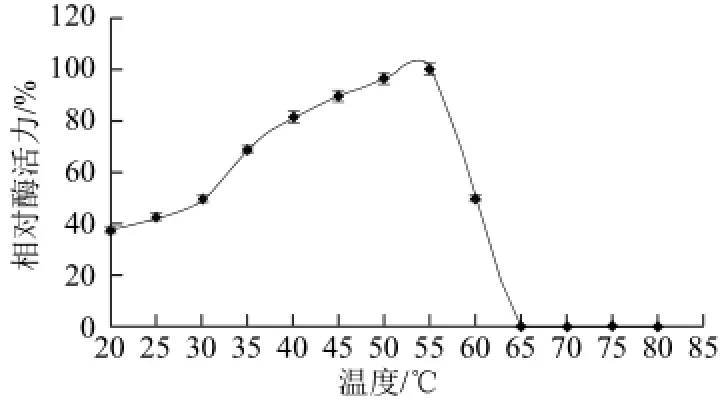
图5 5 β-1,3-1,4-葡聚糖酶最适反应温度Fig.5 Effect of temperature on β-1,3-1,4- glucanase activity
由图5可知,碎囊毛霉β-1,3-1,4-葡聚糖酶在50~55 ℃时酶活力较高,相对酶活力在90%以上,其反应的最适温度为55 ℃,超过55 ℃后酶活力迅速下降,当温度超过65 ℃时,酶完全失活。
2.3.2 酶的热稳定性
β-1,3-1,4葡聚糖酶在40~60 ℃,以5 ℃为梯度下保温,测定酶活力在不同温度下随时间变化的情况,结果如图6所示。
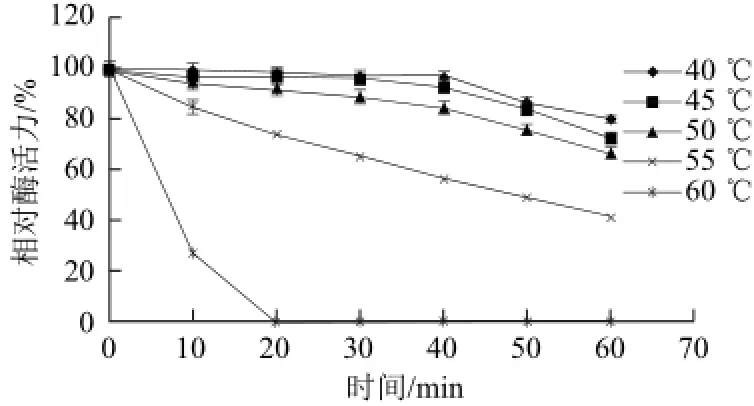
图6 6 β-1,3-1,4-葡聚糖酶的热稳定性Fig.6 Thermo-stability of β-1,3-1,4-glucanase
由图6可知,β-1,3-1,4葡聚糖酶在40、45、50 ℃条件下随保温时间延长,酶活力变化不大,相对比较稳定;在55 ℃条件下随着保温时间的延长酶活力下降较明显;而在60 ℃保温10 min,相对酶活力仅为27.29%,继续保温酶失活。
2.3.3 酶最适pH值的确定
β-1,3-1,4葡聚糖酶与不同pH值底物于40 ℃反应,以确定其最适pH值,结果如图7所示。β-1,3-1,4葡聚糖酶在pH 4.0~5.5时酶活力较高,均在90%以上,最适pH值为5.5,pH值小于4或大于6 时酶活力呈现下降趋势,当pH值达到8时,其相对酶活力仅为30.96%。

图7 7 β-1,3-1,4-葡聚糖酶最适pH值pHFig.7 Effect of pH value on β-1,3-1,4-glucanase activity
2.3.4 酶的酸碱稳定性
采用不同pH值缓冲液稀释β-1,3-1,4葡聚糖酶于40℃反应,结果如图8所示。

图8 8 β-1 ,3-1,4葡聚糖酶的pH值稳定性Fig.8 pH Stability of β-1,3-1,4-glucanase activity
由图8可知,β-1,3-1,4葡聚糖酶在pH值4.0~5.5时酶活力较高,β-1,3-1,4葡聚糖酶在pH4.5~5.5时相对稳定,说明该酶的酸碱稳定性较差。
2.3.5 金属离子对酶活力的影响
不同的金属离子在浓度1 mmol/L和10 mmol/L下对β-1,3-1,4葡聚糖酶活力的影响,结果如表2所示。

表2 金属离子对β-1 ,3-1,4-葡聚糖酶活力的影响Table2 Effect of differet metal ions on β--1,3-1,4- glucanase activity
由表2可知,1 mmol/L和10 mmol/L两个离子浓度下Fe3+、Al3+对碎囊毛霉β-1,3-1,4葡聚糖酶具有明显抑制作用,且Fe3+的抑制作用要比Al3+抑制作用强,Fe3+作用下相对酶活力分别55.41%和40.78%,高浓度的Fe3+比低浓度的Fe3+抑制作用强;在1 mmol/L和10 mmol/L两个离子浓度下Fe2+对β-1,3-1,4葡聚糖酶具有显著激活作用,相对酶活力分别达到108.22%和198.92%;其他离子如Mg2+、Ca2+、Zn2+、Ba2+、K+对β-1,3-1,4葡聚糖酶的影响不大。
3 结论与讨论
西北高海拔地区种植的啤酒大麦普遍存在着β-葡聚糖含量高、胚乳溶解困难且不均匀,制得的麦汁黏度大、过滤慢等缺点[18],而目前针对这一问题的解决方法多采用外源酶解法,有关麦芽制备过程中添加酶法的研究已有报道,如刘妙莲等[19]将来自枯草芽孢杆菌(Bacillus subtilis)的β-葡聚糖酶制剂添加于低发芽率麦芽的制汁过程中,发现可降低麦芽汁黏度,改善啤酒质量。王云川等[20]曾报道过β-1,3葡聚糖酶制剂的在啤酒生产中应用,能促进胚乳细胞自溶、提高麦汁收率,同时协助酵母自溶。而本实验室通过前期的制麦菌株筛选及微生物制麦实验研究发现,添加碎囊毛霉M-28菌株作为制麦启动子培养物能明显改善高β-葡聚糖含量大麦在制麦过程的胚乳溶解性,已证明该菌株所产酶系在制麦方面存在一定的利用潜力和开发价值。本实验结果表明,碎囊毛霉M-28产β-葡聚糖酶的酶活力为9.041U/mL,虽在已报道的相关微生物源酶中活力不是很高,但已可以满足高β-葡聚糖含量大麦在制麦过程中促进胚乳溶解的需要,能够通过有效降解麦芽中的β-葡聚糖来提高麦芽及麦汁的品质。同时该菌株所产酶具有发酵周期短、培养基成分来源广泛,提取工艺较为简单等优点。因此,开展碎囊毛霉M-28产β-1,3-1,4-葡聚糖酶的分离纯化及其酶学性质研究,可以为工业化制麦提供酶制剂来源,具有重要的现实意义。
另外,由酶学性质研究结果可知,该酶不能耐受较高温度,但不影响其应用于制麦过程。因为整个制麦过程一般要求温度控制在25 ℃以下,而该酶在此温度条件下仍有较高活性,可以使用于制麦过程,有利于提高麦芽及啤酒的品质。该酶酸碱稳定性也较差,但制麦过程对pH值一般要求控制在6.0~6.5,而该酶在此pH值范围酶活力较高。
本实验基于碎囊毛霉M-28固态发酵方式,对其所产β-1,3-1,4-葡聚糖酶开展了提取纯化条件优化及酶学性质研究,获得了如下结论。
碎囊毛霉M-28产β-1,3-1,4-葡聚糖酶的最佳浸提条件为pH 5.5的HAc-NaAc缓冲液、振荡器转速200 r/min、时间30 min,最终所得粗酶的酶活力9.041 U/mL,蛋白质含量为0.140 mg/mL,酶比活力为64.583 U/mg。
所得粗酶,经饱和度80%的硫酸铵盐析,透析24 h浓缩处理,再经Sephadex G-100柱凝胶过滤后,得到了电泳纯酶,酶比活力达到225.02 U/mg,纯度较粗酶液提高了2.48 倍。
该酶不能耐受较高的温度,在40~50 ℃时相对稳定,最适反应温度为55 ℃;酶活力在pH值4.5~5.5条件下相对稳定,最适pH值为5.5;Fe3+和Al3+对其有抑制作用,Fe2+对其有激活作用,其他金属离子对其影响不大。
[1] 熊涛, 徐立荣, 曾哲灵, 等. β-葡聚糖酶的研究进展[J]. 四川食品与发酵, 2006, 42(6): 1-4.
[2] HONG T Y, MENG M. Biochemical characterization and antifungal activity of an endo-l,3-β-glucase of Paenibacillus sp. isolated from garden soil[J]. Applied Microbiology and Biotechnology, 2003, 61(5/6): 472-478.
[3] DELACRUZ J, PINTOR-TOROJ A, BENITEZ T, et al. A novel endo-β-1,3-glucanase, BGN13.1, involved in the mycoparasitism of Trichoderna harzianum[J]. Journal of Bacteriology, 1995, 17(7): 6937-6945.
[4] 邹东恢, 江洁. β-葡聚糖酶的开发与应用研究[J]. 农产品加工: 学刊, 2005(8): 7-9.
[5] 王宝顺, 张梁, 丁重阳, 等. 解木聚糖类芽孢杆菌木葡聚糖酶的分离纯化及酶学性质研究[J]. 生物技术通报, 2012(7): 126-133.
[6] 路梅, 李多川. 嗜热毛壳菌内切β-葡聚糖酶的分离纯化及特性[J]. 生物学报, 2003, 42(4): 471-477.
[7] 韩晶, 李宝坤, 李开雄, 等. β-葡聚糖酶的特性与应用研究[J]. 中国酿造, 2008, 19(17): 4-7.
[8] 赵志超, 贠建民, 艾对元, 等. 毛霉F-32产β-葡聚糖酶发酵条件优化及其对麦芽溶解性的影响[J]. 食品科学, 2011, 32(1): 199-204.
[9] 赵志超. 产β-葡聚糖酶的菌株筛选及其制麦性能评价[D]. 兰州: 甘肃农业大学, 2012: 1-35.
[10] BAI Yingguo, WANG Jianshe, ZHANG Zhifang, et al. A novel family 9 β-1,3(4)-glucanase from thermoacidophilic Alicyclobacillus sp. A4 with potential applications in the brewing industry[J]. Applied Microbiology and Biotechnology, 2010, 87(1): 251-259.
[11] 孙建义, 李卫芬, 顾赛红, 等. 木霉GXC产β-葡聚糖酶条件和酶学性质[J]. 微生物学报, 2001, 41(4): 458-462.
[12] 李世贵, 顾金刚, 姜瑞波, 等. 生防木霉菌β-1,3-葡聚糖酶活性研究[J]. 微生物学杂志, 2010, 30(4): 88-91.
[13] 彭维, 杨幼慧, 孙远明, 等. 不同温度、pH值对β-葡聚糖酶活力的影响研究[J]. 酿酒科技, 2011(1): 31-33.
[14] TSAO Chingyu, PAN Yunzu, JIANG Shanntzong, et al. Purif cation and characterization of amylases from small abalone (Sulculus diversicolor aquatilis)[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 1064-1070.
[15] FONTAINE T, HARTLAND R P, BEAUVAIS A, et al. Purification and characterization of an endo-1,3-β-glucanase from Aspergillus fumigates[J]. European Journal of Biochemistry, 1997, 243: 315-321.
[16] CELESTINO K R S, CUNHA R B, FELIX C R, et al. Characterization of a β-glucanase produced by Rhizopus microspores var. microsporus, and its potential for application in the brewing industry[J]. BMC Biochemistry, 2006, 7(23): 1-9.
[17] 唐治玉, 段会柯, 熊善柏, 等. 木霉LE02 β-1,3-葡聚糖酶酶学特性的研究[J]. 食品与发酵工业, 2007, 33(5): 32-36.
[18] 李崎, 顾国贤. 利用根霉提高国产麦芽质量的研究[J]. 酿酒科技, 2005(6): 77-80.
[19] 刘妙莲, 林宇野, 王洁, 等. β-葡聚糖酶(EC.3.2.1.73)的研究[J]. 食品与发酵工业, 1989, 15(4): 1-5.
[20] 王云川, 殷蔚申. β-1,3-葡聚糖酶的研究和应用[J]. 微生物学通报, 1998, 25(2): 74-76.
Purification and Enzymatic Properties of β-1,3-1,4-Glucanase Produced by Mucor petrinsularis
DING Ye-mei, YUN Jian-min*, WEI Long, CHEN Fang, AI Dui-yuan, ZHANG Wen-wei
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
In the present study, we optimized the conditions for purifying β-1,3-1,4-glucanase produced by Mucor petrinsularis M-28 in solid-state fermentation, and characterized some enzymatic properties of the purif ed enzyme. The cultured medium was extracted with acetic acid-sodium acetate buffer at pH 5.5 by shaking at 200 r/min for 30 min and the crude enzyme extract was salted out with 80% saturated ammonium sulfate, dialyzed for 24 h, and chromatrographed on a Sephadex G-100 column. As a result, two protein peaks were obtained as determined by UV spectrophotometry. One of these was found to be enzymatically active. The pooled activity peak was highly concentrated using polyethylene glycol before being analyzed for purity by SDSPAGE. It turned out that the purif ed enzyme displayed a single protein band with a molecular weight of 17.2 kD. Its specif c activity was 225.02 U/mg, which was 3.48 times more active than the crude enzyme. The optimum temperature and pH for the enzyme activity were 40 ℃ and 6.0, respectively. The en zyme appeared to be stable at temperatures between 40 and 50 ℃ and in the pH range of 4.0–7.0, respectively. Both Fe3+and Al3+had obvious inhibitory effects on the enzyme. In contrast, Fe2+could obviously activate the enzyme, but other metal ions had a little impact.
Mucor petrinsularis; β-1,3-1,4 -glucanase; separation and purification; enzymatic properti es
TS262.5
A
1002-6630(2014)11-0143-06
10.7506/spkx1002-6630-201411029
2013-07-08
甘肃省科技重大专项计划项目(1002NKDH029);甘肃省自然科学基金项目(1107RJZA128)
丁叶梅(1988—),女,硕士研究生,研究方向为发酵工程。E-mail:731376177@qq.com
*通信作者:贠建民(1968—),男,教授,博士,研究方向为生物工程。E-mail:yunjianmin@gsau.edu.cn

