人参茎叶总皂苷对幼年雄性大鼠生殖系统的影响及作用机制
胡华刚,肖 璇,刘慧敏,孙婉娟,唐晓静,朴香兰,徐斯凡,*
(1. 中央民族大学 中国少数民族传统医学研究国家民委-教育部重点实验室,北京 100081;2. 中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
人参茎叶总皂苷对幼年雄性大鼠生殖系统的影响及作用机制
胡华刚1,肖 璇2,刘慧敏1,孙婉娟1,唐晓静1,朴香兰1,徐斯凡1,*
(1. 中央民族大学 中国少数民族传统医学研究国家民委-教育部重点实验室,北京 100081;2. 中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
目的:研究人参茎叶总皂苷对幼年雄性大鼠生殖系统的影响及作用机制。方法:将40只SD幼年大鼠分为对照组及人参茎叶总皂苷低、中、高剂量给药组,灌胃两周后处死,用放射免疫法检测大鼠血清中睾酮的含量,用酶联免疫试剂盒测量大鼠血清中双氢睾酮、促黄体激素和促卵泡素的含量,称量大鼠的睾丸质量,计算体质量增加量、睾丸脏器系数和精子密度。用高效液相色谱仪对比分析高剂量组大鼠血清和对照组血清中成分的差异。将高剂量组大鼠血清和人参茎叶总皂苷溶液,按0%(对照组)、5%、10%、15%的体积分数分别加到培养的大鼠睾丸间质细胞中,用台盼蓝染色法和噻唑蓝法检测细胞存活率和活力,用放免法检测睾丸间质细胞培养液中睾酮的含量,用大鼠环磷酸腺苷酶联免疫试剂盒检测睾丸间质细胞内环磷酸腺苷的变化。用SPSS软件分析各组间差异。结果:人参茎叶总皂苷能剂量依赖性地显著降低幼年大鼠的血清睾酮水平(P<0.01)、双氢睾酮(P<0.01)水平和精子密度(P<0.01)。与对照组相比,高剂量组大鼠血清中含有5种成分是对照组中所没有的,并且人参茎叶总皂苷给药组的睾丸质量(P<0.05)和体质量增加量(P<0.01)显著降低,血清促黄体激素(P<0.01)、促卵泡素(P<0.01)和睾丸脏器系数显著上升(P<0.05)。人参茎叶总皂苷及其含药血清能抑制睾丸间质细胞内内环磷酸腺苷水平和睾酮的合成。结论:人参茎叶总皂苷可能通过抑制蛋白激酶A途径降低大鼠血清中睾酮的生成,从而抑制睾丸发育和精子生成,影响雄性幼鼠生殖系统的发育。
人参茎叶总皂苷;睾酮;精子;促黄体激素;促卵泡素
人参为五加科人参属植物人参(Panax ginseng C. A. Mey.)的根,是名贵中药,药用历史悠久,始载于《神农本草经》,列为上品[1]。人参味甘、微苦、微温,归脾、肺、心、肾经,能大补元气、复脉固脱、补脾益肺、生津养血、安神益智,用于体虚欲脱、肢冷脉微、脾虚食少、肺虚喘咳、津伤口渴、内热消渴、气血亏虚、久病虚羸、惊悸失眠、阳痿宫冷[2]。人参不仅是名贵药材,2002年卫生部将人参叶和人参列为保健食品;2012年国家卫生部又将人参列为新资源食品,食用部位为根及根茎。
人参的主要功效成分为人参皂苷[3],为了综合利用人参的地上部分,人们于1976年开始对人参茎叶的化学成分进行了研究。人参茎叶总皂苷(total ginsenosides of ginseng stems and leaves,TGSL)是2010年版《中国药典》新收载的品种[4],由于其富含人参皂苷并具有显著的生理活性,一直是国内外学者研究的热点,但是人参茎叶总皂苷对雄性生殖的作用仅有数篇报道,也仅仅局限于腹腔注射人参茎叶总皂苷后对遗传物质保护的实验研究[5-10]。本实验用人参茎叶总皂苷灌胃幼年雄性大鼠研究其在整体情况下对生殖系统的影响,并应用血清药理学的方法研究其对大鼠睾丸间质细胞睾酮分泌的影响及机制。
1 材料与方法
1.1 动物、材料与试剂
出生6周的雄性SD幼年大鼠40只,(100±10)g;由军事医学科学院实验动物中心提供,动物饲养合格证号SCXK(军)2007-004。大鼠维持饲料,由北京科澳协力饲料有限公司生产(京饲审(2009)06166)。
TGSL,购于南京泽朗医药科技有限公司,生产批号HJ091201-Z,用人参皂苷作标准品,紫外分光光度仪检测总皂苷含量为80.33%。
碘(I125)睾酮放射免疫分析药盒(批号100720) 北京北方生物技术研究所;大鼠双氢睾酮(dihydrotestosterone,DHT)酶联免疫检测试剂盒(FA02073B)、大鼠促黄体激素(luteinizing hormone,LH)酶联免疫检测试剂盒(FA02131B)、大鼠促卵泡素(follicle-stimulating hormone,FSH)酶联免疫检测试剂盒(FA02107B)、大鼠环磷酸腺苷(cyclic adenosine monophosphate,cAMP)酶联免疫检测试剂盒(FA02090B) 上海沪峰生物科技有限公司;DMEM/F12培养基 美国Gibco公司;胎牛血清 美国Hyclone 公司;Ⅱ型胶原酶、噻唑蓝 美国Sigma公司。
1.2 仪器与设备
XP205型分析天平 瑞士Mettler-Toledo 公司;γ放射免疫计数仪 上海核所日环光电仪器有限公司;scientz-IID型超声波细胞粉碎仪 宁波新芝生物科技股份有限公司;SPD-M20A高效液相色谱仪 日本岛津公司;Benchepark Plus型酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 动物实验
将雄性SD幼年大鼠分为对照组及人参茎叶总皂苷低、中、高剂量组,共4组,每组10只。人参茎叶总皂苷灌胃幼年大鼠的低、中、高剂量分别是0.175、0.35、0.7 g/(kg·d)(以体质量计),对照组灌胃等体积双蒸水,连续灌胃两周[11]。
末次给药前12 h称质量,禁食不禁水,灌胃90 min后股动脉取血。颈椎脱臼处死大鼠,摘取左侧睾丸,称质量。
1.3.2 给药期间大鼠体质量增长量的测量

1.3.3 精子密度
颈椎脱臼处死大鼠,取出左侧附睾置于20 mL小烧杯中,加0.1%葡萄糖任氏液2 mL,剪碎,振荡,在30 ℃水浴锅中保温10 min使精子移动到溶液中,取一滴置血球计数板上,显微镜下计算精子密度[12]。
1.3.4 血清中相关指标的测定
全血放在4 ℃冰箱中静置过夜,低温3 000 r/min离心10 min得血清。用试剂盒测定血清中睾酮、DHT、LH和FSH的含量。
1.3.5 给药组血清和对照组血清中成分的对比分析
从高剂量组和对照组的每只大鼠血清中各取0.5 mL集中到10 mL EP管中,加入5 mL甲醇涡旋5 min,10 000 r/min离心10 min,取上清,上清液在40 ℃条件下旋转蒸发,向其中加入1 mL甲醇溶解后转移到1.5 mL的EP管中15 000 r/min离心10 min,上清液过滤膜后,用高效液相色谱仪在25 ℃、203 nm波长处以0.2 mL/min的流速分析高剂量组血清和对照组血清中成分的差异,色谱条件见表1。

表1 高剂量组血清和对照组血清中成分对比分析的HPLC条件Table 1 HPLC conditions for analyzing the composition difference in serum from high dose group and control group
1.3.6 TGSL及其含药血清对大鼠睾丸间质细胞分泌功能的影响
1.3.6.1 TGSL溶液的配制
将TGSL溶于DMEM/F12培养液配制成质量浓度为10 mg/mL的溶液,按照无菌操作和互不污染的要求用无菌注射器吸取含药血清,通过0.22 μm一次性无菌滤器,分装到带有标记的EP管中,每管约1 mL,将这些EP管放置于-80℃冰箱备用。
1.3.6.2 含药血清的处理
从高剂量给药组的每只大鼠血清中各取0.5 mL集中到10 mL试管中,置于57 ℃水浴锅中灭活30 min。将已灭活的含药血清按照无菌操作和互不污染的要求用无菌注射器吸取含药血清,通过0.22 μm一次性无菌滤器,分装到带有标记的1.5 mL EP管中,每管约1 mL,将这些EP管放置于-80℃冰箱备用[13]。
1.3.6.3 大鼠睾丸间质细胞的培养[14]
颈椎脱臼处死大鼠,按照无菌操作的要求,取出睾丸,4 ℃磷酸缓冲液液中清洗3次后置于冰浴的培养皿中,用眼科镊剥离被膜、血管,将剥离好的睾丸用磷酸缓冲液清洗3次,置于两个50 mL离心管中,加入Ⅱ型胶原酶缓冲液,35 ℃水浴中消化15 min,适当摇晃。吸出上部液体后通过200目尼龙过滤网过滤。收集滤液于离心管,900 r/min离心10 min,弃去上清液,再加入磷酸缓冲液,摇匀,900 r/min离心10 min,如此共反复漂洗5次,弃上清。用含胎牛血清的DMEM/F12培养液调整细胞浓度为2.5×106个/mL,340 øL/孔接种到48孔板,在35 ℃、5% CO2培养箱中培养4 h后加入含药血清或TGSL溶液。
将培养的大鼠睾丸间质细胞分为7组,分别加入60 øL的DMEM/F12培养液作为对照组、20 øL的TGSL溶液和40 øL的DMEM/F12培养液、40 øL的TGSL溶液和20 øL的DMEM/F12培养液、60 øL的TGSL溶液、20 øL的高剂量给药组大鼠含药血清和40 øL的DMEM/F12培养液、40 øL的高剂量给药组大鼠含药血清和20 øL的DMEM/F12培养液、60 øL的高剂量给药组大鼠含药血清,使TGSL溶液及其含药血清的体积分数分别为0%(对照组)、5%、10%、15%。每组设12个复孔。
1.3.6.4 睾丸间质细胞睾酮分泌的测量,细胞存活率和活力的检测[14]
加入TGSL溶液及其含药血清4 h后,收集孔板中每孔的上清液,用放射免疫试剂盒测量上清液中睾酮的含量,将上清液吸去后加入200 øL 0.05%的胰酶,轻轻吹打2 min后加入200 øL含胎牛血清的DMEM/F12培养液,取一滴细胞悬液滴于载玻片上,加一滴0.4%的台盼蓝溶液,混匀,静置3 min加盖玻片,显微镜下观察,活细胞为无色透明,死细胞为蓝色,计算每组细胞的存活率。
加入TGSL溶液及其含药血清4 h后,向孔板加入20 øL/孔的5 mg/mL的噻唑蓝溶液(以无血清培养基配制),继续培养4 h后仔细吸去上清,每孔加入400 øL二甲基亚砜(dimethyl sulfoxide,DMSO),轻轻振荡,1 h后在570 nm波长处用酶标仪测定吸光度,以观测TGSL溶液及其含药血清对睾丸间质细胞活力的影响。
1.3.6.5 cAMP含量的测定
加入TGSL溶液及其含药血清4 h后,吸去上清液,用PBS液清洗3次后,再加入400 øL的PBS液,用超声波细胞粉碎仪使睾丸间质细胞破碎。吸取每孔的混悬液,15 000 r/min离心10 min得上清液,用cAMP酶联免疫试剂盒检测各组细胞中cAMP的含量。
1.3.7 统计分析
采用SPSS18.0软件进行统计分析,组间采用单因素方差分析,所有数据均用 ±s表示。
2 结果与分析
2.1 TGSL对幼年大鼠血清睾酮和DHT含量的影响
由表2可见,与对照组相比,给药组幼年大鼠血清中睾酮和DTH含量剂量依赖性地显著下降(P<0.01)。
表2 人参茎叶总皂苷对幼年大鼠血清睾酮和DHT含量的影响TTaabbllee 22 EEffffeecctt of TGSL on the contents of testosterone and DHT in
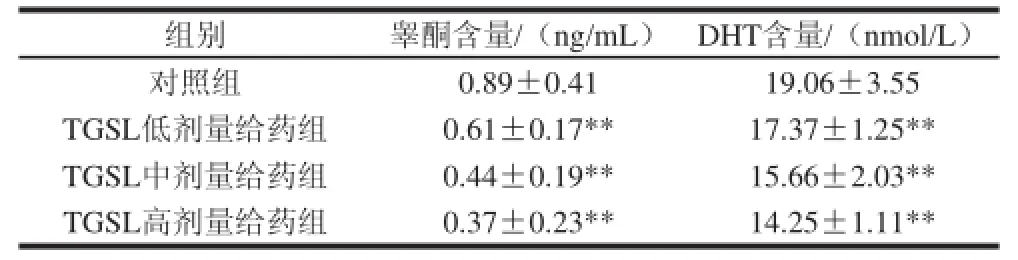
表2 人参茎叶总皂苷对幼年大鼠血清睾酮和DHT含量的影响TTaabbllee 22 EEffffeecctt of TGSL on the contents of testosterone and DHT in
注:**.与对照组相比,有极显著差异(P<0.01)。下同。
组别 睾酮含量/(ng/mL) DHT含量/(nmol/L)对照组 0.89±0.41 19.06±3.55 TGSL低剂量给药组 0.61±0.17** 17.37±1.25** TGSL中剂量给药组 0.44±0.19** 15.66±2.03** TGSL高剂量给药组 0.37±0.23** 14.25±1.11**
2.2 TGSL对幼年大鼠血清中FSH和LH含量的影响
表3 人参茎叶总皂苷对幼年大鼠血清中FSH和LH含量的影响TTaabbllee 33 EEffffect of TGSL on the contents of FSH and LH in serum

表3 人参茎叶总皂苷对幼年大鼠血清中FSH和LH含量的影响TTaabbllee 33 EEffffect of TGSL on the contents of FSH and LH in serum
组别 FSH含量/(IU/L) LH含量/(ng/L)对照组 4.32±0.17 13.62±0.18 TGSL低剂量给药组 4.63±0.16** 14.42±0.24** TGSL中剂量给药组 4.75±0.25** 14.98±0.19** TGSL高剂量给药组 4.89±0.43** 15.43±0.25**
由表3可见,与对照组相比,TGSL给药组幼年大鼠血清中FSH和LH含量剂量依赖性地显著增加(P<0.01)。
2.3 TGSL对幼年大鼠睾丸质量、体质量和睾丸脏器系数的影响
表4 人参茎叶总皂苷对幼年大鼠睾丸质量、体质量和睾丸脏器系数的影响Table 4 Effect of TGSL on testis weight, body weight and testis weight coeffi
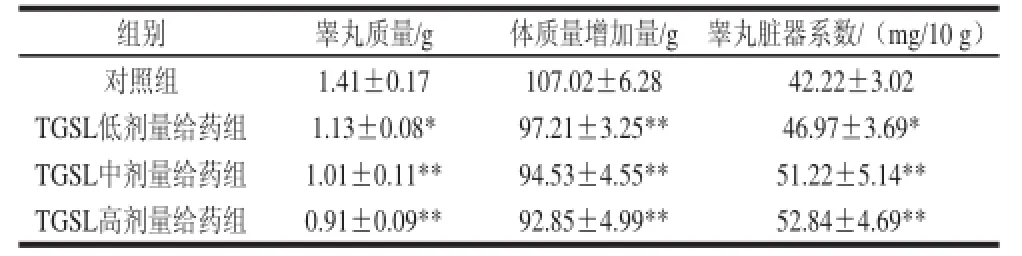
表4 人参茎叶总皂苷对幼年大鼠睾丸质量、体质量和睾丸脏器系数的影响Table 4 Effect of TGSL on testis weight, body weight and testis weight coeffi
注:*.与对照组相比,有显著差异(P<0.05)。下同。
组别 睾丸质量/g 体质量增加量/g 睾丸脏器系数/(mg/10 g)对照组 1.41±0.17 107.02±6.28 42.22±3.02 TGSL低剂量给药组 1.13±0.08* 97.21±3.25** 46.97±3.69* TGSL中剂量给药组 1.01±0.11** 94.53±4.55** 51.22±5.14** TGSL高剂量给药组 0.91±0.09** 92.85±4.99** 52.84±4.69**
由表4可见,与对照组相比,TGSL给药组的睾丸质量显著降低(P<0.05或P<0.01),体质量的增加量极显著降低(P<0.01),睾丸脏器系数显著提高(P<0.05或P<0.01)。
2.4 TGSL对幼年大鼠精子密度的影响

表5 人参茎叶总皂苷对幼年大鼠精子密度的影响Table 5 Effect of TGSL on sperm density of juvenile male rats
由表5可见,与对照组相比,TGSL给药组幼年大鼠的精子密度剂量依赖性地显著降低(P<0.01)。
2.5 给药组血清和对照组血清中成分的对比分析
如图1所示,与对照组相比,TGSL高剂量组大鼠血清中有5个成分是对照组中所没有的(箭头标示处)。
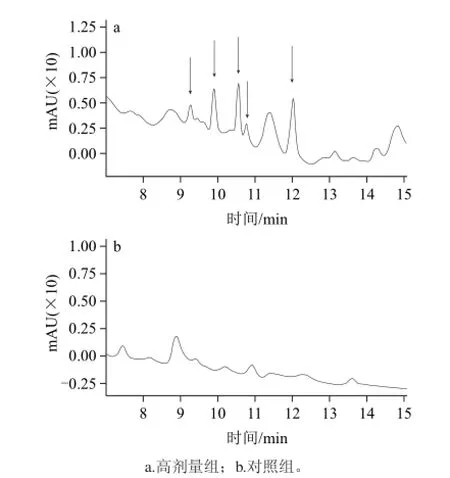
图1 高剂量组血清和对照组血清中成分对比分析的高效液相色谱图Fig.1 Comparative analysis by HPLC of serum components of the high dose group and the control group
2.6 TGSL及其含药血清对大鼠睾丸间质细胞存活率和细胞活力的影响
表6 人参茎叶总皂苷及其含药血清对大鼠睾丸间质细胞存活率和活力的影响Table 6 Effects of rat serum containing TGSL and TGSL on the viability and vitality of leydig cells

表6 人参茎叶总皂苷及其含药血清对大鼠睾丸间质细胞存活率和活力的影响Table 6 Effects of rat serum containing TGSL and TGSL on the viability and vitality of leydig cells
组别 体积分数/% 细胞存活率/% A570nm对照组 0 98±1 1.25±0.09 TGSL溶液5 95±2 1.01±0.09* 10 96±2 0.89±0.05** 15 94±2 0.78±0.16** TGSL含药血清5 97±2 1.19±0.05 10 97±2 1.03±0.08** 15 96±2 0.92±0.11**
由表6可见,与对照组相比,加入TGSL及其含药血清后睾丸间质细胞的活率无变化,但是细胞的活力随着含药血清体积分数的增加而显著下降(P<0.01)。
2.7 TGSL及其含药血清对大鼠睾丸间质细胞睾酮分泌和细胞内cAMP含量的影响

表7 人参茎叶总皂苷及其含药血清对睾丸间质细胞睾酮分泌和细胞内cAMP的影响(x ±s,n==1122)Table 7 Effect of rats serum containing TGSL and TGSL on testosterone and cAMP levels in leydig cell (x ±s,, n = 1122))
由表7可见,与对照组相比,加入TGSL及其含药血清后,睾丸间质细胞培养液中睾酮的含量剂量依赖性显著下降(P<0.01),睾丸间质细胞内cAMP的含量随着含药血清体积分数的增加而显著下降(P<0.01)。
3 讨 论
雄性的主性器官是睾丸。睾丸分泌的最主要雄激素为睾酮,主要来自睾丸间质细胞。睾酮能通过血睾屏障进入曲细精管,与生精细胞内的睾酮受体结合,促进精子发生和成熟。睾酮与支持细胞分泌的雄激素结合蛋白相结合,可提高曲细精管内睾酮的浓度,维护着精子发生的特殊环境,临床上睾酮缺乏的患者表现为原发性无精子或精子发生完全停止[15-16]。
本实验用TGSL灌胃雄性幼年大鼠两周后,发现幼年大鼠血清睾酮和精子密度显著降低。这是由于TGSL抑制了睾酮的分泌,睾酮水平的降低抑制精子的发生。
经5α-还原酶的作用,睾酮转化为双氢睾酮[17]。本实验研究显示TGSL灌胃雄性幼龄大鼠两周后,给药组大鼠血清中双氢睾酮含量显著低于对照组,推测是由于给药组大鼠血清中睾酮含量的显著下降使得双氢睾酮的水平也相应下降,或者TGSL可能通过抑制5α-还原酶的作用从而降低血清中双氢睾酮的含量。
在青春期,睾酮和双氢睾酮的大量分泌能促进性器官和副性器官的生长发育,促进第二性征的出现,并维持其正常状态,表现为睾丸增大、阴茎变长、出现胡须等雄性体征,开始分泌精液[18]。睾酮能促进青春期阶段的蛋白质合成(同化作用),抑制蛋白质的降解(异化作用),促进骨骼的生长和钙磷在骨中沉淀,还能提高基础代谢率,使肌肉增长,体质量增加[19]。
本实验用大鼠为6周龄雄性幼年大鼠,饲养两周后大鼠已进入了性成熟阶段,本实验覆盖大鼠的性成熟过程。TGSL灌胃雄性幼年大鼠两周后,发现幼年大鼠睾丸质量、体质量增加量显著降低,但是睾丸脏器系数显著升高。这可能是由于TGSL抑制大鼠睾酮的分泌,睾酮水平的显著下降抑制了幼年大鼠睾丸的发育和蛋白质的合成,从而使睾丸质量和体质量的增加量显著降低。在睾丸脏器系数的计算公式中,睾丸质量是分子,体质量是分母,由于体质量随着给药剂量的增加而显著降低,所以睾丸脏器系数随着给药剂量的增加而显著升高。
下丘脑-垂体-睾丸是最重要的男性生殖轴。下丘脑分泌促性腺激素释放激素,经垂体门脉系统到达腺垂体远侧部,作用于促性腺激素细胞,使之分泌LH、FSH。LH和FSH再经血液运输到睾丸,与睾丸内细胞上的受体结合,从而启动间质细胞内睾酮的合成和产生其他生物学效应[20]。当血中睾酮升高到一定程度后,睾酮又可以负反馈方式作用于下丘脑和腺垂体,分别抑制促性腺激素释放激素、FSH和LH的分泌,从而使血液中的睾酮浓度维持在一定的水平[21]。本实验中,人参茎叶总皂苷给药组血清睾酮浓度显著降低,睾酮对下丘脑和垂体的负反馈抑制减弱,所以大鼠血清中LH和FSH的浓度显著上升。
在睾丸间质细胞内,cAMP的主要作用是促进类固醇激素的合成,进而使睾酮的分泌量增加。cAMP对类固醇生成途径的作用之一是加速胆固醇裂解成孕烯醇酮,这是所有类固醇生物合成的第一步。cAMP作用的可能途径有[22]:1)增大还原性辅酶Ⅱ的浓度,这是胆固醇裂解为孕烯醇酮所需的辅因子;2)通过激活胆固醇酯酶,提高胆固醇的浓度;3)转运胆固醇进入线粒体,在胆固醇侧链裂解酶的作用下,胆固醇被裂解成孕烯醇酮;4)激活胆固醇侧链裂解酶系统;5)转运孕烯醇酮离开线粒体。细胞内cAMP水平升高,激活蛋白激酶A。蛋白激酶A能将睾丸间质细胞内某些特定的调控因子或酶上的丝氨酸和苏氨酸磷酸化,从而启动Leydig细胞内合成睾酮的酶系统[20]。所以说,cAMP是睾丸间质细胞内促进睾酮合成的主要信使之一。
本实验用高效液相色谱分析高剂量组大鼠血清和对照组血清中成分的差异,发现高剂量组大鼠血清中有5个成分是对照组中所没有的,这说明TGSL能够被雄性大鼠吸收或转化,并移行入血,形成TGSL的药效物质,从而对雄性大鼠生殖系统产生药理作用,但是由于血清中的成分含量很低,暂时不能确定这5种物质的结构。
将TGSL及高剂量组的大鼠含药血清按不同体积分数加入到体外培养的睾丸间质细胞中,发现细胞的活率无显著变化,但是细胞活力、睾丸间质细胞的睾酮分泌能力和细胞内的cAMP水平随着体积分数的增加而显著降低。这说明,TGSL及含药血清中的有效成分可能通过蛋白激酶A途径抑制间质细胞睾酮的合成,从而使血清中的睾酮水平下降。同时,这也揭示了在动物实验中给药组大鼠LH和FSH升高,但是给药组大鼠血清中睾酮水平依然显著下降的原因。
TGSL能使幼年雄性大鼠血清中睾酮和DHT水平显著降低,进而使精子密度、睾丸质量和体质量增加量显著降低。这在保健品的食用方面给予我们一个提示,男性青少年儿童不宜长时间或大量食用含有人参叶或人参的保健品或食品,这会影响他们生殖系统的发育。
另外,前列腺癌、前列腺增生、脂溢性脱发等与雄激素关系密切[23]。目前,前列腺癌内分泌治疗的机制是降低血液循环中的雄激素水平[24]。本研究发现,TGSL能显著降低大鼠血清睾酮和双氢睾酮浓度,这提示可进一步研究TGSL对上述病症的预防和治疗。
参考文献:
[1] 高学敏. 中药学[M]. 北京: 中国中医药出版社, 2002: 497.
[2] 李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 2010: 563-567.
[3] 黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164.
[4] 国家药典委员会. 中国药典. 一部[S]. 北京: 中国医药科技出版社, 2010: 365.
[5] 朱玉琢, 邢沈阳, 孙凯, 等. 人参茎叶总皂甙的遗传毒性研究[J]. 卫生毒理学杂志, 1994, 8(2): 114-115.
[6] 房学东, 卢尧, 刘建伟. 人参茎叶总皂甙对小鼠体细胞及生殖细胞的诱变研究[J]. 吉林中医药, 1996(3): 38-39.
[7] 朱玉琢, 邢沈阳, 庞慧民, 等. 人参茎叶总皂甙对遗传物质损伤的防护作用[J]. 白求恩医科大学学报, 1994, 20(4): 340-341.
[8] 姜官凤, 孙凯. 人参茎叶总皂甙对小鼠雄性生殖细胞的诱变研究[J].白求恩医科大学学报, 1992, 18(2): 110.
[9] 朱玉琢, 刘冰, 孙凯. 人参茎叶总皂甙对甲基磺酸甲酯诱发小鼠精子非程序DNA合成的抑制作用[J]. 卫生毒理学杂志, 1993, 7(4): 244-245.
[10] 卢尧, 庞慧民, 武广恒. 人参茎叶总皂甙对遗传物质损伤的修复作用及其时间效应[J]. 癌变·畸变·突变, 1994, 6(3): 10-11.
[11] 许立, 刘晓辉, 张莉. 人参总皂苷对小鼠睾丸NO、NOS及总抗氧化能力的影响[J]. 武警医学院学报, 2006, 15(5): 507-508.
[12] 魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010: 1401.
[13] 李仪奎. 中药药理实验方法学[M]. 2版. 上海: 上海科学技术出版社, 2006: 50-61.
[14] 郑娟, 赵莹, 王丽蕃, 等. 藏党参皂苷对睾丸间质细胞的影响及作用机制[J]. 中国实验方剂学杂志, 2011, 17(22): 145-148.
[15] 姚泰. 生理学[M]. 北京: 人民卫生出版社, 2003: 602.
[16] 宋博, 蔡志明. 精子形成的调控机制及其进展[J]. 现代泌尿外科杂志, 2011, 16(6): 575-576.
[17] 潘继升, 王永晨, 蔡丽敏. 5α-还原酶在相关疾病中的作用[J]. 医学综述, 2011, 17(17): 2571-2573.
[18] 窦兆华. 生殖生物学[M]. 北京: 人民卫生出版社, 2007: 37.
[19] 洪锴, 姜辉. 睾酮对骨骼系统、肌肉和脂肪的影响[J]. 国际生殖健康/计划生育杂志, 2011, 30(1): 26-28.
[20] 王一飞. 人类生殖生物学[M]. 上海: 上海科学技术文献出版社, 2005: 49; 46-47.
[21] 王颖, 佟倜, 孙迎春. 下丘脑-垂体-睾丸轴激素的振荡行为与非线性动力学模型[J]. 东北师范大学学报, 2009, 41(2): 92-94.
[22] 朱长虹. 生殖药理学[M]. 北京: 人民卫生出版社, 2007: 13.
[23] 张树栋, 马潞林. 雄激素缺乏与老年疾病的关系[J]. 临床泌尿外科杂志, 2008, 23(4): 317-319.
[24] CANNATA D H, KIRSCHENBAUM A, LEVINE A C. Androgen deprivation therapy as primary treatment for prostate cancer[J]. J Clin Endocrinol Metab, 2012, 97(2): 360-365.
Effects of Total Ginsenosides from Ginseng Stems and Leaves on Reproductive System of Juvenile Male Rats and Its Mechanism
HU Hua-gang1, XIAO Xuan2, LIU Hui-min1, SUN Wan-juan1, TANG Xiao-jing1, PIAO Xiang-lan1, XU Si-fan1,*
(1. State Nationalities Affairs Commission and Department of Educational Key Laboratory of Minority Traditional Medicine, MINZU University of China, Beijing 100081, China; 2. Institute of Medicinal Plant Development, Peking Union Medical College & Chinese Academy of Medical Sciences, Beijing 100193, China )
Objective: To study the effect of total ginsenosides from ginseng stems and leaves (TGSL) on the reproductive system of juvenile male rats and its mechanism. Methods: Forty SD rats were randomized into control group and three administration groups. The administration groups and control group were given TGSL at high, middle and low doses and water by intragastric administration, respectively. After administration for two weeks, testosterone, dihydrotestosterone (DHT), luteinizing hormone (LH), follicle-stimulating hormone (FSH), testis weight, body weight, testis weight coefficient and sperm density were tested. The difference in serum components between high dose group and control group was compared by HPLC. TGSL and serum from the high-dose group were added into the culture medium of rat leydig cells, respectively, at volume fractions of 0 (control group), 5%, 10% and 15%. Leydig cell viability and vitality, the content of testosterone in cell culture medium and intracellular cAMP were measured. The content of testosterone was tested by radioimmunoassay. DHT, FSH, LH and intracellular cAMP were measured by ELISA. Cell viability and vitality of cultured rat leydig cells were tested by placenta blue staining and MTT assay. Finally, SPSS software was used to analyze the differences among different groups.Results: The contents of testosterone and DHT in serum and sperm density of three administration groups significantly reduced in a dosedependent manner by total ginsenosides (P < 0.01). Compared with the control group, testis weight (P < 0.05) and the increase of rat body weight (P < 0.01) in the administration groups significantly decreased, but the contents of LH and FSH (P < 0.01) in serum and testis weight coefficient (P < 0.05) in the administration groups significantly increased. Five compounds were detected in the serum from the high dose group with HPLC, but were not observed in the serum from the control group. The secretion of testosterone and intracellular cAMP in leydig cells could be inhibited by TGSL and TGSL-containing serum. Conclusion:TGSL may reduce the generation of testosterone in serum of juvenile male rats through PKA pathway to inhibit testicular development and sperm production, and then affect the growth and development of the reproductive system of juvenile male rats.
total ginsenosides from ginseng stems and leaves; testosterone; spermatozoa; luteinizing hormone; folliclestimulating hormone
TS202.1
A
1002-6630(2014)03-0187-06
10.7506/spkx1002-6630-201403038
2013-05-22
国家自然科学基金面上项目(30973956)
胡华刚(1983—),男,博士研究生,研究方向为生殖药理学。E-mail:tangang_666@163.com
*通信作者:徐斯凡(1953—),男,教授,本科,研究方向为民族药药理学。E-mail:sifanxu@126.com

