菌株Bacillus sp.CLb芽孢漆酶对染料、模拟染料废水脱色的研究
李凡姝,刘海洋,范丽莉,王天女,戴绍军,赵 敏,汪春蕾*
(1.东北林业大学,黑龙江哈尔滨 150040;2.黑龙江省实验中学,黑龙江哈尔滨 150001;3.哈尔滨工业大学理学院,黑龙江哈尔滨 150001)
菌株Bacillus sp.CLb芽孢漆酶对染料、模拟染料废水脱色的研究
李凡姝1,刘海洋2,范丽莉3,王天女1,戴绍军1,赵 敏1,汪春蕾1*
(1.东北林业大学,黑龙江哈尔滨 150040;2.黑龙江省实验中学,黑龙江哈尔滨 150001;3.哈尔滨工业大学理学院,黑龙江哈尔滨 150001)
[目的]研究芽孢杆菌菌株CLb的芽孢漆酶在介体的互作下对不同类型的染料及模拟染料废水的脱色效果。[方法]制备芽孢粗酶液,在介体的互作下,测定具有漆酶活性的粗酶液对活性亮蓝、活性黑、靛红和结晶紫的脱色效果,筛选出对染料脱色有促进作用的漆酶介体,并且研究芽孢漆酶在不同pH条件下对染料和模拟染料废水脱色的影响。[结果]菌株CLb的芽孢漆酶在无介体参与下只能使活性亮蓝和结晶紫脱色。在介体乙酰丁香酮(ACE)的作用下,芽孢漆酶对4种染料的脱色率均超过70%。在pH 7.0条件下,芽孢漆酶浓度为44.74 U/L和介体ACE浓度为1 mmol/L时对模拟染料废水的脱色效果最好,6 h脱色率超过80%。在介体乙酰丁香酮存在,pH 7.0的条件下,菌株CLb的芽孢漆酶对合成染料脱色效率高于pH 9.0时的脱色率。[结论]在介体乙酰丁香酮的存在下,芽孢漆酶对染料和模拟染料废水均具有较好的脱色效果。
芽孢漆酶;模拟染料废水;染料脱色
合成染料被广泛应用于纺织工业、医药、化妆品和食品等行业。全球每年生产100 000多种染料,并且数量超过800 000 t[1]。我国生产的染料占全球产量的40%,并且每年以高于30%的速率增长[2]。以显色基团划分的染料有偶氮、蒽醌和靛蓝类,其中偶氮染料为染料的最大族群,70%的偶氮染料被应用于纺织品加工[3]。合成染料的生产成本低,相比于天然染料它对各种颜色的配色有更好的稳定性和有效性[4]。在染色过程中,高达15%的染料被排放到废水中[5],印染废水中的染料不易分离,大量的染料被释放到环境中,导致严重的环境污染[6]。
目前,治理印染废水的方法有物理法、化学法和生物法[7-8]。物理法和化学法不仅成本高,效率低,而且产生许多不易降解的污染物以及有毒的副产物,造成二次污染,在工业应用中受到一定程度的限制[9]。生物处理法主要是利用各种微生物转化酶如漆酶通过吸附或降解的方式去除废水中的染料[10]。白腐真菌和某些细菌对合成染料具有一定的脱色能力。因此,有效治理印染废水,首要任务是筛选具有生物转化酶的菌株,并且对其染料脱色能力进行研究。虽然已发现一些细菌菌株能使蒽醌[11]、偶氮[12]和三苯甲烷[13]染料脱色,但能够同时对3种染料脱色的细菌菌株鲜见报道。笔者以具有漆酶活性的芽孢杆菌Bacillussp.CLb为试验材料,研究芽孢漆酶在介体存在时对偶氮、蒽醌、靛蓝以及三苯甲烷类合成染料的脱色能力,发现它对靛红、活性黑和结晶紫的脱色效果较显著,6 h脱色率均高于90%。这为细菌漆酶应用于染料废水治理提供了一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种。供试菌种为实验室保藏的芽孢杆菌菌株Bacillussp.CLb。
1.1.2 培养基。LB培养基(1 L)组成为:酵母粉5 g、胰蛋白胨10 g、NaCl 10 g、琼脂15 g,pH 7.0。
1.2 方法
1.2.1 芽孢粗酶液的制备。菌株Bacillussp.CLb的芽孢外壁上的蛋白具有漆酶活性,含有芽孢的酶液即为粗酶液。参照文献[14]的方法制备芽孢粗酶液。
1.2.2 芽孢漆酶活性的测定。漆酶活性测定的体系为3 ml,含有0.2 mol/L 磷酸氢二钠 -0.1 mol/L柠檬酸缓冲液、0.5 mol/L丁香醛连氮以及一定体积的粗酶液。反应在37℃条件下进行,3min后测定OD525。重复3次,取平均值。1个漆酶活力单位定义为在1 min内氧化1μmol底物所需要的酶量[15]。
1.2.3 芽孢漆酶对染料的脱色以及介体的筛选。利用活性亮蓝(RBBR)、活性黑(RB5)、靛红(IC)以及结晶紫(CV),研究菌株Bacillussp.CLb芽孢漆酶对染料的脱色情况。脱色体系中包含0.2 mol/L磷酸氢二钠-0.1 mol/L柠檬酸缓冲液(pH 7.0)、染料(终浓度和最大吸收波长见表1)、芽孢粗酶液(终浓度为47.78 U/L)以及各种介体。选用乙酰丁香酮(ACE)、2,2,6,6-四甲基哌啶氧化物(TE)、1- 羟基苯并三唑(HBT)、2,2′-联氮-双-(3-乙基苯并噻唑-6-磺酸)(ABTS)、丁香醛(SYR)以及10-(3-二甲氨基丙)吩嗪(PZ)等介体。除ABTS的终浓度为0.01 mmol/L外,其余的介体浓度均为0.1mmol/L,同时设不加介体的芽孢粗酶液体系为空白对照。40℃水浴锅中振荡脱色,定时取样,7 800 r/min,离心3 min后吸取上清。在各染料的最大吸收波长处,测定吸光值,计算脱色率。
脱色率=(A0-A)/A0×100%
式中,A0为初始染料吸光值;A为定期取样测得的吸光值。重复测定3次,取平均值。

表1 染料类型、终浓度及最大吸收波长
1.2.4 不同pH对染料脱色的影响。选用ACE为介体,参照“1.2.3”的方法,研究 pH 7.0 和 pH 9.0 条件下芽孢漆酶对染料的脱色效果。每隔2 h取样,测定染料的吸光值,计算脱色率。重复3次,取平均值。
1.2.5 模拟染料废水脱色中芽孢漆酶浓度的优化。参考模拟染料废水的配制文献[16],按照比例加入4种染料以及100 mg/L(NH4)2SO4、100mg/LNa2CO3、25 mg/L CaCl2、25 mg/L KCl、25mg/LCaHPO4以及 25mg/LMgSO4,制成模拟染料废水。通过全波长扫描,得出模拟染料废水的最大吸收波长为600 nm。用模拟染料废水取代染料加入到6ml脱色体系中,缓冲液pH 选用7.0和9.0,选取最适的介体ACE,其浓度为0.1 mmol/L,比较不同pH条件下不同芽孢漆酶浓度对模拟染料废水脱色率的影响,芽孢漆酶的浓度分别为44.74、95.56 和143.34 U/L。每隔 2 h 取样,测定OD600,计算其脱色率。重复3次,取平均值。
1.2.6 模拟染料废水脱色中介体乙酰丁香酮浓度的优化。在pH 7.0的条件下,参照“1.2.5”的模拟染料废水的脱色体系,分别选用44.74、95.56 和 143.34 U/L 的粗酶液,研究介体ACE浓度分别为0.1、0.5和1.0 mmol/L时对模拟染料废水脱色效果的影响。设不加介体的体系为空白对照。定时取样,测定OD600,计算其脱色率。重复3次,取平均值。
2 结果与分析
2.1 介体筛选 在不含介体的脱色体系中,菌株CLb的芽孢粗酶液对结晶紫的脱色效果好,在6 h内脱色率为75.03%。由表2可知,6种介体在活性亮蓝的脱色中均起促进作用,其中ACE和SYR的影响较明显。仅ACE在活性黑的脱色中有促进作用。ACE和SYR在靛红的脱色中有促进作用,在SYR作用下对靛红的脱色率可高达96.78%。除HBT外,其他5种介体对结晶紫的脱色均有一定的促进作用,ACE的效果较好,对结晶紫的脱色率达到91.18%。由此可知,介体乙酰丁香酮对各染料的脱色效果均起到较好的促进作用。
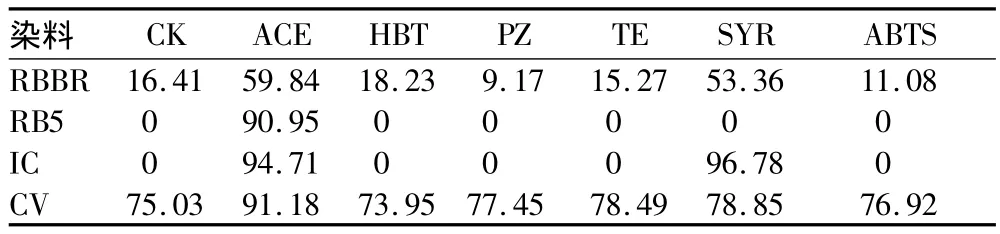
表2 在6种介体的作用下芽孢漆酶对染料的脱色率 %
2.2 不同pH对染料脱色的影响 由图1可知,在脱色体系中加入0.1mmol/L ACE,缓冲液 pH 为7.0,菌株Bacillussp.CLb芽孢漆酶在4 h内对活性黑以及在2 h内对靛红的脱色率均达到93%,在6 h内对活性亮蓝和结晶紫的脱色率分别为79.0%和92.5%。由图2可知,当缓冲液pH为9.0时,菌株Bacillussp.CLb芽孢漆酶同样能使活性黑、靛红和结晶紫脱色,在4 h内它们的脱色率依次为 81.0%、85.3%和93.5%。在40℃条件下,芽孢漆酶在pH 7.0的条件下对活性黑和靛红的脱色效果要比在pH 9.0的条件下好,pH对结晶紫的脱色效果影响差别不大。

图1 ACE对各染料脱色率的影响(pH 7.0)
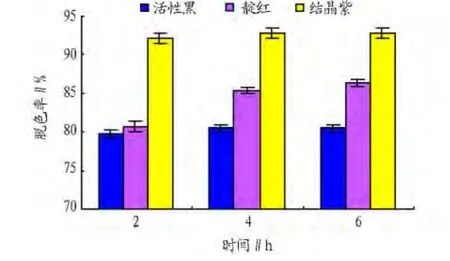
图2 ACE对各染料脱色率的影响(pH 9.0)
2.3 芽孢漆酶浓度对模拟染料废水脱色的影响 由图3可知,缓冲液 pH 7.0,在0.1 mmol/L ACE 介导下,随着芽孢漆酶浓度的增加,模拟染料废水的脱色率也增加,2 h的脱色率均超过60%。经过6 h脱色反应,其脱色率依次可达到80.42%、80.24%和 84.34%。由图 4 可知,缓冲液 pH 9.0,脱色2 h后,随着酶浓度的提高,对模拟染料废水的脱色率由49.82%提高至63.77%,随着脱色反应时间的延长,反应6 h后脱色率均高于65%。可见,随着酶浓度的增加,它对模拟染料废水的脱色率也提高,芽孢漆酶在pH 7.0的条件下对模拟染料废水的脱色效果比在pH 9.0时明显。

图3 芽孢漆酶对模拟染料废水脱色率的影响(pH 7.0)

图5 不同芽孢漆酶浓度下ACE浓度对模拟染料废水脱色率的影响

图4 芽孢漆酶对模拟染料脱色率的影响(pH 9.0)
2.4 乙酰丁香酮浓度对模拟染料废水脱色的影响 由图5可知,在pH 7.0,不含介体的条件下,当芽孢漆酶浓度为44.74U/L时,对模拟染料脱色率仅为28.75%,随着脱色时间的增加,脱色率呈上升的趋势,但是脱色效果不明显。当脱色体系中加入不同浓度的ACE时,脱色率明显提高,脱色6 h后脱色率均高于80%。当芽孢漆酶浓度为95.56和143.34 U/L时,介体作用6 h后,对模拟染料废水的脱色率同样超过80%。可见,芽孢漆酶的最适脱色浓度为44.74 U/L,介体ACE的浓度达到1mmol/L时对模拟染料废水的脱色效果最好。
3 讨论
漆酶能催化氧化多酚类化合物,同时分子氧被还原为水。研究表明,非漆酶底物可以在小分子介体存在时被漆酶氧化。介体主要通过电子转移的方式,形成阳离子自由基,促进非漆酶底物型物质的氧化分解[17]。有研究表明,小分子介体能促进漆酶对染料的氧化反应[18]。
介体按照来源可分为天然介体和人工合成介体。大多数人工介体稳定性差、成本高且效率低,易于吸附在纤维表面,且具有一定的毒性[19-21]。因此,工业上推崇来自一些真菌次生代谢产物或木素降解产物的天然介体,对环境和生态有一定的保护作用。ACE是天然介体,其浓度在6~57 mmol/L时,不适合应用于废水处理,不仅成本高,而且会带来额外的污染[22]。该研究选用的乙酰丁香酮浓度范围为0~1mmol/L,促进染料脱色的效果较好。介体乙酰丁香酮浓度对模拟染料废水脱色具有一定的影响。当介体浓度为0.1 mmol/L,pH 7.0时,脱色2 h后对模拟染料废水的脱色率为66.13%。当介体浓度提高为0.5 和1.0mmol/L 时,2 h 后的脱色率分别上升为75.54%和79.40%,提高的幅度不大。这可能是由于反应体系中介体与漆酶的结合达到饱和,从而不能产生新的活性自由基。所以,在染料脱色过程中应研究漆酶与介体的比例,从而做到既有利于提高其脱色率,又不浪费介体。Pathak等[23]把4种偶氮染料混合制成模拟染料废水(100 mg/L),在pH 7.0的条件下由丛毛单胞菌属(Comamonassp.)VS-MH2作用,30 h后直至完全脱色,而该研究将偶氮、蒽醌、靛蓝和三苯甲烷4种不同类型的染料混合(170 mg/L),脱色6 h后脱色率达到80.42%。由此可知,菌株Bacillussp.CLb芽孢漆酶对这种混合染料的脱色能力很强。蒽醌型染料可直接由漆酶氧化,属于漆酶底物型染料,而偶氮和靛蓝2种染料则需要小分子代谢物介导染料和漆酶之间的相互作用,属于非漆酶底物型染料[17]。研究中,在不含介体的情况下,菌株Bacillussp.CLb芽孢漆酶对100 mg/ml活性亮蓝(蒽醌染料)2 h的脱色率为16.41%,对5 mg/ml结晶紫(三苯甲烷染料)2 h的脱色率为75.03%,而活性黑(偶氮染料)和靛红(靛蓝染料)则不能被脱色。漆酶底物型染料在工业废水中能促进某些非底物型染料的脱色[17]。因此,除了介体浓度和漆酶浓度影响模拟染料废水的脱色效果,不同类型染料之间也可能相互作用。
灵芝Ganoderma lucidumU-281漆酶催化偶氮染料活性黑5,其脱色率在 pH 3.5 ~6.0 条件下明显高于 pH 6.5 ~8.0条件,24 h脱色率可达到90%以上[24]。研究中,在 pH 7.0,介体ACE的作用下,菌株CLb芽孢漆酶4 h对活性黑的脱色率高于93%;在pH 9.0,其他条件相同的条件下,脱色率超过80%。可见,在碱性条件下,菌株CLb芽孢漆酶对活性黑的脱色效果优于灵芝。红酵母菌Rhodotorulasp.T-2对染料脱色的最适pH为3.0,偏酸性。在pH 3.0~7.0之间,随着pH的增加,其脱色率呈下降趋势[25]。相对于真菌漆酶,细菌Bacillussp.CLb的芽孢漆酶在中性和碱性条件下有较好的稳定性。该研究优化出的乙酰丁香酮是天然介体,价格低,效率高,而且用量少。菌株Bacillussp.CLb芽孢漆酶在介体的促进下对染料、模拟染料废水脱色效果的研究,为细菌漆酶应用于工业废水脱色提供了一定的理论基础。
[1]HUSAINQ.Potential applications of the oxidoreductive enzymes in the decolorization and detoxification of textile and other synthetic dyes from polluted water:a review[J].Critical Reviews in Biotechnology,2006,26(4):201-221.
[2]FAN L,ZHU SN,LIU D Q,et al.Decolorization of 1-amino-4-bromoanthraquinone-2-sulfonic acid by a newly isolated strain ofSphingomonas herbicidovorans[J].International Biodeterioration & Biodegradation,2009,63(1):88-92.
[3]PEGGA U,BROWN D.The Degradation of Dye stuffs.Part II.Behavior of Dye stuffs in Aerobic Biodegradation Test[J].Chemosphere,1986,15:479.
[4]WANG Y F,ZHAOD,MAW H,etal.Enhanced sonocatalytic degradation of azo dyesby Au/TiO2[J].Environmental Science & Technology,2008,42(16):6173-6178.
[5]ZOLLINGER H.Color Chemistry-Synthesis,Properties and Application of Organic Dyes and Pigment[J].VCH Publishers,1987,92:102.
[6]PEARCEC I,LLOYD JR,GUTHRIE JT.The removalof color from textile wastewater using whole bacterial cells:a review [J].Dyes Pigm,2003,58(3):179-196.
[7] BRENT S,O’NEAL G,BOYTER H,et al.Decolorizing textile dye wastewater by anoxic/aerobic treatment[J].Chemical Technology Biotechnology,2006,82:16-24.
[8]HASNATM A,UDDIN M M,SAMED A JF,et al.Adsorption and photocatalytic decolorization of asynthetic dye erythrosine on anatase TiO2and ZnO surfaces[J].Hazardous Materials,2007,60:471-477.
[9]RENS,GUO J,ZENGG,etal.Decolorization of triphenylmethane,azo,and anthraquinone dyes by a newly isolatedAeromonas hydrophilastrain [J].Applied Microbiology and Biotechnology,2006,72:1316-1321.
[10]SARATALEG,KALMES,BHOSALE S,etal.Biodegradation of kerosene byAspergillusochraceusNCIM-1146[J].JBasic Microbiol,2007,47(5):400-405.
[11]ITOH K,YATOME C,OGAWA T.Biodegradation of anthraquinone dyes byBacillus subtilis[J].Bulletin of Environmental Contamination and Toxicology,1993,50:522-527.
[12]SUZUKIY,YODA T,RUHUL A,et al.Molecular cloning and characterization of the gene encoding azoreductase fromBacillussp.OY 1-2 isolated from soil[J].Journal of Biological Chemistry,2001,246:9059-9065.
[13]YATOMEC,OGAWA T,MATSUIM.Degradation of Crystal violetbyBacillus subtilis[J].Environmental Science and Health,1991,26:75-87.
[14]李泰仑.枯草芽孢杆WN02芽孢漆酶的性质及染料脱色研究[D].哈尔滨:东北林业大学,2010:20-21.
[15]林俊芳,刘志明,陈晓阳,等.真菌漆酶的酶活测定方法评价[J].生物加工过程,2009,7(4):1-8.
[16]洪俊明,洪华生.A/O膜生物反应器组合工艺处理活性染料废水的实验研究[J].厦门大学学报,2005,44(3):441-444.
[17]WONG X Y,YU J.Laccase-catalyzed decolorization of synthetic dyes[J].Water Research,1999,33(16):3512-3520.
[18]赵丽艳,赵敏,卢磊,等.一色齿毛菌漆酶-介体系统在染料脱色中的应用[J].北京林业大学学报,2011,33(4):130-135.
[19]周生飞,詹怀宇,周坤,等.漆酶-天然介体体系用于硫酸盐竹浆漂白[J].生物技术,2011,30(7):48-51.
[20]高千千,朱启忠.漆酶-介体体系(LMS)及其应用[J].环境工程,2009,27(S1):598-602.
[21]CANAS A I,CAMARERO S.Laccases and their naturalmediators:Biotechnological tools for sustainable eco-friendly processes[J].Biotechnology Advances,2010,28(6):694-705.
[22]KURNIAWATIS,NICELL JA.Efficacy ofmediators for enhancing the laccase-catalyzed oxidation of aqueous phenol[J].Enzyme and Microbial Technology,2007,41(3):353-361.
[23]PATHAK H,PATEL S,RATHODM,etal.In vitro studies on degradation of synthetic dyemixture byComamonassp.VS-MH2 and evaluation of its efficacy using simulatedmicrocosm[J].Bioresource Technology,2011,102(22):10391-10400.
[24]赵世光,张焱,薛正莲,等.Ganoderma lucidumU-281漆酶催化偶氮染料活性黑5 脱色[J].菌物学报,2012,31(6):867-877.
[25]林晓华,董新姣.一株染料脱色红酵母菌的分离鉴定及脱色条件研究[J].浙江农业学报,2005,17(4):196-199.
Decolorization of Dye and Simulated Dye Effluent by Spore Laccase from Bacillus sp.CLb
LIFan-shu,WANG Chun-lei et al(Northeast Forestry University,Harbin,Heilongjiang 150040)
[Objective]The aim of this study was to investigate the dye decolorization capacity of spore laccase fromBacillussp.CLb with the mediator interaction.[Method]Spore suspension with laccase activity was prepared and tested for its ability of decolorizing four synthetic dyes,including remazol brilliant blue R(RBBR),reactive black 5,indigo carmine and crystal violet with the mediator interaction.And the mediator promoting the laccase activity was screened.The dye and simulated dye effluent decolorization capacity of spore laccase were researched under different pH conditions.[Result]The result showed that only RBBR and crystal violetwere decolorized in the absence ofmediator.The four dyeswere decolorizedmore than 70%by the spore laccase in the presence of acetosyringone(ACE).About80%of simulated dye effluentwas efficiently decolorized by 44.74 U/L spore laccase at pH 7.0 with 1 mmol/L acetosyringone asmediator after 6 h.In the presentofacetosyringone(ACE)asmediator and pH 7.0,the synthetic dyeswere decolorizedmore efficiently than under pH 9.0 condition by spore laccase.[Conclusion]In the present of acetosyringone(ACE),the spore laccase fromBacillussp.CLb had an obvious dye and simulated dye effluent decolorization effect.
Laccase;Simulated dye effluent;Dye decolorization
S181.3
A
0517-6611(2014)15-04569-04
中央高校基本科研业务费专项资金资助(DL12CA08);国家林业局948项目(2012-4-03);国家自然科学基金(No.31170553,30671702,30170775)。
李凡姝(1989-),女,山东掖县人,硕士研究生,研究方向:环境微生物学。*通讯作者,副教授,硕士生导师,从事微生物学的教学与科研工作。
2014-05-04

