黄连素对癌性恶病质小鼠肝肾功能的影响
张学梅 许崇安 佘春燕
中国医科大学附属第四医院肿瘤科,辽宁沈阳 110032
恶病质是肿瘤常见的并发症,近80%的晚期肿瘤患者会出现恶病质,近20%的患者直接死于恶病质[1],临床表现为体质量下降、食欲减退、疲劳、肌肉消耗、脏器功能损害,严重影响患者的生活质量及生存期。黄连素作为祖国的传统中医中药,是毛莨科植物黄连干燥根茎的提取物之一,近年发现其具有抗肿瘤作用[2]。笔者前期研究证实黄连素能改善癌性恶病质的发生、发展,现观察黄连素对小鼠恶病质肝肾等重要脏器保护作用,进一步明确其对恶病质的改善,并阐明其可能的作用机制。
1 材料与方法
1.1 实验材料
小白鼠结肠癌细胞株CT-26,购于中国医学科学院基础医学研究所细胞中心;雌性Balb/c 小白鼠,8周龄,体重18 g 左右,购于中国医学科学院实验动物研究所;黄连素,购自东北制药集团沈阳第一制药有限公司,国药准字H21022453;ELISA 试剂盒,购于英国Abcam 公司;原位凋亡检测试剂盒,购自德国Roche 公司。
1.2 实验方法
1.2.1 动物分组 将24 只小鼠随机分成三组,每组8 只,即正常对照组、荷瘤无干预组、荷瘤黄连素干预组。
1.2.2 构建肿瘤恶病质动物模型 建立结肠癌小鼠恶病质模型。荷瘤无干预组和荷瘤黄连素干预组小鼠腋窝下植入小鼠结肠腺癌细胞株CT-26(植入量为1×106/0.2 mL), 植入细胞7 d 后肉眼可见有肿瘤结节生成,14 d 的时候小鼠出现瘤块明显增大,小鼠消瘦,体重下降且进食量及饮水量下降,活动减少,与正常对照组相比,差异显著时,进入恶病质状态,提示构建肿瘤恶病质小鼠模型成功。
1.2.3 药物干预 接种肿瘤细胞第15 天后, 荷瘤黄连素干预组给予黄连素25 mg/(kg·d)灌胃,连续15 d;正常对照组、荷瘤无干预组给予等量生理盐水灌胃;各组每天给药1 次,连续给药15 d。
1.3 观察指标
1.3.1 一般状况 观察小鼠毛色和活动情况。
1.3.2 体重、摄食和饮水量 每两天用游标尺测定肿瘤的长径、短径并称小鼠体重量1 次,精确到0.1 g,肿瘤体积(V)的估计采用公式V=a×b2/2(a、b 分别为肿瘤的长度与宽度),肿瘤重量(M)的估计采用公式M=V×F(F 为实验结束时肿瘤实际重量与体积的比值),利用体质量减瘤重来估算去瘤体重量。所有测量均在每天同一时间进行。 每组小鼠同笼喂养,提供同一饲料和饮用水,从接种第1 天开始,记录每组小鼠摄食总量和饮水总量。
1.3.3 肝、肾功能指标 给药15 d 后,各组小鼠取全血分离血清,用全自动生化分析仪测定其肝、肾功能。
1.3.4 细胞因子 取接种15 d 后动物血清,采用酶联免疫吸附试验(ELISA)检测小鼠血清中肿瘤坏死因子(TNF)-α 浓度。
1.3.5 肝、肾组织形态 肝肾组织块常规石蜡包埋,切片,苏木精-伊红(HE)染色后光镜下观察肝肾组织形态结构的改变并拍照。
1.3.6 肝、肾细胞凋亡指数 采用原位末端转移酶标记技术(TUNEL) 检测肝、肾细胞凋亡情况。 石蜡切片常规脱蜡、水化后,首先经1%焦碳酸二乙酯水溶液处理30 min,以淬灭内源性核酸内切酶,按试剂盒说明进行操作。 以核棕黄色为阳性,普通光镜下每片随机选取5 个400 倍视野,以阳性细胞所占百分比的平均数为凋亡指数(apoptotic index,AI)。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验,以P < 0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况观察
正常对照组小鼠毛色、活动和摄食及饮水量一直保持正常。 荷瘤无干预组、荷瘤黄连素干预组小鼠在接种细胞株7 d 皮下可触及结节,并逐渐长大;至第14 天去瘤体重量较对照组明显减轻,小鼠活动变得迟缓,毛色变粗糙,摄食量逐渐减少,小鼠全部进入恶病质状态。 与荷瘤黄连素组小鼠相比,荷瘤无干预组小鼠活动迟缓及摄食、饮水减少等情况越来越严重,毛发粗糙无光泽,精神状态萎靡;而荷瘤黄连素组小鼠经治疗后活动量和摄食量、饮水量逐渐增加,毛发逐渐有光泽,精神状态逐渐好转。 摄食量及饮水量变化情况见图1、2。
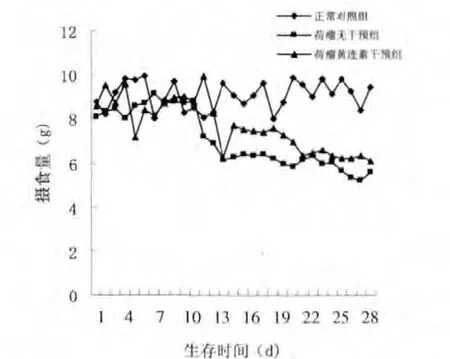
图1 各组小鼠摄食量变化情况

图2 各组小鼠饮水量变化情况
2.2 各组小鼠去瘤体重量比较
正常对照组小鼠去瘤体重量为(20.50±1.22)g,荷瘤无干预组小鼠去瘤体重量为(14.33±1.21)g,荷瘤黄连素干预组小鼠去瘤体重量为(17.33±1.63)g;荷瘤无干预组与荷瘤黄连素干预组较正常对照组去瘤体重量明显减轻(P < 0.05),荷瘤干预组小鼠去瘤体重量明显低于荷瘤黄连素干预组,差异有统计学意义(P <0.05)。
2.3 各组小鼠肝、肾功能比较
与正常对照组比较,荷瘤无干预组小鼠白蛋白、胆碱酯酶、肌酐水平明显降低,差异均有统计学意义(P < 0.05),而给予黄连素干预,可改善荷瘤小鼠的肝肾功能,与荷瘤无干预组比较,上述指标差异均有统计学意义(P < 0.05)。 见表1。
表1 三组小鼠肝、肾功能比较(±s)

表1 三组小鼠肝、肾功能比较(±s)
注:与正常对照组比较,*P < 0.05;与荷瘤无干预组比较,#P < 0.05
?
2.4 各组小鼠细胞因子水平比较
血清TNF-α 水平在正常对照组为(241.72±28.65)pg/mL,荷瘤无干预组为(684.12±94.87)pg/mL,荷瘤黄连素干预组为(336.7±41.94)pg/mL;荷瘤无干预组与荷瘤黄连素干预组血清TNF-α 水平较正常对照组明显增高,差异有统计学意义(P < 0.05);荷瘤黄连素干预组较荷瘤无干预组TNF-α 水平明显减低,差异有统计学意义(P < 0.05) 。
2.5 光镜观察
2.5.1 肝组织 正常对照组:肝细胞排列紧密,肝小板清晰,细胞核清晰,胞浆均匀染色。 荷瘤无干预组:肝细胞排列疏松,肝板界限不清晰,细胞肿胀,可见细胞核缩破碎,并伴有炎症细胞浸润,细胞呈现空泡样变,坏死。荷瘤黄连素干预组:细胞排列相对规则,细胞仍有部分肿胀,无空泡样变,大部分细胞核清晰可见,极少细胞核出现固缩及破碎。 见图3。

图3 各组小鼠肝组织光镜观察(HE×400)
2.5.2 肾组织 正常对照组:肾小球和肾小管细胞浆及细胞核染色清晰,无病变。荷瘤无干预组:可见部分肾小球内胞质外溢,部分肾小管上皮细胞出现肿胀,少量细胞呈现核固缩现象,偶见炎症细胞浸润。 荷瘤黄连素干预组:肾小球和肾小管细胞染色均匀,细胞核及胞浆着色清晰,偶见上皮细胞肿胀,细胞核少见固缩现象。 见图4。
2.6 各组小鼠细胞凋亡情况
2.6.1 肝细胞凋亡指数 正常对照组肝细胞凋亡指数为(5.46±0.50)%,荷瘤无干预组为(24.01±2.01)%,荷瘤黄连素干预组为(19.19±5.79)%,组间两两比较,差异均有统计学意义(P < 0.05)。 见图5。
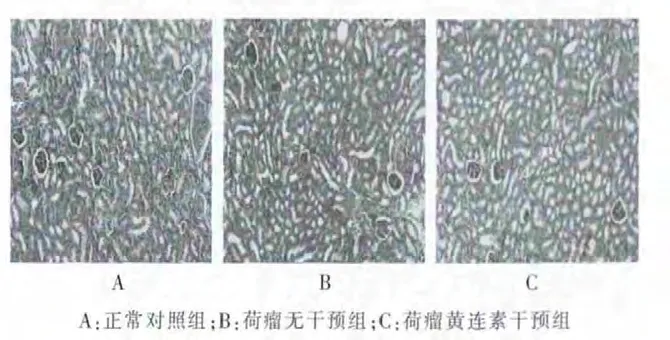
图4 各组小鼠肾组织光镜观察(HE×400)
2.6.2 肾细胞凋亡指数 正常对照组肾细胞凋亡指数为(2.22±0.59)%,荷瘤无干预组为(16.20±3.91)%,荷瘤黄连素干预组为(11.80±1.89)%,组间两两比较,差异均有统计学意义(P < 0.05)。 见图6。

图5 各组小鼠肝组织细胞凋亡(HE×400)
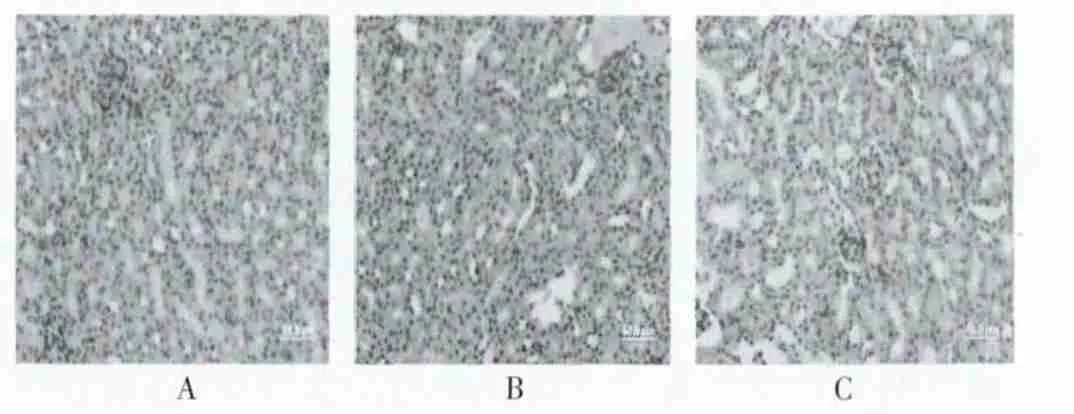
图6 各组小鼠肾组织细胞凋亡(HE×400)
3 讨论
恶病质是癌症晚期常见的综合征,由于长期能量摄入不足,需消耗体内各种组织器官的蛋白质供能,致使其所含蛋白质的量下降,细胞合成DNA 受阻,各种组织和器官生长发育迟缓,甚至停止,并发生严重萎缩和脂肪变性,造成脏器功能障碍[3]。黄连素是从毛茛科如黄连、黄柏、三颗针等植物根茎中提取的异喹啉类生物碱,具有清火燥湿、泻火解毒的功效,临床长期用于解热、解毒、抗肠道细菌感染[4]。 近年来发现黄连素还有多种药理活性,如扩张冠状血管、降血压、降血脂、降血糖、抗心律失常、抗肿瘤等[5]。
CT-26 结肠腺癌恶病质动物模型是一个比较理想的模型,它所表现出的炎症、糖代谢异常、胰岛素抵抗、肌肉蛋白及脂肪组织合成减少、分解增加、体质量进行性下降、脏器功能损害和全身衰竭等与癌症恶病质患者的表现相似[6]。 本研究应用黄连素干预小鼠CT-26 结肠腺癌恶病质动物模型,提示黄连素能明显抑制小鼠的体重下降,增加摄食量、饮水量,改善小鼠的一般状况。
癌性恶病质往往伴有多脏器功能损害,终末期常出现多脏器功能障碍[7]。研究表明,多脏器功能损害与恶病质诱发正常器官细胞凋亡有关[8]。 引起凋亡主要有两条途径:细胞外的死亡受体途径及细胞内的线粒体途径。 前者主要是刺激因素激活细胞内P53、Fas、Bcl-2、NF-κB 等基因,由TNF 受体家族介导,使Caspase-8 激活;后者是通过刺激因素影响细胞内线粒体的膜电位,导致线粒体内细胞色素C 释放, 胞内Ca2+浓度升高,pH 值下降,使Caspase-9 激活。 两个途径最后都导致效应性Caspase-3 活化,效应性Caspase-3、Caspase-6、Caspase-7 激活内切核酸酶,使DNA 链断裂,最终细胞结构的全面解体[9]。文献报道,TNF-α、NF-κB、泛素蛋白酶体参与了癌症恶病质的发生,且持续作用贯穿整个疾病过程[10]。 黄连素能抑制NF-κB 活性[11]。本文研究表明,黄连素能明显减低血清TNF-α 水平,减轻恶病质小鼠模型肝肾病理损害程度,减少肝肾组织细胞凋亡,改善恶病质小鼠肝肾功能,提高肝脏储备能力。 其机制可能为黄连素抑制调控因子NF-κB活化,NF-κB 可进一步调控凋亡相关基因,致使肝肾细胞凋亡减少。 NF-κB 抗细胞凋亡是一个涉及多个信号通路的复杂过程,但其主要方式是通过诱导或上调抗凋亡基因的表达实现的。这些基因调节位点上有NF-κB 的结合位点,他们的表达产物通过抑制细胞凋亡的死亡受体途径或线粒体途径发挥作用。到目前为止,研究发现,细胞凋亡抑制蛋白(IAPs)、Bcl-2 家族、TRAF1、TRAF-2、JNK、c-FLIP、IEX-1L 等都参与NF-κB 激活后的抗细胞凋亡过程[12]。
本研究表明,黄连素口服能改善恶病质小鼠状态,改善食欲,降低体重丢失,减少肝肾细胞凋亡,保护肝肾功能。 确切分子机制有待进一步研究。
[1] 马颖杰,马妮娜,曹邦伟.肿瘤恶病质的分子机制与其改善的策略与方法[J].临床和实验医学杂志,2013,12(1):73-75.
[2] 王海燕,李玉清,王启会.黄连素抗肿瘤作用研究进展[J].中成药,2007,29(10): 1500-1502.
[3] 张红欣,姜达,张富同,等.实验性癌性恶病质药物干预研究[J].临床荟萃,2012,27(24):2149-2152.
[4] 柴惠,余军伟,马建龙.黄连素对肿瘤坏死因子TNF-α介导的炎症作用机理研究[J].浙江中医药大学学报,2011,35(4):489-491.
[5] 杨萍.黄连素临床应用及研究的新进展[J].天津药学,2011,23(3):69-72.
[6] 史海岭,刘芬,郭晓军,等.黄连素对肺腺癌A549 细胞增殖、迁移与黏附的影响[J].中国癌症杂志,2009,19(12):910-914.
[7] 吴国豪.恶性肿瘤病人恶病质发生机制及营养治疗[J].外科理论与实践,2012,17(2): 98-101.
[8] 周开国,何桂珍.肿瘤恶病质的机制及可能的治疗[J].基础医学与临床,2011,31(1): 104-107.
[9] Mustafa K,Zafer F. Adipokines and ghrelin in gastric cancer cachexia [J] .World Journal of Gastroenterology,2008,(6):454-456.
[10] Jiang SM,Wu JH,Jia L. Intervention of Mirtazapine on gemcitabine-induced mild cachexia in nude mice with pancreaticcarcinoma xenografts [J]. World Journal of Gastroenterology,2012,(6):137-138.
[11] 孟晓军,曾映娟,孔红娟,等.黄连素对新诊断2 型糖尿病患者内皮功能、白介素-6、肿瘤坏死因子-α 的影响[J].中国慢性病预防与控制,2011,19(5):504-505,508.
[12] 刘善浩,汪兴洪.细胞凋亡抑制蛋白-2 研究进展[J].安徽医药,2009,13(1):54-56.

