进入生殖嵴前PGCs中H2A变体的分布
时小艳
(江苏食品药品职业技术学院,江苏 淮安 223003)
进入生殖嵴前PGCs中H2A变体的分布
时小艳
(江苏食品药品职业技术学院,江苏 淮安 223003)
小鼠原始生殖细胞进入生殖嵴之前经历细胞迁移、大量繁殖。为进一步解分子调控机制,文章通过组织石蜡切片免疫荧光染色和单细胞免疫荧光染色技术,对8.5、10.5 dpcPGCs中组蛋白H2A变体MacroH2A、H2A.Z、H2A.X的分布情况进行研究。结果表明,8.5~10.5 dpc,H2A.Z在PGCs中的表达明显递增,10.5 dpc PGCs中H2A.Z的表达主要集中于细胞核;而MacroH2A和H2A.X在此过程中无明显变化,在细胞质和细胞核中弱表达。综合分析发现,8.5~10.5 dpc PGCs中H2A.Z可能是装配核小体的主要变体,PGCs大量繁殖可能有H2A.Z的参与。
H2A变体;PGCs;生殖嵴;分布
小鼠PGCs从产生到性别分化产生配子,整个过程中细胞发生着一系列的生物学变化。配种天数(Days post coitum,dpc)为小鼠胚胎8.5~10.5 d,PGCs是尿囊蒂和原条尾端的卵黄囊脏层,即后肠开口边缘并与之结合处,沿后肠在肠壁内胚层细胞之间向前迁移,进入背肠系膜后向生殖嵴迁移,在迁移过程中细胞数量快速增加。
近年来对组蛋白H2A变体研究增多,MacroH2A主要分布在失活X染色体上,在胚胎发育过程中,去除MacroH2A,导致表观遗传重组[1]。MacroH2A有助于改变染色体可塑性和结构[2];H2A.X与基因组稳定相关[3],在DNA出现断裂时,替代H2A变体,对DNA修复有重要作用。组蛋白变异体H2A.Z对基因表达调控、基因组稳定和染色质重构起重要作用[4],但是否与小鼠原始生殖细胞生理活动相关,未见相关研究报道。本文通过组织石蜡切片免疫荧光和单细胞的免疫荧光法对MacroH2A、H2A.Z、H2A.X三种变体在PGCs中表达情况进行研究,分析小鼠生殖细胞进入生殖嵴之前活动状态及分子调控机制,为相关试验研究提供理论依据。
1 材料与方法
1.1 动物及试剂
1.1.1 动物
昆明白孕鼠(8.5和10.5 dpc),购自南京青农山实验动物中心。
1.1.2 试剂及抗体
1.1.2.1 仪器设备
连续变倍体视显微镜(52-51),购自OLYMPUS公司;正置荧光显微镜,购自Leica公司;倒置荧光显微镜,购自Leica公司;超净工作台,购自上海博迅实业有限公司医疗设备厂;超低温冰箱,购自Thercto公司;离心机,购自Eppendorf公司;可调式微量移液器,购自Eppendorf公司。
1.1.2.2 普通试剂
孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(hCG)、Tween-20、无水乙醇、二甲苯、构椽酸钠、石蜡、多聚甲醛均为国产,购自南京农业大学。
1.1.2.3 抗体
一抗:stella(兔抗小鼠,Abcam公司,货号ab19878)、二抗FITC标记(山羊抗兔,Sigma公司,货号F0382);一抗:H2A.X(兔抗小鼠,Abcam公司,货号ab20669)、二抗Cy3标记(山羊抗兔,Sigma公司,货号C2306);一抗:macroH2A(兔抗小鼠,Abcam公司,货号ab20669)、二抗Cy3标记(山羊抗兔,Sigma公司,货号C2306);一抗:H2A.Z(兔抗小鼠,Abcam公司,货号ab20669)、二抗Cy3标记(山羊抗兔,Sigma公司,货号C2306);DAPI,(Sigma公司,货号D9542)。
1.2 方法
1.2.1 PGCs组织样石蜡切片制作
将健康成熟母鼠腹腔注射PMSG、hCG后,与健康成熟公鼠合笼,第2天上午8∶00前见栓母鼠选出分笼饲养,记为孕0.5 dpc。将培养至8.5和10.5 dpc的孕鼠用颈椎脱臼法致死,打开子宫并分离胚胎,置于无Ca2+、Mg2+的PBS液培养皿中,在PBS液中采集胚胎组织样。8.5 dpc胚胎采集后1/3部分;10.5 dpc胚胎采集背肠系膜部,然后将组织样用固定液固定。将固定好的组织样脱水、透明、浸蜡、包埋、修整、切片[5]。
1.2.2 PGCs的分离及切片制备
1.2.2.1 PGCs的分离
将8.5和10.5 dpc含PGCs的组织样用PBS溶液液清洗3次后剪碎,用0.125%胰蛋白酶加0.02% EDTA消化15 min,消化终止时加入等量血清培养液,等其沉淀完全后,取上清液过滤,剩余组织重复消化2次,合并滤液,离心机离心后弃上清,加入3.7%多聚甲醛固定液固定30 min,离心机离心后用吸水纸吸去上清,得到原始生殖细胞溶液。
1.2.2.2 PGCs切片制备
将细胞液滴在经洗衣粉浸泡过夜、自来水冲洗、烘干、硫酸洗剂浸泡过夜、自来水冲洗、95%乙醇浸泡、擦干、高压灭菌、滴50 mL 0.25%明胶溶液铺平,风干处理的载玻片上,室温干燥,用盖玻片加凡士林封片[5]。
1.2.3 免疫荧光染色
将8.5和10.5 dpc含PGCs的组织样切片用含0.1%BSA的PBS溶液清洗2次,滴加0.5%的TritonX-100在切片上,静置10 min,再用PBS清洗1次,滴加含0.05%Tween-20的PBS/BSA在切片上,保持30 min。抗体孵育:加组蛋白变体(H2A.X、macroH2A、H2A.Z)一抗孵育1 h,PBS清洗2次,加二抗Cy3标记孵育1 h。PBS清洗2次,加stella抗体(PGCs抗体)孵育1 h;PBS再清洗2次,加标记stella二抗FITC孵育1 h;PBS清洗2次,加DAPI处理20 min。最后将切片置于荧光显微镜下观察、拍照[6]。
2 结果与分析
2.1 H2A.Z在原始生殖细胞进入生殖嵴前的分布
通过对8.5和10.5 dpc的含PGCs组织样的免疫荧光染色发现,在8.5 dpc PGCs中没有检测到H2A. Z的荧光(见图1,8.5 dpc第三列图片中箭头所指),而在PGCs进入生殖嵴前后(10.5 dpc)H2A.Z的荧光明显增强(见图1,10.5 dpc第三列图片中箭头所指)。
为研究H2A.Z在细胞中具体表达位置,本文进行8.5和10.5 dpc PGCs单细胞的免疫荧光试验。结果表明,10.5 dpc单细胞中H2A.Z荧光强度比8.5 dpc强,10.5 dpc PGCs中H2A.Z的荧光主要集中于细胞核,如图2所示。

图2 8.5和10.5 dpc PGCs中H2A.Z的表达Fig.2 Distribution of H2A.Z in PGCs
2.2 macroH2A在原始生殖细胞进入生殖嵴前的分布
通过对8.5和10.5 dpc含PGCs组织样的免疫荧光染色,结果表明,8.5 dpc PGCs中macroH2A免疫荧光强度很弱(见图3,8.5 dpc第三张图片中箭头所指),PGCs进入生殖嵴前后(10.5 dpc)macroH2A的免疫荧光强度与8.5 dpc PGCs中的表达差异不大(见图3,10.5 dpc第三张图片中箭头所指)。
本文进行8.5和10.5 dpc PGCs单细胞免疫荧光试验。结果表明,10.5与8.5 dpc单细胞中macro-H2A的荧光强度相当,且8.5和10.5 dpc PGCs的细胞质和细胞核中macroH2A荧光强度很弱(见图4)。

图3 8.5和10.5 dpc含PGCs组织样中maroH2A的表达Fig.3 macroH2A in a distribution of paraffin PGCs organization
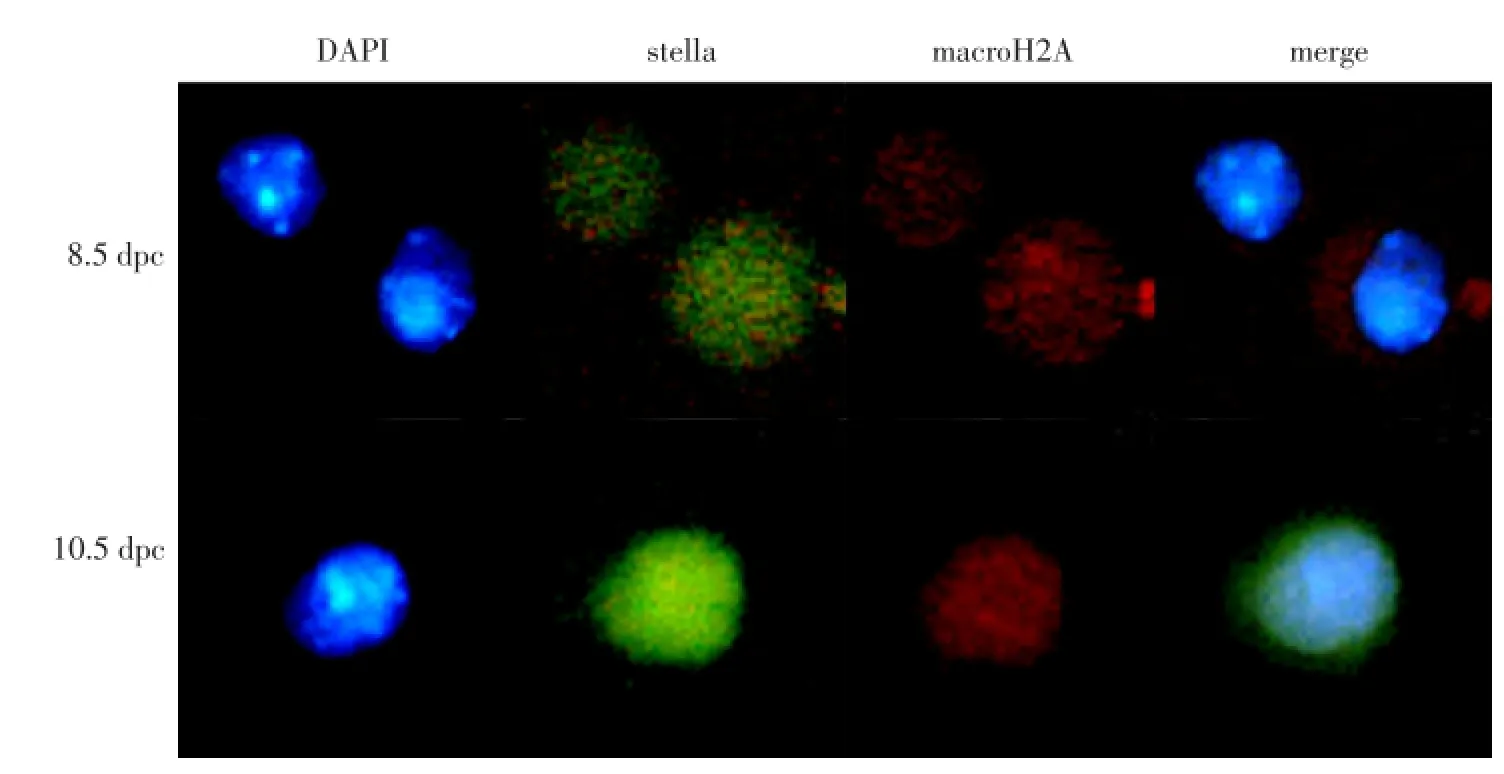
图4 8.5和10.5 dpc PGCs中maroH2A的表达Fig.4 Distribution of macroH2A in PGCs
2.3 H2A.X在原始生殖细胞进入生殖嵴前的分布
通过对8.5和10.5 dpc的含PGCs组织样的免疫荧光染色,结果表明,8.5 dpc PGCs中没有检测到H2A.X的荧光(见图5,8.5 dpc第三张图片中箭头所指),PGCs进入生殖嵴前后(10.5 dpc)H2A.X的荧光强度与8.5 dpc PGCs中的荧光强度增强(见图5,10.5 dpc第三张图片中箭头所指)。
进行8.5和10.5 dpc PGCs单细胞的免疫荧光试验,结果表明,10.5与8.5 dpc单细胞中H2A.X的荧光表达相当,同时8.5和10.5 dpc PGCs中H2A.X都弱表达于细胞质和细胞核中见图6。
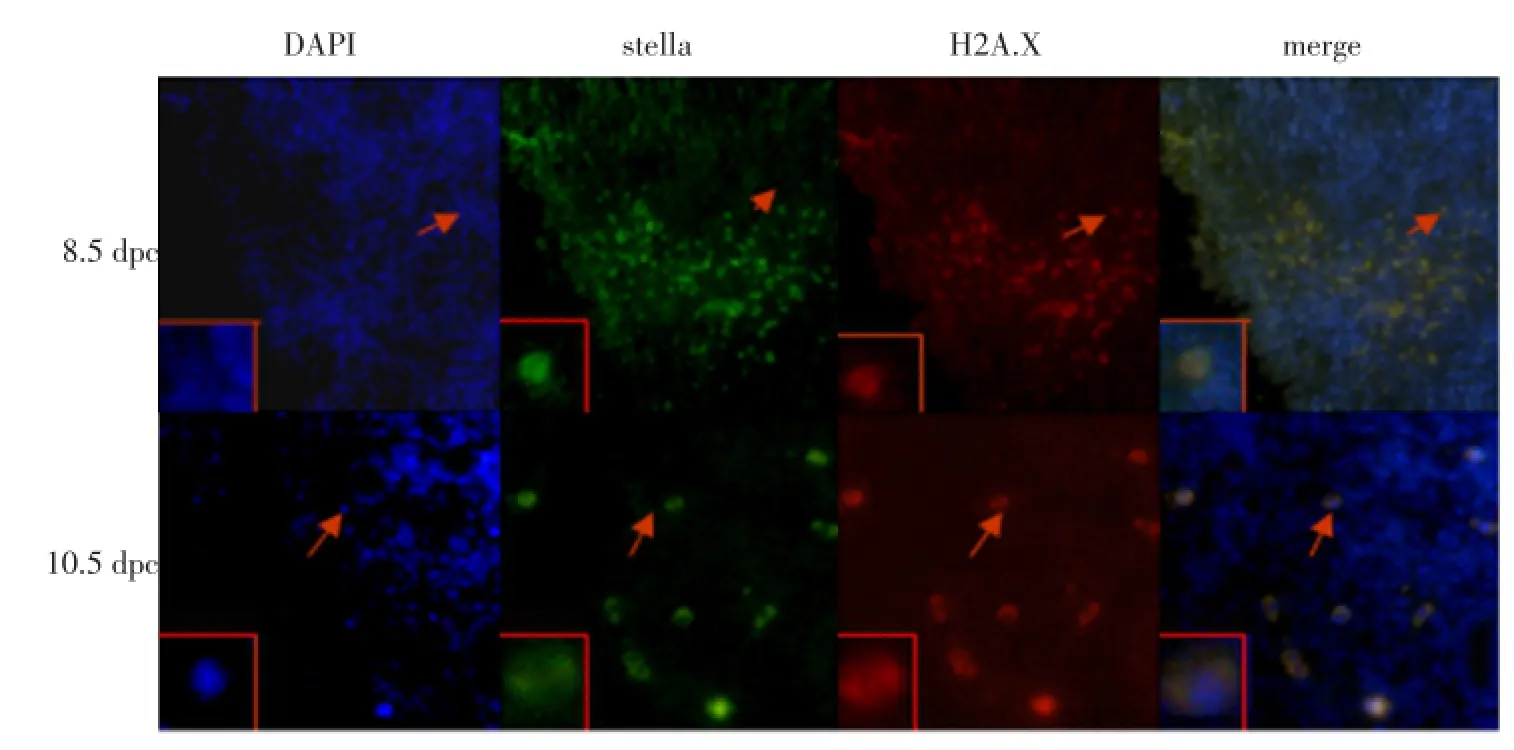
图5 8.5和10.5 dpc含PGCs组织样中H2A.X的表达Fig.5 H2A.X in a distribution of paraffin PGCs organization
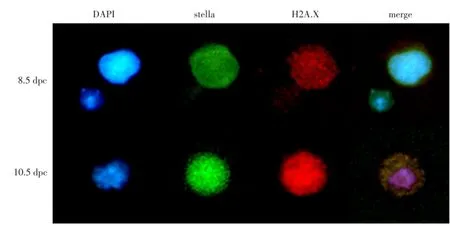
图6 8.5和10.5 dpc PGCs中H2A.X的表达Fig.6 Distribution of H2A.X in PGCs
3 讨论
本文8.5和10.5dpc的PGCs中macro-H2A、H2A.X 和H2A.Z三种组蛋白变体的表达情况为:①H2A.Z表达明显递增,在10.5 dpc PGCs中H2A.Z主要集中于细胞核;②macroH2A和H2A.X在此过程中表达无明显变化,细胞质和细胞核中均弱表达。Suto等研究表明,MacroH2A和H2A.Z不能共定位,组蛋白变异体不能够在同一个核小体中装配[7]。本文研究与Suto结果一致。分析小鼠PGCs 8.5~10.5 dpc发育过程中,H2A.Z是装配核小体主要变体。
8.5 dpc PGCs中H2A.Z不表达,Valdes-Mora等研究表明,DNA甲基化和基因组中的H2A.Z之间存在高度负相关[8]。在8.5 dpc后,PGCs中DNA胞嘧啶的甲基化和H3K9me2在基因组上广泛擦除,抑制作用降低。H2A.Z在细胞质中合成,合成H2A.Z很快转移至细胞核发挥作用,与本文观察到10.5 dpc PGCs细胞质和细胞核都存在H2A.Z一致。在细胞核中H2A.Z首先定位于臂间异染色质区域,而H2A在臂间异染色质区域缺失,H2A.Z是臂间异染色质重要标志[9]。臂间异染色质对染色体分离和胞质分裂起重要作用。因此,在8.5~10.5 dpc PGCs中细胞大量繁殖可能有H2A.Z的参与。
本研究只采用免疫荧光法,对组织及单细胞中H2A变体分布情况进行研究,虽然在荧光强弱和位置能够初步判断H2A变体的表达,但并不精准,可在此基础上做RT-PCR。本文研究结果发现,组蛋白及其变体的分布并不只分布在细胞核装备核小体,在原始生殖细胞发育不同时间段(8.5和10.5 dpc)三种组蛋白H2A变体macroH2A、H2A.X 和H2A.Z分布位置发生明显快速变化。该研究结果与吴宝江对中组蛋白H2A变异体在小鼠卵母细胞和早期胚胎发育过程中的变化研究相吻合[10],证明该研究中三种组蛋白H2A变体分布灵活性和特异性。对于作为组蛋白装备核小体组成成分,H2A变体出现在细胞质中有待深入研究。
4 结论
本文对小鼠原始生殖细胞免疫荧光进行研究分析,小鼠PGCs从8.5 dpc发育至10.5 dpc过程中macroH2A、H2A.X和H2A.Z三种组蛋白变体在细胞中表达量及方位变化灵活。在生殖细胞发育过程中,macroH2A、H2A.X和H2A.Z三种组蛋白变体表达部位不限于细胞核内,有时在细胞质中也有分布。本文研究结果与细胞核装备核小体结合,分析推断H2A.Z可能是装配核小体主要变体,PGCs大量繁殖可能有H2A.Z参与,尚需深入研究。
[1]Vincent Pasque,Richard P,Halley-Stott,et al.Epigenetic stability of repressed states involving the histone variant macro-H2A revealed by nuclear transfer to Xenopus oocytes[J].Nucleus, 2011,2∶6,533-539.
[2]Banaszynski L A,Allis C D,Lewis P W.Histone variants in metazoan development[J].Dev Cell,2010,19∶662-674.
[3]Gonzalez-Romero R,Rivera-Casas C,Frehlick L J,et al.Histone H2A(H2A.X and H2A.Z)variants in molluscs∶Molecular characterization and potentialimplications for chromatin dynamics[J]. PLoS One,2012,7(1)∶1-9.
[4]Billon P,Côté J.Precise deposition of histone H2A.Z in chromatin for genome expression and maintenance[J].Biochim Biophys Acta, 2012;1819(3/4)∶290-302.
[5]时小艳,吴宝江,于建宁,等.小鼠原始生殖细胞迁移过程中H2A. Z的表达[J].安徽农业大学学报,2013(3)∶422-426.
[6]时小艳,于建宁,吴宝江,等.小鼠原始生殖细胞(PGCs)迁移过程中macroH2A的表达[J].江苏农业科学,2013,41(4)∶193-196.
[7]Suto R K,Clarkson M J,Tremethick D J,et al.Crystal structure of a nucleosome core particle containing the variant histone H2A.Z[J]. Nat Struct Biol,2000,7(12)∶1121-1124.
[8]Valdés-Mora F,Song J Z,Statham A L,et al.Acetylation of H2A. Z is a key epigenetic modification associated with gene deregulation and epigenetic remodeling in cancer[J].Genome Res,2012, 22(2)∶307-321.
[9]Rieder C L,Salmon E D.The vertebrate cell kinetochore and its roles during mitosis[J].Trends Cell Biol,1998,8(8)∶310-318.
[10]吴宝江.组蛋白H2A变异体在小鼠卵母细胞和早期胚胎发育过程中的变化[D].南京∶南京农业大学,2010.
Distribution of H2A variants in PGCs before entering the genital ridge
SHI Xiaoyan(Jiangsu Food and Pharmaceutical Science College,Huaian Jiangsu 223003,China)
Before the mouse primordial germ cells into the genital ridge through cell migration, proliferation,in order to further understand the molecular regulation mechanism.In this paper,through the organization of the paraffin section immunity fluorescence dyeing and single cell immunofluorescence staining technique,the distribution of 8.5,10.5 dpcPGCs of histone H2A variants MacroH2A, H2A.Z,H2A.X were studied.The results showed that,8.5-10.5 dpc,the expression of H2A.Z in PGCs was significantly increased,expression of H2A.Z 10.5 dpc in PGCs mainly in the nucleus;but no obvious changes of MacroH2A and H2A.X in the process,expressed in the cytoplasm and nucleus of weak.Comprehensive analysis showed that,8.5-10.5 dpc H2A.Z in PGCs may be the main variant assembly of nucleosomes,PGCs during blooms may participate in the H2A.Z.
H2A variants;PGCs;genital ridge;distribution
S813
A
1005-9369(2014)12-0036-06
时间2014-12-29 13∶45∶48 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20141229.1345.019.html
时小艳.进入生殖嵴前PGCs中H2A变体的分布[J].东北农业大学学报,2014,45(12):36-41.
Shi Xiaoyan.Distribution of H2A variants in PGCs before entering the genital ridge[J].Journal of Northeast Agricultural University,2014,45(12):36-41.(in Chinese with English abstract)
2014-04-23
国家973重点基础研究发展计划项目(2007CB947403)
时小艳(1980-),女,讲师,硕士,研究方向为动物遗传育种。E-mail∶shxy-05@163.com

