18 F-FDG PET-CT 在结直肠癌术前N 分期中的价值及诊断标准探讨
葛继元 张 建 吴仪仪 崔 斌 高明军 邱 爽 张英英 张 卫 鄂继福 左长京
结直肠癌是胃肠道最常见的恶性肿瘤之一,我国结直肠癌发生率位于肺癌和胃癌之后,居第3 位,且近年发生率不断上升。目前结直肠癌的治疗多以根治性手术切除为主,但术后复发率高达30% ~50%,究其原因是大多数结直肠癌患者在发现和诊断结直肠癌时已经出现侵袭和转移,是否能够及早发现,以及正确术前分期是结直肠癌治疗的关键因素之一。18F-FDG PET-CT 是一种集功能和形态显像于一身的先进影像学手段,在结直肠癌的诊断及分期中有其独特的优势。本研究对病理证实的结直肠癌患者的18F-FDG PET-CT 表现进行回顾分析,探讨其在结直肠癌术前N 分期方面的价值及诊断标准的优化。
资料与方法
1.一般资料:回顾性分析2010 年8 月~2013 年5 月在第二军医大学长海医院行18F -FDG PET -CT 检查(术前1 周内)并行结直肠癌根治手术,术后病理证实为结直肠癌的患者80 例,男性53 例,女性27 例,平均年龄59.1 ±9.6 岁。患者术前均未行放疗或化疗等治疗。
2.检查仪器及方法:18F-FDG 由上海原子科兴药业有限公司及华山医院PET 中心提供,放射化学纯度>95%,采用西门子Biograph trupoint 64 层52 环HD PET-CT。检查前患者禁食6 ~8h,空腹血糖<11.1mmol/L 后,按8.14MBq/kg 体重静脉注射18F-FDG,静卧休息1h 并尽量饮水至少300ml 以充盈胃肠道,排尿后行18F-FDG PET -CT 检查,常规扫描7 ~8个床位,每个床位2.0 ~2.5min,扫描范围自颅顶至股骨中段;采用迭代方法重建图像,CT 透射扫描数据做衰减校正,得到CT 图像、PET 图像和PET-CT 融合图像。
3.图像分析:由2 名有经验的核医学科医生在西门子Multimodality 图像工作站上对每例PET-CT 影像进行观察分析,观察结直肠区域淋巴结的数目、大小,在层厚3mm 的横断位图像上测量淋巴结的最大短径,并在相邻的几个层面中找出淋巴结最大标准摄取值(SUVmax)所在的层面,在该层面上沿淋巴结边缘勾画ROI,测量该淋巴结的SUVmax 值,两位医生测量所得数据取平均值,诊断不一致时以两位医生讨论一致后的结果为准。N 分期标准参照最新的美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)结直肠癌TNM 分期:N0无区域淋巴结转移;N1有1 ~3 枚区域淋巴结转移;N2有4 枚以上区域淋巴结转移。在本研究中,区域淋巴结指结肠及直肠供血动脉干范围内的淋巴结,肠旁癌结节按区域淋巴结计数。分别以淋巴结短径≥3、5、8、10mm 以及淋巴结SUVmax≥1.0、1.5、2.0、2.5 作为诊断参考标准,比较不同标准在结肠癌术前N 分期方面的准确性。
4.统计学方法:数据整理录入计算机建库后,采用SPSS 20.0 统计软件进行分析,数据资料用均数±标准差(±s)表示,两组数据间比较行卡方检验,以P <0.05 为差异有统计学意义,诊断标准与病理的相关性用Kappa 一致性检验。
结 果
1.手术病理结果:80 例术前行18F -FDG PET -CT 检查的结直肠癌患者,其中低分化腺癌5 例,中分化腺癌68 例(12 例伴部分黏液腺癌,1 例伴神经内分泌样癌),黏液腺癌6 例,印戒细胞癌1 例。术后病理结果显示有淋巴结转移患者56 例,其中N1期29 例,N2期27 例,无淋巴结转移患者24 例(N0期),共切除淋巴结1241 枚,其中转移淋巴结193 枚,非转移淋巴结1048 枚。73 例腺癌患者共发现转移淋巴结130枚;7 例黏液腺癌及印戒细胞癌患者中有6 例证实淋巴结转移(N11 例,N25 例),转移性淋巴结共63 枚,PET-CT 仅发现其中的12 枚。
2.PET-CT 结果与手术病理结果比较:80 例结直肠癌患者,其病灶均明显摄取18F -FDG,在PET 图像上呈明显阳性表现,结直肠癌原发灶SUVmax 为16.5 ±5.4,其中腺癌SUVmax 为16.7 ±5.3,黏液腺癌及印戒细胞癌为13.8 ±5.2。
分别以淋巴结短径≥3、5、8、10mm 为标准,对80例结直肠癌患者行淋巴结转移诊断以及术前N 分期,PET -CT 基于患者例数诊断结直肠癌淋巴结转移的敏感度分别为89.3%、82.1%、64.3% 和48.2%,特异性分别为54.2%、58.3%、70.8% 和91.7%,准确度分别为78.8%、75%、66.3% 和61.3%;N 分期的准确度分别为68.8%、66.3%、51.3%、43.8%(表1、表2)。
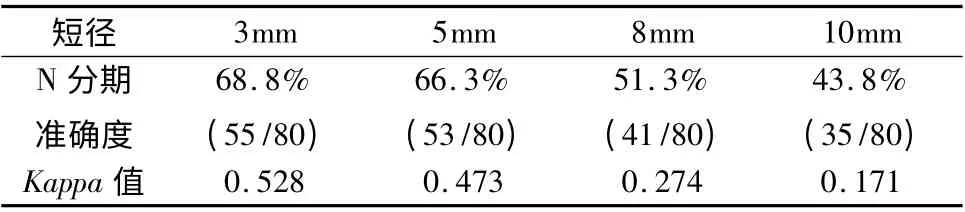
表1 结直肠癌患者淋巴结短径与N 分期准确性的关系

表2 淋巴结短径≥3mm 为标准的N 分期与病理结果的比较
分别以淋巴结SUVmax≥1.0、1.5、2.0、2.5 为标准,对80 例结直肠癌患者行淋巴结转移诊断以及术前N 分期,PET -CT 基于患者例数诊断结直肠癌淋巴结转移的敏感度分别为80.4%、67.9%、57.1%和57. 1%,特异性分别为54.2%、70.8%、75% 和87.5%,准确度分别为72.5%、68.8%、62.5% 和62.5%;N 分期的准确度分别为62.5%、63.8%、52.5%、53.8%(表3、表4)。
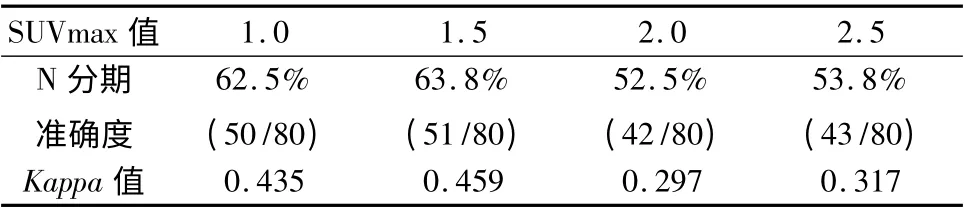
表3 结直肠癌患者淋巴结SUVmax 值与N 分期准确性的关系

表4 淋巴结SUVmax≥1.5 为标准的N 分期与病理结果的比较
笔者将不同诊断标准经McNemar 检验得出,在结直肠癌术前N 分期方面,淋巴结短径≥3mm 与≥5mm比较无明显统计学差异(P =0.774),淋巴结短径≥3mm 与≥8mm 以及≥10mm 比较差异有统计学意义(P=0.008,P=0.007);淋巴结SUVmax≥1.5 与SUVmax≥2.0 比较差异有统计学意义(P=0.022),淋巴结SUVmax≥1.5 与SUVmax≥1.0 以及SUVmax≥2.5 比较无明显统计学差异(P=1.000,P=0.096);淋巴结短径≥5mm 与SUVmax≥1.5 比较无明显统计学差异(P=0.727)。淋巴结短径为3 ~5mm 与SUVmax≥1.5 诊断结直肠癌术前N 分期的准确性相对较高,Kappa 一致性检验与手术病理结果均呈中度相关,但由于淋巴结短径3mm 过小,通常测量会有较大误差,因此笔者认为淋巴结短径≥5mm 为标准的可操作性更好(图1)。
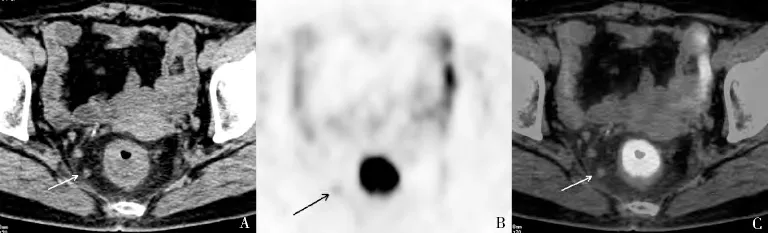
图1 患者,女性,66 岁,直肠中分化腺癌伴区域淋巴结转移,CT 图像见直肠右旁一枚淋巴结,短径约5mm
为了探讨PET 诊断标准与CT 诊断标准结合能否提高结直肠癌术前N 分期的准确度,将淋巴结短径与SUVmax 值两两结合,对N 分期进行评估,结果显示对结直肠癌N 分期的准确度无明显提高,如表5 所示。
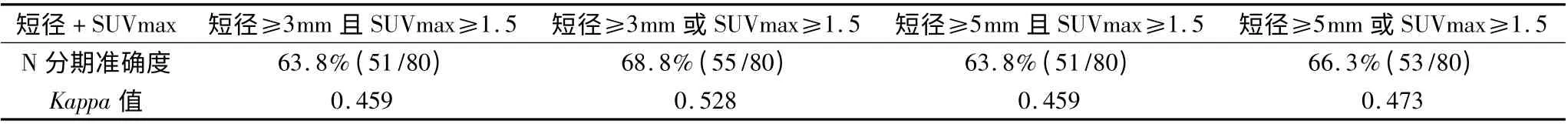
表5 结直肠癌患者淋巴结短径与SUVmax 值结合与N 分期准确度的关系
讨 论
据文献资料显示,淋巴结转移是结直肠癌最常见的转移途径。肿瘤的准确诊断、术前分期,直接影响治疗方案的确定及预后判断。目前影像学上判断结直肠癌淋巴结有无转移并无统一的形态学标准,曾用于判断结直肠癌淋巴结转移的标准包括任何可观察到的淋巴结、淋巴结直径≥3、≥5、≥8 和≥10mm 等,其诊断准确性为43% ~85%不等[1]。有文献报道淋巴结的大小不是判断胃肠道恶性肿瘤淋巴结转移的可靠指标,小淋巴结可能会有微转移,而增大的淋巴结也可能是炎性反应的结果[2,3]。因此,判断淋巴结有无转移不仅要考虑淋巴结大小,还应该结合淋巴结的形态、边缘以及内部的信号特征等综合评估[4]。
18F-FDG PET -CT 不仅能提供淋巴结解剖定位、大小,而且还能提供代谢信息,对淋巴结转移的判断有其独特的优势。以往文献报道的转移淋巴结多以SUVmax≥2.5 为标准,但本研究以SUVmax≥2.5作为诊断结直肠癌N 分期标准时准确性仅为53.8%。Tsunoda 等[5]对不同SUVmax 值在诊断结直肠癌淋巴结转移方面的价值进行了研究,结果显示SUVmax≥1.5 为标准诊断淋巴结转移的准确性相对最高。张占文等[6]的研究显示淋巴结短径5 ~8mm,结合淋巴结SUVmax2.0 ~3.0 作为诊断直肠癌N 分期的准确度最高。本研究旨在探索18F -FDG PET -CT 上不同诊断标准在结直肠癌术前N 分期方面的诊断价值,因此本研究以淋巴结短径≥3、5、8、10mm,SUVmax≥1.0、1.5、2.0、2.5 为标准,分别统计不同诊断标准在判断结直肠癌术前N 分期方面的准确度。根据研究结果笔者发现,以淋巴结短径≥5mm,SUVmax≥1.5 诊断结直肠癌术前N 分期的准确度相对较高且可操作性较好,准确度分别为66.3% 和63.8%。Tsunoda 等[5]研究显示18F - FDG PET - CT诊断结直肠癌区域淋巴结转移的准确度为69.3%。Kim 等[7]研究显示,18F -FDG PET -CT 诊断直肠癌淋巴结转移的准确度为70%。王晓燕等[8]以18F -FDG PET-CT 上SUVmax≥2.5,淋巴结短径>8mm或短径<8mm 的成簇淋巴结(>3 个)为标准,诊断结直肠癌淋巴结转移的准确度为82.5%。结直肠癌病灶周围的淋巴结常因炎症而表现为高代谢,容易导致假阳性结果[5]。本研究中有9 例因高代谢炎性淋巴结(SUVmax≥1.5)而误为转移或导致过分期。癌肿周围的引流血管断面有时也会因FDG 摄取增高而被误认为是转移的淋巴结,增强PET -CT 有助于鉴别血管结构[9]。本研究中有8 例小淋巴结(<3mm)发生微转移而误诊为N0或导致过低分期;淋巴结过小、转移癌组织较少导致FDG 摄取不高是导致PET-CT 图像上假阴性的主要原因。值得一提的是,本研究中黏液腺癌及印戒细胞癌较容易发生淋巴结转移(7 例患者中有6 例发生淋巴结转移),此病理类型虽然原发灶都表现为高代谢灶,但其转移性淋巴结多为低代谢小淋巴结(63 枚转移淋巴结PET -CT 仅发现12 枚),考虑跟肿瘤组织细胞成分少且分泌较多黏液有关,是造成PET-CT 假阴性的一个重要原因[10,11]。
在本研究中,虽然回顾性资料统计提示以淋巴结短径≥5mm,SUVmax≥1.5 作为标准诊断对结直肠癌术前N 分期的准确性相对较高且可操作性较好,但是淋巴结短径≥3mm 与≥5mm 在统计学上无明显差异,SUVmax≥1.5 与SUVmax≥1.0 和SUVmax≥2.5无统计学差异,笔者推断可能的原因有两个:一是本研究的样本量偏少,二是淋巴结短径≥5mm 、SUVmax≥1.5 可能并非诊断结直肠癌术前N 分期的最佳界值。由于本研究回顾性分析不能做到淋巴结一一对应,无法勾画出淋巴结大小、SUVmax 值与淋巴结转移的ROC 曲线,因此不能得到淋巴结大小和SUVmax 的最佳界值,这是本研究的不足之处,需要在后续的前瞻性研究中深入探讨此问题。
综上所述,18F -FDG PET -CT 在结直肠癌术前N 分期方面的回顾性分析提示,以淋巴结短径≥5mm,SUVmax≥1.5 作为标准诊断的准确度相对较高且可操作性较好,Kappa 检验与手术病理结果有较好的一致性,18F-FDG PET-CT 在结直肠癌术前N 分期方面有一定的临床价值。以淋巴结大小和SUVmax 高低作为诊断标准,都会出现假阳性和假阴性的可能,如果能同时提供特异性和假阴性指标,对临床选择可能更有意义。
1 Kim JH,Beets GL,Kim MJ,et al. High -resolution MR imaging for nodal staging in rectal cancer:are there any criteria in addition to the size?[J].Eur J Radiol,2004,52:78 -83
2 Monig SP,Schroder W,Baldus SE,et al. Preoperative lymph - node staging in gastro - intestinal cancer - correlation between size and tumor stage[J].Onkology,2002,25:342 -344
3 Smith NJ,Bees N,Barbachano Y,et al. Preoperative computed tomography staging of nonmetastatic colon cancer predicts outcome:implications for clinical trials[J]. Br J Cancer,2007,96:1030 -1036
4 Brown G,Richards CJ,Bourne MW,et al. Morphologic predictors of lymph node status in rectal cancer with use of high -spatial -resolution MR imaging with histopathologic comparison[J]. Radiology,2003,227:371 -377
5 Tsunoda Y,Ito M,Fujii H,et al.Preoperative diagnosis of lymph node metastases of colorectal cancer by FDG-PET/CT[J]. Jpn J Clin Oncol,2008,38:347 -353
6 张占文,胡平,张杰,等.4O 层18F-FDG PET/CT 在直肠癌N 分期中的应用[J].重庆医学,2011,40:778 -780
7 Kim DJ,Kim JH,Ryu YH,et al. Nodal staging of rectal cancer:high-resolution pelvic MRI versus18F - FDG PET/CT[J]. J Comput Assist Tomogr,2011,35:531 -534
8 王晓燕,饶良俊,易芹芹,等.18F -氟代脱氧葡萄糖PET/CT 与增强CT 在结直肠癌区域淋巴结转移诊断价值对比分析[J]. 中华医学杂志,2013,93:2288 -2291
9 Tateishi U,Maeda T,Morimoto T,et al. Non -enhanced CT versus contrast- enhanced CT in integrated PET/CT studies for nodal staging of rectal cancer[J]. Eur J Nucl Med Mol Imaging,2007,34:1627-1634
10 Stahl A,Ott K,Weber WA,et al. FDG PET imaging of locally advanced gastric carcinomas:correlation with endoscopic and histopathological findings[J].Eur J Nucl Med Mol Imaging,2003,30:288 -295
11 Yoshioka T,Yamaguchi K,Kubota K,et al. Evaluation of 18F -FDG PET in patients with advanced,metastatic,or recurrent gastric cancer[J].J Nucl Med,2003,44:690 -699

